神经组织生化或称神经生化学(neurochemistry),半个多世纪以来已发展成为一门独立的学科。然而,由于神经系统结构和功能极为复杂以及研究方法上的难度较大,迄今积累的资料还很不完备,特别是有关代谢与功能间的内在联系,很多问题还不十分清楚。因此,本章仅就与医学关系较密切的某些问题,有选择地加以介绍,而不是系统地阐述。
第一节 血脑屏障
大约在一百年前就已发现,给动物注入活性染料,全身组织都染上色而唯独脑组织却不染色。但是如果把染料直接注入蛛网膜下腔,则脑组织迅速被染色。以后的大量实验研究表明,有些物质完全不能由血进入脑组织间液;有些物质进入很缓慢;而有些物质的进入颇为迅速。总之,在血-脑之间有一种选择性地阻止某些物质由血人脑的“屏障(barrier)”存在,称为血脑屏障(BBB)。血脑屏障的功能在于保证脑的内环境的高度稳定性,以利于中枢神经系统的机能活动,同时能阻止异物(微生物、毒素等)的侵入而有保护作用。
一、血脑屏障的结构特点
血脑屏障的物质基础是脑的毛细血管,它与其他组织中的毛细血管不同,有以下三个特点:
(1)脑毛细血管内皮细胞间相互“焊接”得十分紧密,不象其他组织毛细血管壁那样有较大的缝隙;(2)毛细血管内皮细胞外的基底膜(basement membrane)是连续的;(3)毛细血管壁外表面积的85%都被神经胶质细胞的终足所包绕。由此可见,物质由血液进入脑组织间液要穿越较多的层次,包括脂性的(质膜)和非脂性的(基底膜)膜的结构。其中,穿越毛细血管内皮细胞是关键性的步骤。与其他组织,譬如肌肉组织的毛细血管内皮细胞相比较,脑毛细血管内皮细胞的胞饮作用(pinocytosis)很微弱。因此,对脑毛细血管内皮细胞来说,借胞饮作用转运物质(大分子和电解质)的能力是很有限的,这就更加强了脑毛细血管壁的屏障功能。
二、物质通过血脑屏障的方式
物质可以通过扩散(diffusion)或载体转运(mediated transport)的方式由血液进入脑组织,从脑组织进入血液。
以扩散方式通过血脑屏障的物质最主要的是水和气体。静脉注入重水(D2O)的示踪实验表明,脑中水分子交换的半寿期为12-25秒。水可以根据血浆渗透压的改变而自由进出脑组织。临床上采用静脉注入甘露醇一类的物质,提高血浆渗透压,可使脑脱水以降低颅内压,O2、CO2、N2O等气体以及挥发性麻醉剂亦可迅速扩散进入脑组织。脂溶性物质及脂溶剂容易透过亲脂性的质膜,因而也能迅速扩散入脑,已知扩散最快的物质是乙醇。
葡萄糖、氨基酸和各种离子是靠载体转运的。由于葡萄糖载体转运系统的立体特异性(stereospecificity),只有D-葡萄糖才能进入脑,而L-型的则不能。各种氨基酸进入脑组织的快慢不同,这与有无相应的氨基酸载体以及载体的量与质(特异性)有关。引人注目的是凡营养上必需的氨基酸大都转运迅速,而难以越过血脑屏障的都是非必需氨基酸。各种离子的转运快慢也不同,但都比进出其他组织的速度慢得多。可扩散入脑的物质一旦解离形成离子则越过血脑屏障的速度减慢,例如NH3、水杨酸(未解离者)、CO2分别较NH+4、水杨酸根、HCO3-进入脑组织快。H+的转运也很慢,与CO2的迅速扩散呈鲜明对比。注意到这个特点对理解血液pH与脑组织pH的不一致很重要,即血液的Pco2比血液pH更能反映脑组织的酸碱度。当用碱性药物(NaHCO3)纠正糖尿病酸中毒时要谨慎,因为CO2的扩散比HCO3-的进入脑组织要快,这就有可能使脑组织的pH进一步下降。
三、影响因素
物质通过血脑屏障的难易取决于两方面的影响因素:一是物质本身的性质和状态;另一是血脑屏障的结构和功能。
(一)物质的亲脂性与亲水性
细胞膜是以类脂为基础的双分子层结构,所以凡是亲脂性强的物质就易于透过细胞膜;反之,亲水性强者则不易透过。而物质的亲脂性与亲水性又取决于物质的化学结构:含极性基团多者亲水性强;含疏水基团多者则极性小而亲脂性强。亦即物质的极性与亲脂性之间呈负相关。在药物学上应用这一原理,可以把某些作用于中枢神经系统的药物进行化学修饰,降低其极性,增强其亲水性,使其能更迅速地透过血脑屏障,从而提高药物的疗效。例如把巴比妥转变为苯巴比妥而提高催眠药的效果。
(二)与血浆蛋白的结合
在一般组织的毛细血管,亲水性物质大多通过内皮细胞之间的缝隙并越过基底膜而进入组织内(通透性,permeability)。但是,如前所述,脑毛细血管内皮细胞之间“焊接”十分紧密,通透性较小,实验证明,分子量大于2,000的物质即不能由内皮细胞联接处通过。因此,与血浆蛋白结合的物质就难以通过血脑屏障,而实际上血浆中的许多物质(激素、脂肪酸、胆红素等)又都是与血浆蛋白结合而运输的,由于物质与血浆蛋白的结合是可逆的,所以结合与解离的动态平衡直接影响到物质通过血脑屏障的速度。例如患高胆红素血症(参看肝脏生化)的婴儿,血中胆红素与血浆蛋白结合,从而防止胆红素进入脑组织造成损害。但是如果此时给以磺胺类药物。由于后者能同胆红素竞争与血浆蛋白的结合,使大量游离的胆红素(亲脂性)迅速通过血脑屏障,可引起严重的后果。
(三)载体转运系统
脑毛细血管内皮细胞膜上有多种载体蛋白,能促进一些本来难以通过血脑屏障的极性分子的转运。已经肯定的载体系统有:(1)已糖载体;(2)中性氨基酸载体;(3)碱性氨基酸载体;(4)短链单羧酸载体等。
葡萄糖载体具有较强的特异性已如前述。此外,甘露糖亦能较快进入脑组织,半乳糖次之, 而果糖则很难通过血脑屏障。由于缺乏酸性氨基酸载体,所以谷氨酸和天门冬氨酸是难以通过血脑屏障的。必需氨基酸特别是芳香族的和支链的最容易通过血脑屏障,蛋氨酸的通过亦较迅速。尽管能通过血脑屏障的氨基酸甚多,但已发现的氨基酸载体却只有少数几个,因此,至少有些氨基酸载体的特异性不是很强的,于是就有可能出现竞争的现象。例如,患先天性苯丙酮酸尿症(phenylketonuria,PKU)的小儿,血中苯丙氨酸浓度太高,影响色氨酸进入脑组织,导致小儿脑发育不全。
(四)生物转化作用
某些物质在通过脑毛细血管内皮细胞时将遭受到胞浆内酶系统的作用而被破坏,所以即使能进入毛细血管内皮细胞的物质也不一定都能通过血脑屏障而进入脑实质。现已发现脑毛细血管内皮细胞含有单胺氧化酶(MAO)可使属于单胺类的神经递质(如儿茶酚胺,5-羟色胺等,见后)氧化分解,又γ-氨基丁酸(GABA)虽然可被脑毛细血管内皮细胞摄入,但却又遭受细胞内GABA转氨酶的作用而被破坏,如果用β-氨基乙酸抑制该酶则GABA是可以进入脑组织的。脑毛细血管壁内的这种生物转化作用加强了血脑屏障的屏蔽功能,使脑组织的内环境免受血液中化学成份骤然变动的影响。
(五)发育的影响
新生儿血脑屏障发育不全,通透性较高。正在迅速生长的脑组织对某些积极进行代谢的物质摄取率大增,这可能是由于转运本身加快,也可能是由于代谢物的高转换率所致。
此外,脑的不同区域的血脑屏障也存在着差别。病理情况下,例如血管性脑水肿、脑肿瘤、以及电离辐射损伤等均可发生血脑屏障通透性的增高。
第二节 脑代谢的某些特点
一、能量供应(Energy Supply)
脑的活动瞬息万变,需要大量能量的及时供应。脑细胞本身的生物高分子(核酸及蛋白质)的合成以及神经递质的合成与释放固然都是耗能的过程,但这些尚不足以说明为什么脑细胞的功能活动较之其他组织细胞要消耗更多的能量。脑的能量消耗主要在于经常不断地把Na+泵出细胞外,使去极化(depolarization)后的膜迅速恢复膜电位,以维持神经的兴奋和传导。脑的代谢率(metabolic rate)是很高的,它可以用单位时间的耗氧量(oxygenconsumption)和基质消耗量或产物生成量作指标来表示,如表14-1。
表14-1 正常青年男子的脑血流量和代谢率
|
速率 |
|
每百克脑组织 |
全脑 |
| 血流量(ml/分) |
57 |
798 |
| 耗氧量(ml/分) |
3.5 |
49 |
| 葡萄糖消耗(mg/分) |
5.5 |
77 |
| CO2生成(ml/分) |
3.5 |
49 |
脑血流量占心输出量的15%,耗氧量占全身总耗氧量(约250ml/分)的20%,然而脑的重量只不过占体重的2%。分析流入和流出脑组织血液的化学成分(动?静脉差法)发现,除了葡萄糖外,其他可作为能源的物质没有明显的减少。由上表可见每百克脑组织每分钟产生的二氧化碳和消耗的氧均为3.5ml(156微克分子),呼吸商(respiratoryquotient)为1。再者,按化学计算(1克分子葡萄糖完全氧化要消耗6克分子的氧),葡萄糖的消耗率还稍高于氧的消耗率。
这些事实综合起来说明,脑组织是以葡萄糖的氧化来供能的,甚至可以说,至少在正常条件下,脑组织唯一利用糖作为能源。因为脑中糖原含量很少(小于0.1%),所以必须依赖血糖的供应。虽然脑组织还可以利用酮体,但必须以低血糖为前提,例如在饥饿引起酮血症(ketonemia)的情况下。如果血糖和血酮体均增高时(糖尿病酮血症),脑仍然优先利用葡萄糖以供能。有人认为,脑利用酮体作能源是对饥饿时低血糖的适应,长期慢性饥饿的病人,脑的耗氧量的一半可用来氧化酮体。
脑细胞含有完整的糖酵解(EMP)酶系,已糖激酶活性约为其他组织的20倍。但是即使最大程度地发挥糖酵解的作用也不能满足供能的需要,而必须依赖糖的有氧氧化。所以氧的供给一刻也不能中断。由于脑组织主要依赖糖的有氧氧化供给能量,所以它对缺糖和缺氧均极敏感。血糖下降50%即可致昏迷,而中断(流向脑的)血流几分钟就可引起死亡。临床上使用大剂量胰岛素做为治疗手段也可以引起昏迷。胰岛素对脑的这种影响,现在认为是间接作用的结果,也就是因为胰岛素降低了血糖之故。因为胰岛素是大分子物质,它不能透过血脑屏障,这和对其他组织或周围神经组织的作用不同。在那些组织,胰岛素的作用可能主要是直接影响其对葡萄糖的摄取。
脑内ATP的水平甚高,它的合成和利用均很迅速。据测定,脑内ATP末端磷酸基的半数更新时间平均只有约3秒钟,脑组织的磷酸肌酸(CP)水平比ATP还要高,它可看作是ATP末端高能磷酸键的一种贮存形式。在磷酸肌酸激酶(CPK)的催化下,ATP和CP可相互转变。
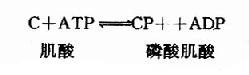
这是一个等能反应,因此在相互转变中不致于有能量的丢失。脑中CPK活性较强,有利于能量的贮存和动用。此外,脑组织中还有活性较强的肌激酶(myokinase),它可催化下列反应。此反应的意义在于“挖掘潜力”,即充分利用ATP中的两个高能磷酸键。
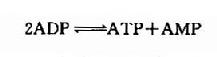
上述两种激酶都是维持脑内高水平ATP的有力保证。
二、类脂的组成和代谢
除脂肪组织外,脑是全身含脂类最多的组织,但脂肪组织主要含甘油三酯(贮存脂),而脑组织中的脂类几乎全是类脂。脑干重的1/2是脂类,这是就全脑平均而言,如果分别测定脑灰质和脑白质的化学成分,就会发现灰质含水份和蛋白质较多,脂类仅占干重的1/3;而白质中的脂类含量较多,约占干重的55%。
表14-2 正常成人脑的脂类组成
| 成分 |
灰质 |
白质 |
|
温重(%) |
干重(%) |
总脂(%) |
温重(%) |
干重(%) |
总脂(%) |
| 水 |
81.9 |
|
|
71.0 |
|
|
| 总脂 |
5.9 |
32.7 |
100 |
15.6 |
54.9 |
100 |
| 总磷脂 |
4.1 |
22.7 |
69.5 |
7.2 |
25.2 |
45.9 |
| 胆固醇 |
1.3 |
7.2 |
22.0 |
4.3 |
15.1 |
27.5 |
| 总半乳糖苷脂 |
0.4 |
2.4 |
7.3 |
4.1 |
14.5 |
26.4 |
| 总神经节苷能 |
0.3 |
1.7 |
|
0.05 |
0.18 |
|
由上表可见,以湿重计,脑白质中脂类含量约三倍于灰质。这种差别主要是由于白质中的神经纤维外被以髓鞘(myelin sheath),而髓鞘的脂类可高达干重的70-80%。
脑中的类脂主要用以构成神经元(neurone)的质膜和髓鞘。这些膜性结构与其他组织细胞的膜结构有共同之处,即都是由类脂与蛋白质构成的复合物,但在类脂的组成和代谢上亦有一些特点。尤其是髓鞘,它含有某些特殊的类脂成分,这些成分或者仅见于髓鞘,或者髓鞘中含量较多,而在其他组织中则较少见,例如缩醛磷脂(plasmalogen)和脑苷脂(cerebroside)。
脑不从血中摄取脂肪酸,本身也不含游离脂肪酸,那么组成这些类脂的脂肪酸是从哪里来的呢?实验证明,脑中的脂肪酸和胆固醇都可由乙酰CoA合成,而乙酰CoA的主要来源还是葡萄糖。
髓鞘形成(Myelination)之前的未成熟的脑组织含胆固醇和磷脂较多,而含脑苷脂极少,脑苷脂合成酶系的活性也极低。当髓鞘形成时,此酶系的活性升高,脑苷脂的含量亦相应增多,髓鞘形成与神经系统的发育和功能密切相关,而髓鞘脱落(demyelination)是神经系统疾病的重要的病理改变之一。髓鞘的代谢特点是正在进行髓鞘形成时代谢很快,一旦形成之后就变得很慢,成为体内最稳定的一种结构。据认为,这是由于髓鞘缺乏催化类脂分解代谢的酶系。已经形成的髓鞘,除了个别成分(如三磷酸肌醇磷脂)有较高的更新率外,其他磷脂和胆固醇等的更新率均甚低。
三、谷氨酸的代谢与功能
脑的游离氨基酸组成与血浆有很明显的差别,这是由于血脑屏障的特点和脑本身氨基酸代谢特点造成的。脑和血浆中某些游离氨基酸的含量对比如表14-3。
表14-3 人脑和血浆中某些游离氨基酸的含量
| 氨基酸 |
脑 |
血浆 |
|
微克分子/克 |
微克分子/毫升 |
| 谷氨酸 |
10.6 |
0.05 |
| N-乙酰天门冬氨酸 |
5.7 |
- |
| 谷氨酰胺 |
4.3 |
0.7 |
| γ-氨基丁酸 |
2.3 |
- |
| 天门冬氨酸 |
2.2 |
0.01 |
| 色氨酸 |
0.05 |
0.05 |
由表14-3可见,脑中游离氨基酸以谷氨酸(Glu)含量最高,它比其在血浆中的浓度要高出200倍以上。谷氨酸、谷氨酰胺(Gln)和γ?氨基丁酸(GABA)三者含量总和约占脑中游离氨基酸总量的一半。所以,在脑的氨基酸代谢中,谷氨酸占有重要位置。
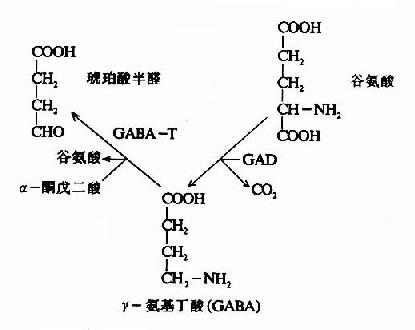
然而,谷氨酸难以通过血脑屏障,脑内谷氨酸来源于自身的合成,同位素示踪实验表明脑内谷氨酸合成的原料是葡萄糖,它来自血糖。葡萄糖进入脑细胞后先转变成α-酮戊二酸(α-KG),后者可在谷氨酸脱氢酶的催化下转变成谷氨酸,亦可经转氨基作用生成谷氨酸,一般认为后一途径更切合实际,因为谷氨酸脱氢酶(GDH)催化逆反应时K?mNH4+为8mM,远高于细胞内氨之浓度。谷氨酸在谷氨酰胺合成酶的作用下与氨结合成为谷氨酰胺,这是一个耗能反应(消耗ATP),脑中谷氨酰胺合成酶的活性强,其K?mNH4+仅为0.39mM。所生成的谷氨酰胺,与谷氨酸不同,可以通过血脑屏障而进入血中,这样,脑组织从血中摄入葡萄糖,通过代谢,还血液以谷氨酰胺,清除了脑中的氨,以免氨的积存危害脑的功能。
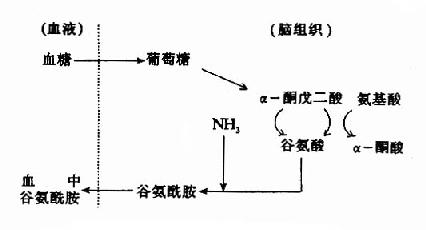
图14-1 脑中谷氨酸代谢与氨的消除
脑中谷氨酸代谢的另一个特点是脱羧生成γ-氨基丁酸(又名γ-氨酪酸GABA),催化此反应的酶是谷氨酸脱羧酶(GAD),它需要磷酸吡哆醛作辅酶。GABA是一种抑制性的神经递质,仅见于中枢神经系统。脑内GABA主要贮于灰质,特别是纹状体、黑质、小脑的齿状核等处。
GABA对中枢神经元有普遍性抑制作用。1963年曾有人提出,GABA能作用于突触前神经末梢,减少兴奋性递质的释放,从而引起抑制。这种效应称为突触前抑制(presynaptic inhibition)。GABA在脊髓中的作用就是以突触前抑制为主。在脑内则GABA主要是引起突触后抑制(postsynaptic inhibition)。睡眠时皮层释放GABA增多,因此有人认为GABA可能与睡眠、觉醒的生理机能有关。
 |
 |
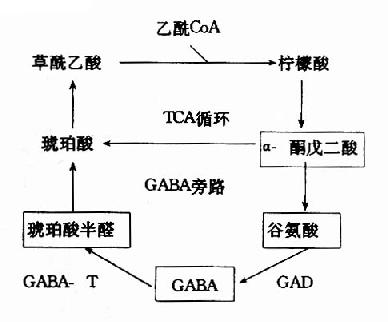
| 图14-2a 脑中TCA循环和GABA代谢旁路 |
图14-2b GAD和GABA-T的作用 |
在神经元胞体和突触(synapse)的线粒体内含有大量的γ-氨基丁酸转氨酶(GABA-T),它可催化GABA与α?酮戊二酸之间的转氨作用,生成琥珀酸半醛(succinic acid semialdehyde)和谷氨酸。这可看作是GABA灭活的一种方式。GABA-T也是需要磷酸吡哆醛作辅酶,但与GAD比较,它同磷酸吡哆醛的亲和力大,所以当体内维生素B6缺乏时,主要影响GAD的活性。例如,使用异烟肼治疗结核病时,由于异烟肼能与维生素B6(吡哆醛)结合成异烟腙(isoniazone),加速维生素B6从尿中排泄,引起脑组织内维生素B6浓度下降,GAD活性亦下降,结果GABA的合成受阻,容易使中枢过度兴奋而发生抽搐等症状。所以长期使用异烟肼时应合并使用维生素B6。此外,临床上对于惊厥、妊娠呕吐的病人,也常使用维生素B6,其道理也是提高脑组织内GAD的活性,使GABA生成增多,中枢抑制相对加强。
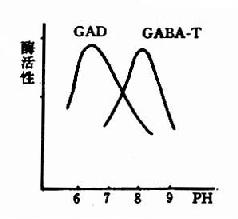
图14-3 GAD与GABA-T的作用最适pH
GABA经转氨作用后的产物琥珀酸半醛可脱氢生成琥珀酸,后者进入三羧酸循环而被氧化利用。因此,与脑组织中的三羧酸循环相连系,存在着一条GABA代谢旁路(GABa shunt)。
谷氨酸脱羧酶与γ-氨基丁酸转氨酶的协同作用对保持脑中GABA一定浓度有重要意义。两种酶的最适pH不同,GAD的最适pH为6.5,而GABA-T则为pH8.2。(图14-3)由此可见,脑细胞内pH稍有变动就可明显改变这两种酶的活性对比。当酸中毒时,脑中GAD活性增强而GABA-T活性减弱,可致脑中GABA水平上升,呈现中枢抑制;反之,当碱中毒时脑中GABA-T活性增强而GAD活性减弱,脑中GABA水平下降,易于发生痉挛。
尚须指出,谷氨酸对神经中枢有兴奋作用,而其脱羧产物GABA却有抑制作用,所以谷氨酸的代谢与中枢的兴奋和抑制调节有关。此外,通过GABA代谢旁路,也把脑的氧化代谢与兴奋抑制功能联系起来了。
第三节 神经递质(Neurotransmitter)的代谢
神经系统内存在着许多化学物质,但它们不一定都是递质(transmitter)。作为神经递质,必须具备几个基本条件:(1)被认为是递质的物质应特异性地存在于以该物质为递质的神经元中,而且,在这种神经元的末梢有合成该递质的酶系统;(2)递质在神经末梢内合成以后,通常是集中贮存在囊泡(vesicle)内,这样可以防止被胞浆内的其它酶所破坏;(3)当神经冲动到来时,神经末梢内的递质就自突触前膜释放入突触间隙;(4)递质通过突触间隙,作用于突触后膜的叫做受体的特殊部位,引起突触后膜离子通透性改变以及电位变化;(5)神经递质在发挥上述效应后,其作用应该迅速终止,以保证突触传递的高度灵活。作用的终止有几种方式:一是被酶所水解,失去活性;其次是被突触前膜“重摄取”,或是一部分为后膜所摄取;也有的部分进入血循环,在血中一部分被酶所降解破坏。
目前已知的神经递质种类很多,但主要的有乙酰胆硷、儿茶酚胺类(去甲肾上腺素和多巴胺)、5?羟色胺、GABA、某些氨基酸和寡肽等。
一、乙酰胆碱(Acetylcholine简写Ach)
乙酰胆碱是许多外周神经如运动神经、植物性神经系统的节前纤维和付交感神经节后纤维的兴奋性神经递质。
(一)合成和贮存
Ach由胆碱和乙酰CoA所合成。胆碱乙酰化酶(choline acetylase)催化下列反应:
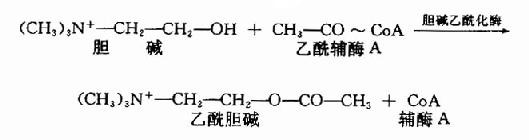
由于胆碱乙酰化酶位于胞浆内,因此设想Ach是先在胞浆内合成,然后进入囊泡贮存。平时囊泡中和胞浆中的Ach大约各占一半,且两者可能处于平衡状态。囊泡内贮存的Ach是一种结合型的(与蛋白质结合),而释放至胞浆时,则变为游离型。
(二)释放、重摄取和失活
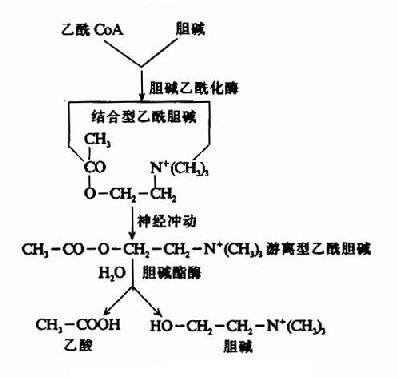
当神经冲动沿轴突到达末梢时,囊泡趋近突触膜,并与之融合、破裂,此时囊泡内结合型Ach转变为游离型Ach,释放入突触间隙。同时,还可能有一部分胞浆内新合成的Ach也随之释放。
Ach作用于突触后膜(突触后神经元或效应细胞的膜)表面的受体,引起生理效应。已经确定Ach受体是一种分子量为42,000的蛋白质,通常以脂蛋白的形式存在于膜上。
Ach在传递信息之后和受体分开,游离于突触间隙,其中极少部分在突触前膜的载体系统作用下重新被摄入突触前神经元。大部分Ach是在胆碱酯酶的作用下水解成胆碱和乙酸而失去活性,也有一部分经弥散而离开突触间隙。关于乙酰胆碱在神经末梢中的代谢,可总结如图(14-4,14-5)。
 |
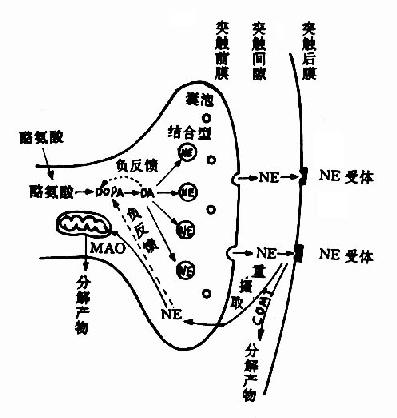 |
| 图14-5 乙酰胆碱的代谢 |
图14-4 突触部位Ach的动态 |
二、儿茶酚胺类(Catecholamines)
儿茶酚胺类是指含有邻苯二酚基本结构的胺类。体内具有生物活性的儿茶酚胺包括多巴胺(dopamine,DA)、去甲肾上腺素(norepinephrine,noradrenaline,NE)和肾上腺素(epinephrine,adrenalin,E)。它们的结构如下。
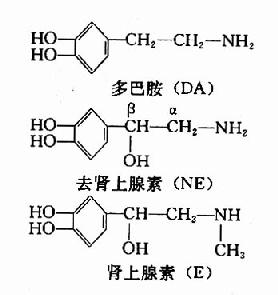
去甲肾上腺素和肾上腺素既是肾上腺髓质所分泌的激素,又是交感和中枢神经系统中去甲肾上腺素能纤维的神经递质。NE在中枢内分布广泛,含量较多,E则少,因此我们着重介绍NE的代谢。DA则主要集中在锥体外系,也是一种神经递质。
(一)儿茶酚胺的生物合成
神经组织中儿茶酚胺的合成原料来自血液中的酪氨酸,其合成过程如图14-6。
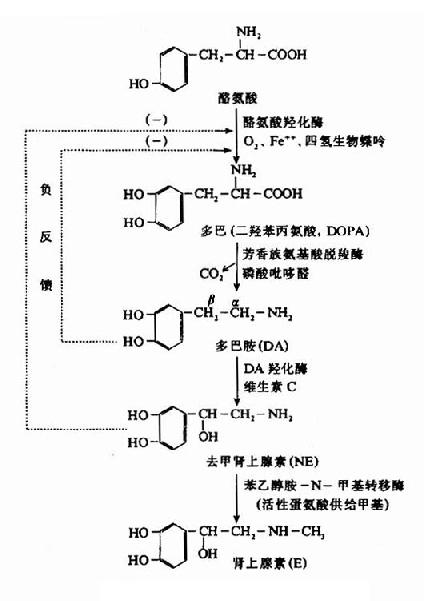
图14-6 儿茶酚胺类的生物合成
在上述过程中,第一步有酪氨酸羟化酶参加,它位于去甲肾上腺素能神经纤维的胞浆内,含量少,活性低,成为NE生成的限速酶,四氢生物蝶呤是它的辅酶,O2和Fe++也是合成时必不可少的因素;第二步反应是由胞浆中芳香族氨基酸脱羧酶所催化,这酶的特异性不高,和一般氨基酸脱羧酶一样,要求磷酸吡哆醛作为辅酶;第三步是多巴胺羟化酶催化的氧化反应,氧化发生在β碳原子上,此酶不存在于胞浆而是附于囊泡内壁,属于含Cu++的蛋白质,并需要维生素C为辅助因子。
从以上各酶的亚细胞水平分布可以了解,合成NE的最后一步只能在囊泡内进行,NE合成量不仅受酪氨酸羟化酶限速调节,而且当神经末梢胞浆中游离的NE浓度过高时,还可以因反馈性抑制酪氨酸羟化酶的作用而减少NE的合成。
苯乙醇胺-N-甲基转移酶主要见于肾上腺髓质细胞,可使NE甲基化生成肾上腺素。此酶在脑内虽有少量存在,但一般认为正常时哺乳类脑内的肾上腺素含量极少。有人认为,如果苯乙醇胺?N?甲基转移酶活性过高,可以使多巴胺直接变成N?甲基多巴胺等物,造成这些递质的代谢紊乱,这可能是精神分裂症的原因之一。
(二)去甲肾上腺素(NE)
1.贮存和释放 NE在囊泡内合成后就地贮存。它和ATP、嗜铬颗粒蛋白等疏松地结合在一起,这样,就使NE不易渗入胞浆而遭单胺氧化酶的破坏。当神经冲动到达末梢时,突触前膜附近的囊泡便与前膜融合,破裂并生成小孔。这时囊泡内的NE连同嗜铬颗粒蛋白等一起被释放入突触间隙。
2.突触间隙中NE的去向 释放入突触间隙的NE能与突触后膜上的NE受体结合,产生生理效应。然后,约有3/4的NE重新被突触前膜所摄取。摄入胞浆后的NE又可进入囊泡贮存。重摄取是一种耗能过程,与突触前膜上的Na+,K+?ATP酶系统及囊泡膜上的Mg++-ATP酶系统有关。另外一部分NE则为后膜所摄取,并在那里被分解灭活。还有一部分是在突触间隙中被破坏或逸入血液。除了被突触前膜和囊泡重摄取的NE可再供利用外,其余的NE大都遭到酶促降解而灭活。NE的酶促降解如图14?所示,单胺氧化酶(MAO)和儿茶酚-O-甲基转移酶(catechol?o?transmethylase,COMT)是催化儿茶酚胺分解的两种主要的酶,它们不仅存在于神经组织内,而且广泛地分布于非神经组织,神经元的线粒体膜上也很多。NE受MAO作用,首先氧化脱氨基生成醛,后者再变成醇或酸。3-甲氧基-4-羟基苯乙二醇(MHPG)是中枢内NE的主要降解产物。在外周则以氧化成香草基扁桃酸(VMA)为主。血液循环中的NE(主要是激素),则在肝、肾等组织经COMT作用变成甲氧基代谢产物而排泄。现在,临床上常测定尿中VMA含量,作为了解交感神经功能的指标,患嗜铬细胞瘤和神经母细胞瘤时,由于肿瘤组织也产生NE或E,其代谢产物VMA相应增多,故在诊断上颇有意义。
关于NE在突触部位的动态可用图14-8表示。
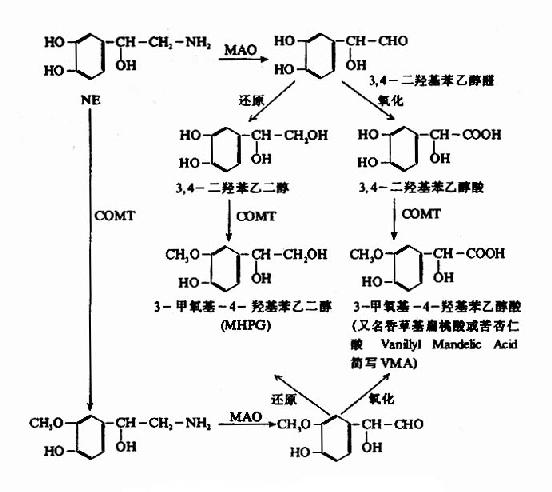
图14-7 去甲肾上腺素的分解代谢
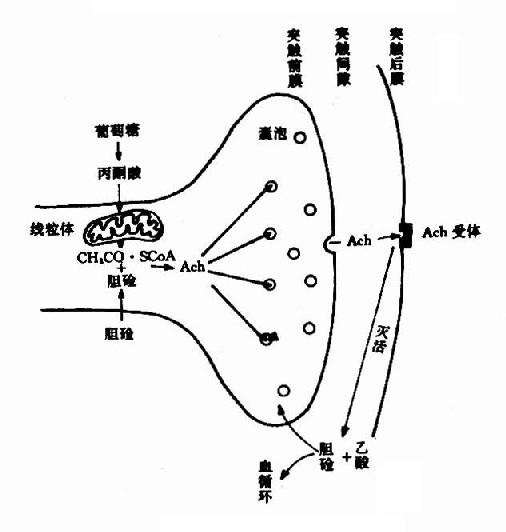
图14-8 突触部位NE的动态
中枢神经系统内的去甲肾上腺素能神经元胞体集中在延脑和桥脑,其通路都已研究明确。但是NE在中枢究竟是抑制性还是兴奋性的递质,目前尚不能肯定,可能随部位不同而异。NE所引起的生理效应也很难用简单的术语“兴奋”、“抑制”来表达。根据一些动物实验观察到,NE可引起动物嗜睡,体温降低,出现摄食行为。有人认为,脑内NE减少,可表现出精神抑郁;反之,过量可表现出狂躁。总之,脑内NE的功能可能和体温、摄食行为、镇痛、心血管系统和精神状态的调节有密切关系。
(三)多巴胺(DA)
在儿茶酚胺类递质的生物合成过程中,多巴胺是去甲肾上腺素的前体。体内凡有NE的组织,其中必然也有DA。由于DA在中枢某些部位中浓度很高,而且它的分布又与NE不平行,所以一般认为它本身也是一种独立的神经递质。
脑内多巴胺的作用是多方面的,它可能和躯体运动功能的加强,垂体内分泌机能的加强以及精神活动的调节都有关系。
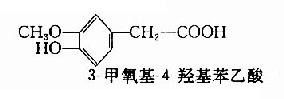
多巴胺能神经末梢中的囊泡是贮存DA的场所。这种囊泡不同于NE囊泡,前者不含多巴胺?β?羟化酶,所以不致将DA羟化成NE。此外,在去甲肾上腺素能纤维中,NE囊泡对贮存物的要求是β?位置上有羟基,而DA结构上没有β?羟基。DA的贮存、释放和酶促降解都和NE十分相似,而更新速度则较NE快。脑内DA的代谢产物主要是3-甲氧基-4-羟基苯乙酸(homovanillic acid简写HVA,又名同型香草酸)
三、5-羟色胺(5-ydroxytryptamine 简写5-HT)
5-羟色胺又名血清紧张素(serotonin),最早是从血清中发现的。中枢神经系统存在着5-?色胺能神经元,但在脊椎动物的外周神经系统中至今尚未发现有5-羟色胺能神经元。
由于5-羟色胺不能透过血脑屏障,所以中枢的5-羟色胺是脑内合成的,与外周的5-羟色胺不是一个来源。用组织化学的方法证明,5-羟色胺能神经元的胞体在脑内的分布主要集中脑干的中缝核群,其末梢则广泛分布在脑和脊髓中。
(一)合成、贮存和释放
5-羟色胺的前体是色氨酸。色氨酸经两步酶促反应,即羟化和脱羧,生成5-羟色胺。此过程在某种程度上和儿茶酚胺的生成相似。
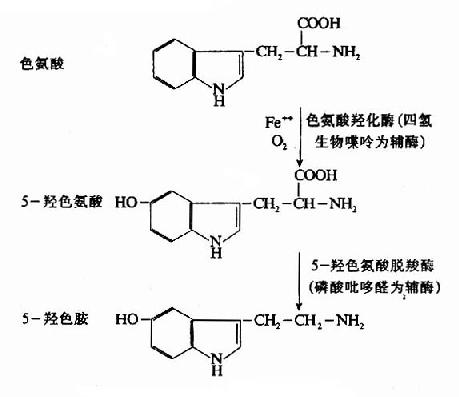
图14-9 5-HT的生成
色氨酸羟化酶象酪氨酸羟化酶一样,需要O2、Fe++以及辅酶四氢生物蝶呤。但脑内这种酶的含量较少,活性较低,所以它是5-HT生物合成的限速酶。此外,脑内5-HT的浓度影响色氨酸羟化酶的活性,从而对5-HT起着反馈性自我调节作用。血中游离色氨酸的浓度也影响脑内5-HT的合成,当血清游离色氨酸增多时(例如给大鼠腹腔注射色氨酸后),进入脑的色氨酸就增多,从而加速了5-HT的合成。
(二)重摄取和降解
和儿茶酚胺类递质一样,释放到突触间隙的5?HT,大部分被突触前神经末梢重摄取,而且重摄取后,部分进入囊泡再贮存,部分则被线粒体膜上的单胺氧化酶(MAO)所氧化:
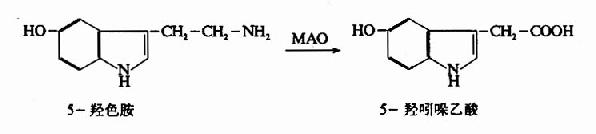
这就是脑内5-HT降解的主要方式,5-羟吲哚乙酸(5-hydroxyindolacetic acid)无生物活性。
检查5-HT对各种神经元的作用时发现,5-HT可使大多数交感节前神经元兴奋,而使付交感节前神经元抑制。损毁动物的中缝核或用药物阻断5-HT合成,都可使脑内5-HT含量明显降低,并引起动物睡眠障碍,痛阈降低,同时,吗啡的镇痛作用也减弱或消失。如果电刺激大鼠的中缝核,可影响其体温升高;另一方面,也观察到室温升高时大鼠脑内5-HT更新加速。这些现象揭示脑内5-HT与睡眠、镇痛、体温调节都有关系。还有人报导,5-HT能改变垂体的内分泌机能。此外,有人提出5-HT能神经元的破坏是精神性疾病时出现幻觉的原因。可见精神活动也与5?HT有一定的关系。
四、氨基酸和寡肽
脑内到处都存在着氨基酸。过去只认为它们是合成蛋白质的原料,或是蛋白质分解的产物。近年来,注意到某些氨基酸在中枢的突触传递中起着递质的作用。而且发现,凡是中性氨基酸,如γ?氨基丁酸、甘氨酸、β?丙氨酸等对中枢神经元表现抑制作用,而酸性氨基酸如谷氨酸、天门冬氨酸则表现为兴奋作用。
有一些小分子肽类在中枢神经系统中也具有神经递质同的作用。1975年发现的脑啡肽(enkephalin)是由五个氨基酸残基构成的寡肽,从猪脑中分离出来的脑啡肽又分为两型。
蛋氨酸型(蛋脑啡肽,Met-enkephalin):
H-酪-甘-甘-苯丙-蛋-OH
亮氨酸型(亮脑啡肽,Leu-enkephalin)
H-酪-甘-甘-苯丙-蛋-OH
它们是由脑细胞内合成的具有吗啡样作用的肽,故名脑啡肽。已知吗啡(morphine)要先与脑内的吗啡受体结合才能产生镇痛、欣快作用,而脑啡肽之所以有吗啡样作用也是因为它们能与吗啡受体结合。吗啡是外来的物质,而脑啡肽是内源性的。此外,已知脑内还有一些能与吗啡受体结合并产生吗啡样作用的其它的肽类,称之为内啡肽(endorphin),虽然还不能十分肯定这些肽类都是真正的神经递质(即完全符合前述神经递质的条件),但是,研究它们的作用对阐明脑的功能,特别对阐明痛觉原理是很有意义的。