结缔组织是人体中分布最为广泛的一种组织,包括骨、牙、软骨、肌腱、韧带、皮肤角质及血管等(表13-1)。其组成特点是细胞少而间质多,其细胞间质一般由基质(ground substance)和纤维(fiber)两部分组成。基质为无定形的胶态物质,主要成分为蛋白多糖(Proteoglycan)。纤维包括胶原纤维、弹性纤维和网状纤维,分别由胶原蛋白、弹性蛋白及网状蛋白构成。本章着重介绍蛋白多糖和胶原蛋白结构、功能及代谢。
表13-1 各种结缔组织的生化功能和大分子结构
(取自Karlson、Gerok、Groβ著《病理生化学》)
| 组织类型 |
机械性能 |
蛋白质 |
碳水化物* |
| 骨质 |
负荷重量** |
Ⅰ型胶原蛋白 |
硫酸软骨素 |
| (抗压、维持外形) |
|
透明质酸 |
|
|
硫酸角质素 |
| 肋软骨 |
抗压、减少摩擦 |
Ⅱ型胶原蛋白 |
硫酸软骨素 |
| 弹性好 |
|
(硫酸角质素) |
| 肌腱 |
抗张强度大 |
Ⅰ型胶原蛋白 |
硫酸皮肤素 |
| 弹性(延性)小 |
|
硫酸软骨素 |
| 大血管 |
延性强 |
弹性蛋白 |
硫酸软骨素 |
| 抗裂性强 |
Ⅲ型和Ⅰ型胶原蛋白 |
透明质酸、硫酸皮肤素不相识硫酸乙酰肝素 |
|
|
(肝素***) |
| 关节液 |
润滑防震 |
Ⅱ型胶原蛋白 |
透明质酸 |
| 皮肤 |
有中度延性和变形性而 |
Ⅰ型(80%)与Ⅲ型胶原蛋白、 |
硫酸皮肤素 |
| 具韧性 |
角蛋白 |
透明质酸 |
| 基底膜 |
变形性良好、分隔作用、 |
Ⅵ型和Ⅴ型蛋胶原蛋白、昆布 |
硫酸乙酰肝素(?) |
| 选择性渗透 |
氨酸粘连蛋白 |
|
| 角膜 |
透明、坚固 |
Ⅰ型与Ⅱ型胶原蛋白 |
硫酸角质素 |
|
|
软骨素(硫酸软骨素) |
*主要成分(多于50%)用黑体字印出,低于10%的组分在括号中。
**以钙盐沉着(羟磷灰石)计。
***肥大细胞的典型多糖。
第一节 蛋白多糖
结缔组织基质中蛋白质与多糖以共价和非共价键相连构成多种巨大分子称为蛋白多糖(proteoglycans)或粘蛋白(mucoproteins)。其分子组成以多糖链为主,蛋白质部分所占比例较小。往往一条多糖链上联结多条多肽链,分子量可达数百万以上。
一、化学结构
蛋白多糖中的多糖链为杂多糖,因其组成成分中均含氨基已糖,所以称为氨基多糖或糖胺聚糖(glycosaminoglycans)。人体组缔组织中常见的氨基多糖包括透明质酸(hyaluronicacid)、硫酸软骨素(chondroitin sulfate)、硫酸角质素(keratan sulfate)和肝素(heparin)等。
表13-2 人体中常见的糖胺多糖
| 名称 |
基本结构单位 |
主要存在部位 |
| 透明质酸 |
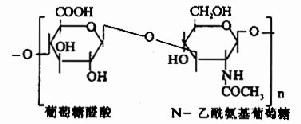 |
关节液、软骨、结缔组织基质、皮肤、脐带、玻璃体液 |
| 4-硫酸软骨素(硫酸软骨素A) |
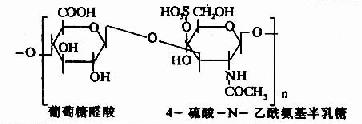 |
骨、软骨、角膜、皮肤、血管 |
| 6-硫酸软骨素(硫酸软骨素C) |
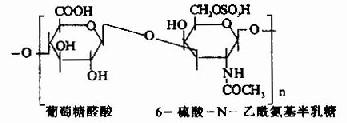 |
软骨、肌腱、脐带、椎间盘 |
| 硫酸皮肤素(硫酸软骨素B) |
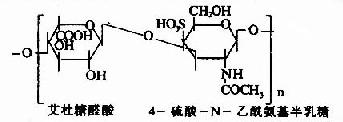 |
皮肤、韧带、动脉、心瓣膜 |
| 硫酸角质素 |
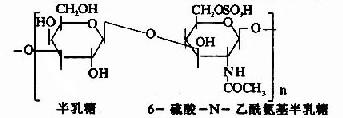 |
角膜、软骨、髓核 |
| 肝素 |
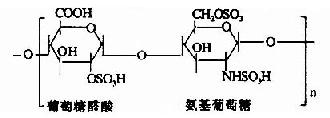 |
肺、皮肤、肝、肠等肥大细胞及嗜碱性白细胞内 |
其中硫酸软骨素B又称为硫酸皮肤素(dermatan sulfate)。各种糖胺多糖的结构单元为二糖单位,均含有乙酰氨基已糖和糖醛酸(硫酸角质素例外,不含糖醛酸而代之以半乳糖)。除透明质酸外都含硫酸。因而糖胺多糖为酸性,加之分子大具有粘性,故又称为酸性粘多糖(acidmucopolysaccharide,AMPS)。
经电子显微镜图形及实验推测,蛋白多糖为“瓶刷状”分子结构(图13-1),其蛋白多糖亚单位(“刷毛”)非共价附着于透明质酸主链上(backbone),其间相隔200-300A。
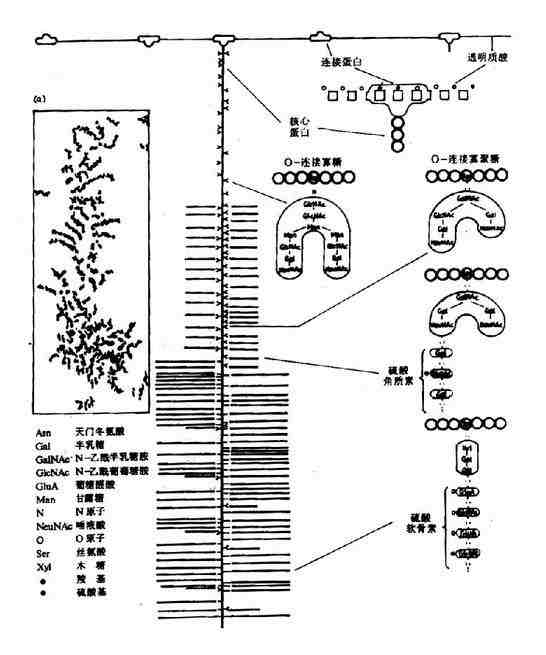
图13-1 蛋白多糖的分子结构
蛋白多糖亚单位由一个核心蛋白(coreprotein)和共价连接其上的糖胺多糖组成,后者主要为硫酸角质素和硫酸软骨素。人体中有多种不同的核心蛋白,分子量达200~300kD,是所有组织细胞中分泌的最大的一种多肽。核心蛋白高度伸展N-末端,形成一球状区,约60-70kD,非共价连接于透明质酸链上,另一种约40-60kD的连接蛋白(link protein)参与稳定球状区与透明质酸链的非共价连接。核心蛋白及多糖组成的亚单位可分为三区:
(1)N-端区:包括球状连接区,含有较少的寡糖链。
(2)富含寡糖区:为硫酸角质素寡糖链的主要附着区。寡糖链共价连接于核心蛋白分子中丝氨酸和苏氨酸残基侧链氧原子上。
(3)C-末端区:富含硫酸软骨素。通过半乳糖?半乳糖?木糖三糖连接于核心蛋白的丝氨酸残基。
蛋白多糖的透明质酸主链长度为4000~40,000?,可附着上百个核心蛋白,每条核心蛋白可结合50条硫酸角质素链和100条硫酸软骨素链,由此可见蛋白多糖分子巨大,分子量可高达数千万。
二、蛋白多糖的生理功能
蛋白多糖分子大,具高度亲水性,对保持结缔组织水分及与组织间物质交换均有重要作用。例如软骨组织中胶原纤维排列成网格状,网格间隙中填充蛋白多糖,因其有高度亲水性,吸附大量水份在其中,当软骨受压时,水分可被挤压出去,而减压后又可重吸进来。关节软骨无血管供应,其营养物质的交换主要靠运动产生压力变化使液体流动。由此可以解释长期不运动导致关节软骨的萎缩。
蛋白多糖的糖链上含有较多的酸性基团,对于细胞外液中Ca++、Mg++、K+、Na+等阳离子有较大的亲和力,因此能调节这些阳离子在组织中的分布。
蛋白多糖分子巨大,有较大的粘滞性,附着于组织表面,能缓冲组织之间的机械磨擦,因而具有润滑、保护作用。例如关节液中的蛋白多糖有润滑关节面的作用。类风湿关节炎患者,关节液中蛋白多糖减少,失去原有润滑作用,因而关节面易被破坏。
蛋白多糖与创伤的愈合亦有密切关系。皮肤创伤后的肉芽形成过程中,通常先有糖胺多糖的增生,进而促进胶原纤维的合成,其机理尚不清楚。近年来发现蛋白多糖可调节某些蛋白生长因子的作用。例如碱性成纤维细胞生长因子(basic fibrotlast growth factor,bFGF)结合于蛋白多糖的肝素或硫酸角质素链上,而且要以bFGF?糖胺多糖复合物形式与细胞表面受体结合。bFGF与肝素或硫酸角质素结合能保护bFGF免被降解。当核蛋白水解或肝素或硫酸角质素链部分降解时可释放出活性bFGF?糖胺多糖复合物,刺激细胞增殖及分化。其它一些生长因子也有类似作用机制,很明显,广泛和大量存在的蛋白多糖可局限这些生长因子在其分泌细胞短距离内作用。这对于组织的特有结构具有重要意义。
三、蛋白多糖的生物合成
蛋白多糖的合成首先按蛋白质生物合成的原理,在核糖体上合成多肽,并分泌入内质网中,在内质网中修饰过程中,由相应的转移酶催化活性单糖转移到氨基酸的侧链上,合成胺基多糖。但糖链的延伸和加工修饰在高尔基体进行。所以说多肽的合成受专一基因控制,而氨基多糖的合成主要由酶的分隔定位和对酶特异性所决定。
参与胺基多糖合成的各种单糖及其衍生物需先活化成活性单糖,即与二磷酸尿苷(UDP)结合,而各种单糖及其衍生物均可由葡萄糖转变而来,如下图13-2所示:
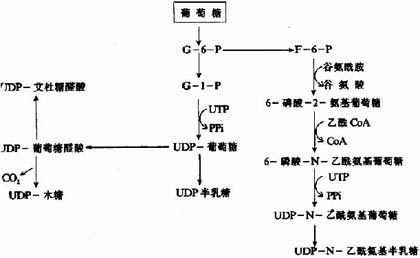
图13-2 各种单糖及其衍生物的来源
糖胺多糖合成的起始步骤是在木糖转移酶(Xylose transfevase)的催化下,将一分子木糖基连接到核心蛋白多肽链的丝氨酸残基上,形成O-糖苷键(O-glycosidicbond)。再由半乳糖转移酶(galactose transforase)催化依次转移两分子半乳糖,构成“木棸霔半”三糖连接区。然后再由高度特异的糖基转移酶作用逐渐按顺序延长,糖链合成后再进一步修饰。由差向异构酶催化将葡萄糖醛酸转变为艾杜糖醛酸,而硫酸基则是由活性硫酸根(PAPS)提供,由硫酸转移酶
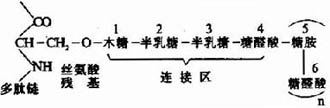
图13-3 糖胺多糖链与多肽链的连接
催化加到新合成的多糖链的氨基或羟基上。(图13-4为硫酸软骨素A合成过程示意图),当Vit A缺乏时硫酸转移酶活性下降,糖胺多糖合成受限,可引起组织生长、发育的障碍。
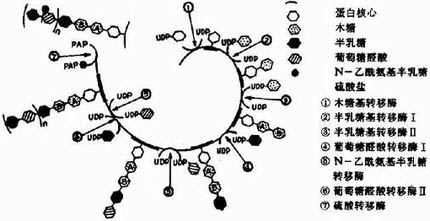
图13-4 硫酸软骨素A的合成示意
四、蛋白多糖的分解代谢
结缔组织基质中的蛋白多糖主要受组织蛋白酶D等的作用,部分肽链水解产生的带多糖链的小片段可被细胞吞噬,进而在溶酶体中逐步水解成各种单糖及其衍生物。因此,溶酶体是糖胺多糖分解的主要场所。
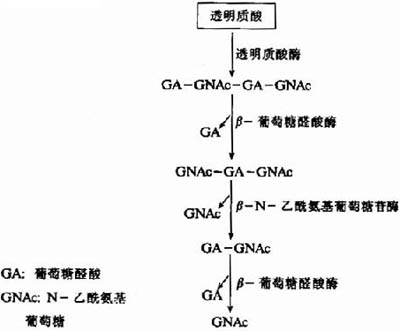
图13-5 透明质酸的水解
溶酶体中分解糖胺多糖的酶包括内切糖苷酶、外切糖苷酶及硫酸酯酶等。如图13-5所示透明质酸的水解过程:首先透明质酸酶(hyaluronidase)为一种内切酶,能水解透明质酸、硫酸软骨素A和C中的β-N-乙酰氨基已糖糖苷键,产生主要为四糖或六糖的寡糖。随后再由β-葡萄糖醛酸酶及β-N-乙酰氨基葡萄糖苷酶等外切酶进一步水解,成为单糖及其衍生物。
大多数糖胺多糖都含有硫酸基团。溶酶体中也存在多种硫酸酯酶,能水解各种硫酸酯键。有些糖苷酶有很强的底物特异性、不能水解带硫酸基的寡糖链,因此,硫酸酯酶的先天性缺乏会引起糖胺多糖分解障碍,导致粘多糖症(mucoplysaccharidoses)。
第二节 胶原蛋白
胶原蛋白(collagen)存在所有多细胞动物体内,是体内含量最多的一类蛋白质,存在于几乎所有组织中,是一种细胞外蛋白质,以不溶纤维形式存在,具高度抗张能力,是决定结缔组织韧性的主要因素。
一、胶原蛋白的结构
单个的Ⅰ型胶原分子分子量约285kD,宽14A,长约3000A。由三条多肽链组成。哺乳动物个体中有30种不同的多肽链构成16种不同的胶原,其中最常见的列于表13-3中。
表13-3 胶原的主要类型
| 类型 |
链组成 |
分布 |
| Type |
Chain Composition |
Distribution |
| Ⅰ |
[a1(Ⅰ)]2a2(I) |
皮肤、骨、肌腱、血管、角膜 |
| Ⅱ |
[a1(Ⅱ)]3 |
软骨、椎间盘 |
| Ⅲ |
[al(Ⅲ)]3 |
血管、新生儿皮肤 |
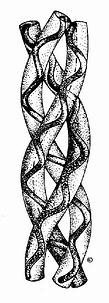
图13-6 胶原的右手超螺旋结构
胶原蛋白的氨基酸组成有如下特征:①甘氨酸几乎占总氨基酸残基的三分之一,即每隔两个其他氨基酸残基(X,Y)即有一个甘氨酸,故其肽链可用(甘-X-Y)n来表示。②含有较多在其他蛋白质中少见的羧脯氨酸和羧赖氨酸残基,也有较多脯氨酸(pro)和赖氨酸。如脯氨酸(Pro)和4—羟脯氨酸(4—hydroxyproline,Hyp)含量高达15~30%。同时还含有少量3—羟脯氨酸(3hydroxyproline)和5—羟赖氨酸(5—hydroxylysine,Hyl)。羟脯氨酸残基可通过形成分子内氢键稳定胶原蛋白分子。例如,正常胶原在39℃变性,而在缺乏脯氨酸羟化酶条件下合成的胶原在24℃变性成为白明胶(gelatin)。而羟赖氨酸上可结合半乳糖-葡萄糖苷,与特定组织功能相关。如在基底膜胶原(Ⅳ型)中含hyl较多,含糖也较多,可能与基底膜的滤过功能有关。③胶原中缺乏色氨酸,所以它在营养上为不完全蛋白质。
在胶原纤维中,胶原蛋白分子单位称为原胶原(tropo collagen)。每个原胶原分子由三条α-肽链组成,α-肽链自身为α螺旋结构,三条α-肽链则以平行、右手螺旋形式缠绕成“草绳状”三股螺旋结构(图13-6)。肽链中每三个氨基酸残基中就有一个要经过此三股螺旋中央区,而此处空间十分狭窄,只有甘氨酸适合于此位置,由此可解释其氨基酸组成中每隔两个氨基酸残基出现一个甘氨酸的特点。而且三条α-肽链是交错排列的,因而使三条α-肽链中的Gly、X、Y残基位于同一水平上,借Gly中的N-H基与相邻链X残基上羟基形成牢固的氢键(图13-7),以稳定其分子结构。
原胶原分子平行排列成束,通过共价交联,可形成稳定的胶原微纤维(microfibvil),进一步行聚集成束,形成胶原纤维。胶原分子通过分子内或分子间的交联成为不溶性的纤维。因胶原分子氨基酸组成中缺乏半胱氨酸,不可能象角蛋白那样以二硫键相联,而是通过组氨酸与赖氨酸间的共价交联,一般发生在胶原分子的C-或N末端之间。
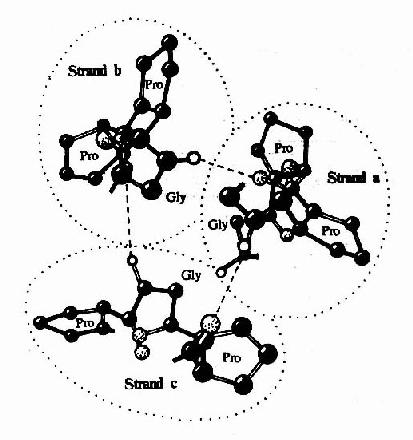
图13-7 胶原样多聚体三螺旋轴的C端投影图
胶原纤维在不同组织中的排列方式与其功能相关。如在肌腱、皮肤及软骨,要分别在一维、二维和三维方向承受张力,因而其胶原纤维排列分别为平行束状,多角的纤维片层及不规则排列等方式。(表13-4)
表13-4 胶原纤维在不同组织中的排列
| 组织 |
排列 |
| 肌腱 |
平行束 |
| 皮肤 |
多角的纤维片层 |
| 软骨 |
无规则排列 |
| 角膜 |
交叉排布的光滑片层使光的散身最小化 |
二、胶原的生物合成
结缔组织中的原胶原分子主要由成纤维细胞合成,软骨中胶原由软骨细胞合成,骨胶原来自成骨细胞,基底膜中胶原则由上皮或内皮细胞合成。胶原的生物合成可分为细胞内和细胞外两大阶段。

图13-8 胶原结构示意图
1.细胞内合成阶段
在结缔组织细胞中,首先是按蛋白质合成的原则先合成一条很长的,约1400个氨基酸残基的肽链,称为溶胶原蛋白,而后转入内质网中进行羟基化和糖基化修饰。
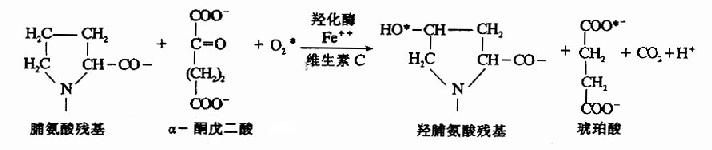
(1)羟基化修饰
胶原分子组成中含有羟脯氨酸和羟赖氨酸,这两种氨基酸并无遗传密码、反密码及tRNA引导入肽链,而是在内质网中,由脯氨酸、赖氨酸残基经羟化生成的。由脯氨酸羟化酶(prolylhydroxylase)和赖氨酸羟化酶(lysyl hydroxylase)催化,此酶为加单氧酶,需Fe++和维生素C为辅因子,α-酮戊二酸作辅底物。如脯氨酸的羟化反应:
此羟化反应中需分子氧,缺氧会妨碍胶原的生成,因而缺氧可使伤口愈合延迟。而维生素C是维持羟化酶活性所必需的,缺乏维生素C,胶原合成不能形成正常的纤维,可出现皮肤结节,血管脆弱及伤口愈合缓慢等症状。羟化作用对三股螺旋的坚固性有重要作用,羟化不足的链在体温下不能形成坚固的三股螺旋,因而不能从细胞内排出。
(2)糖基化修饰
胶原分子中含有共价连接的糖基,根据组织不同,糖含量可达0.4-12%。其中糖基主要为葡萄糖、半乳糖及它们的双糖。在内质网中由半乳糖基转移酶及葡萄糖基转移酶催化将糖基联于5-羟赖氨酸残基上。
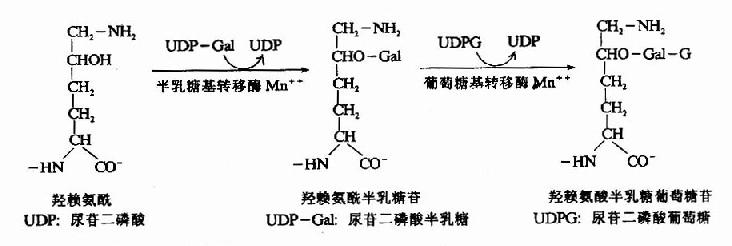
糖基化的作用目前尚未完全阐明,研究发现这些糖基位于胶原纤维中原胶原的接头处。推测糖基化与纤维的定向排列有关。
经羟基化和糖基化修饰的溶胶原蛋白,形成三股螺旋而排出细胞外。
2.细胞外胶原纤维成熟阶段
分泌到细胞外的溶胶原由内切酶作用,水解N—末端和C—末端的附加肽链,形成原胶原蛋白,原胶原分子可在中性pH条件下,借分子间各部分不同电荷的相互吸引而自动聚合成胶原纤维,此种聚合不稳定,经共价交联成网使之进一步固定。?
胶原纤维的共价交联由赖氨酸氧化酶(lysyloxidase)催化,此酶含Cu++,是参与交联反应过程的唯一酶,能将赖氨酸转变为醛赖氨酸(allysine)ε-醛赖氨酸与另一α-肽链的ε赖氨酸醛醛缩合生成ε-醛赖氨酸醛酸(Allysinealdol),再与组氨酸反应生成醇醛组氨酸(aldol histidine),后者再与5-羟赖氨酸进行醛胺缩合形成希夫碱结构(图13-9)可使4条α-肽链间共价交联。
通过共价交联,胶原微纤维的张力加强,韧性增大,溶解度降低,最终形成不溶性的胶原纤维。
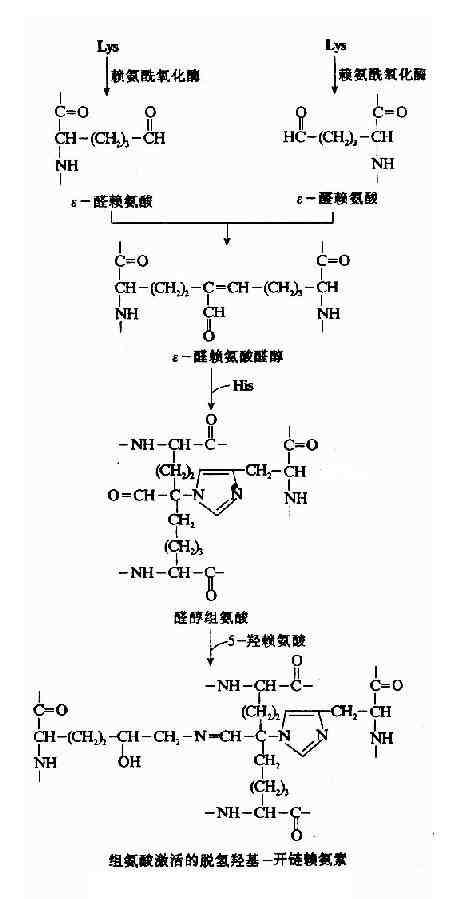
图13-9 胶原纤维的交联过程
胶原蛋白分子共价交联对胶原正常功能有重要意义。例如人或动物进食山藜豆所致的山藜豆中毒(lathyrivsm)表现为严重的骨、关节及大血管壁的异常,其发病即因为山藜豆毒素β—氨基丙晴(β—mino propionitrile)
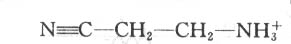
与赖氨酸氧化酶活性位点共价结合而使之失活,从而导致胶原纤维变脆弱。
胶原蛋白与许多人类疾病相关。如骨形成不全(osteogenesis imperfecta)或称脆骨病(brittle bonediesease),即是由于胶原蛋白生物合成或转录后的修饰作用障碍所致。现已清楚是由于I型胶原突变所致,据突变发生的位置及性质不同,发病的严重性亦不同。此外,有些胶原性疾病涉及多种胶原合成紊乱或合成过程中酶(如赖氨酸羟化酶,赖氨酸氧化酶)活性的异常。如Ehlers?Danlos综合症即有10种以上不同胶原的缺陷,其症状主要为关节过度伸张,皮肤弹性增高、脆弱,血管脆弱及外伤后皮下粘蛋白或皮下脂肪小结形成等,又被称为“印第安橡皮人”(India?rubber man)。
三、胶原的分解代谢
胶原纤维由于广泛的共价交联,其结构稳定,不易被一般蛋白酶水解。体内有特异作用于胶原的胶原酶(calagenase),对其分解起关键作用。此酶在N椂嗽?/4处切断原胶原,切断后的碎片可自动变性,经细胞外非特异性蛋白酶及肽酶水解或被细胞吞噬后由溶酶体酶进一步分解,形成小分子寡肽或游离氨基酸。
胶原酶在某些修复或再生组织如分娩后子宫、重建的骨组织以及愈合的伤口等含量较高,Ca++为其激活剂。血清中α2巨球蛋白能与胶原酶结合而抑制其活性。胶原酶对温度十分敏感,36℃时酶活性比30℃大10倍。炎症局部温度升高,可能因此加速胶原分解。
胶原分解后产生的寡肽及氨基酸中均含有羟脯氨酸,这在其它蛋白分解产物中少见。因而测定尿中羟脯氨酸或含羟脯氨酸的短肽的含量,可作为判断体内胶原分解的指标。
第三节 弹性蛋白及角蛋白
一、弹性蛋白
弹性蛋白构成弹性纤维,弹性纤维是有橡皮样弹性的纤维,能被拉长数倍,并可恢复原样,它是结缔组织弹性的主要因素。弹性蛋白分布没有胶原蛋白广泛,但在组织内也大量存在,如富有弹性的组织,肺、大动脉、某些韧带、皮肤及耳部软骨等。
弹性蛋白中疏水性氨基酸含量高达95%,其中有许多是甘氨酸、脯氨酸和亮氨酸。弹性蛋白初合成时为水溶性单体,分子量为70000,称为原弹性蛋白(tropoelastin),在修饰中部分脯氨酸羟化生成羟脯氨酸。原弹性蛋白从细胞中分泌出来后,部分赖氨酸经氧化酶催化氧化为醛基,并与另外的赖氨酸的ε-氨基缩合成吡啶衍生物,称为链素(图13-10)。
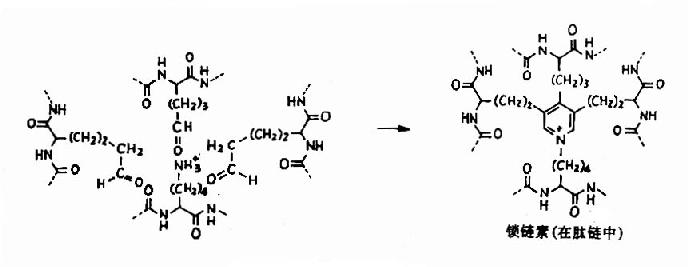
图13-10
交联后使弹性蛋白卷曲,从而具有弹性、并且使弹性蛋白溶解性降低,稳定性增高。
二、角蛋白
角蛋白(kevatin)是皮肤、毛发和指甲等组织的重要组成成分。是一种抗机械、抗化学刺激的蛋白质,存在于所有高等脊椎动物体中。角蛋白可分为α角蛋白(αkevatin),主要存在于哺乳动物;和β角蛋白(βkevatin),主要分布于鸟类和爬行动物。哺乳动物有30种不同的角蛋白,可分为相对酸性(Ⅰ型)和碱性(Ⅱ型)两类多肽。

图13-11头发的显微结构
通过电子显微镜分析表明:毛发主要由α角蛋白组成,一根典型毛发直接约20μm,由死细胞组成。由约80?粗的微纤维(microfibril)通过二硫键交联构成的巨纤维(macrofibrils)组成。
角蛋白中的肽链卷曲为α螺旋,两条分别为Ⅰ型和Ⅱ型的角蛋白肽链紧密结合为平行的左手螺旋二聚体(dimer)此二聚体首-尾相连构成原纤维(protofibril),4条原纤维构成微纤维(microfibril)(图13-11),微纤维再横向粘合为200μm直径的巨纤维(macrofibril)。α-角蛋白富含半胱氨酸,并能与邻近的多肽链通过二硫键进行交联,因此,α-角蛋白很难溶解,并受得起一定的拉力。烫发时先用巯基化合物破坏二硫键使之易于卷曲,然后用氧化剂恢复二硫键使卷曲固定。
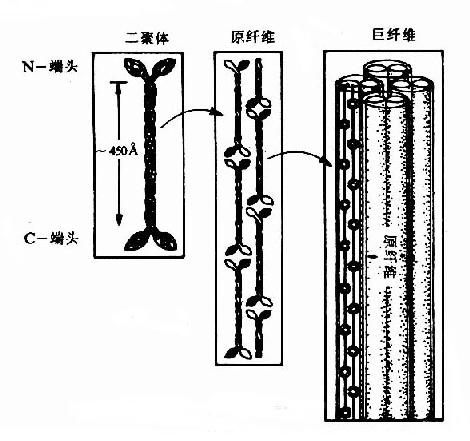
图13-12 α角蛋白的结构
遗传性皮肤疾病表皮松懈单片疱疹(epidermolysis bullosa zimplex EBS)和表皮松懈角化过度症(epidermolytichyperkeratosis,EHK)在对常人无害的机械摩擦下使上皮基底细胞和表皮基底细胞破裂而生成水疱为特征。研究表明EBS主要是皮肤14或5型角蛋白的异常,而EHK则主要是1或10型角蛋白的异常,由此可见角蛋白在维持人体正常生理防护功能方面有重要意义。
第四节 结缔组织代谢的调节
生长激素在促进蛋白质合成的同时亦促进蛋白多糖和胶原的合成。动物实验表明,生长激素的促软骨生长作用,至少部分是通过生长调节素A(somatomedin A)而间接作用的,它刺激软骨细胞的增殖和硫酸盐掺入蛋白多糖,所以又称“硫酸化因子”。
甲状腺素促进蛋白多糖的分解,甲状腺功能低下时常出现粘液性水肿,与蛋白多糖分解减弱在皮下蓄积有关。
睾丸酮和雌激素均可促进透明质酸的合成,而肾上腺皮质激素能稳定溶酶体,减少溶酶体酶的释放,从而维持蛋白多糖的稳定。胰岛素可促进糖胺多糖的合成,糖尿病人创伤愈合缓慢、易感染及并发血管退行性变等可能与此有关。糖皮质激素对胶原蛋白的合成及分解均有影响,长期使用可产生皮肤变薄、骨质疏松以及延缓创伤愈合等副作用,用药时应加以注意。