第四章索引
第四章 血液循环
心脏和血管组成机体的循环系统,血液在其中按一定方向流动,周而复始,称为血液循环。血液循环的主要功能是完成体内的物质运输,运输代谢原料和代谢产物,使机体新陈代谢能不断进行;体内各内分泌腺分泌的激素,或其它体液因素,通过血液的运输,作用于相应的靶细胞,实现机体的体液调节;机体内环境理化特性相对稳定的维持和血液防卫功能的实现,也都有赖于血液的不断循环流动。
第一节 心脏的泵血功能
心脏是一个由心肌组织构成并具有瓣膜结构的空腔器官,是血液循环的动力装置。生命过程中,心脏不断作收缩和舒张交替的活动,舒张时容纳静脉血返回心脏,收缩时把血液射入动脉,为血液流动提供能量。通过心脏的这种节律性活动以及由此而引起的瓣膜的规律性开启和关闭,推动血液沿单一方向循环流动。心脏的这种活动形式与水泵相似,因此可以把心脏视为实现泵血功能的肌肉器官。
几个世纪以来,生物学家一直认为心脏是一个单纯的循环器官,近年来关于心钠素的研究,认训到心脏除循环功能外,还具有内分泌功能。心钠素是脊椎动物心脏分泌的激素,主要在心房肌细胞内合成,具有利尿、利钠、舒张血管和降血压作用。参与机体水电解质平衡、体液容量和血压的调节(参看本章第四节)。除心钠素外,从哺乳动物的心肌组织中还提取分离出某些生物活性多肽,如抗心律失常肽和内源性洋地黄素等,还发现心肌细胞内有肾素~血管紧张素系统存在。有关心脏内分泌功能的研究进展很快,大大加深丰富了对心脏功能的认识和了解。
心脏活动呈周期性,每个周期中心脏表现出以下三方面活动;①兴奋的产生以及兴奋向整个心脏扩布;②由兴奋触发的心肌收缩和随后的舒张,与瓣膜的启闭相配合,造成心房和心室压力和容积的变化,从而推动血液流动;③伴随瓣膜的启闭,出现心音。心脏泵血作用是由心肌电活动、机械收缩和瓣膜活动三者相联系配合才得以实现。明确每个周期中这三者的变化和相互关系,对于了解心脏如何实现其泵血功能,以及它们将对心脏泵血产生什么影响,都是非常必要的。心脏机械活动的周期称为心动周期;生物是变化周期,称为心肌电周期。
一、心动周期的概念
心脏一次收缩和舒张,构成一个机械活动周期,称为心动周期。心房与心室的心动周期均包括收缩期和舒张期。由于心室在心脏泵血活动中起主要作用。故通常心动周期是指心室的活动周期而言。正常心脏的活动由一连串的的心动周期组合而成,因此,心动周期可以作为分析心脏机械活动的基本单元。
心动周期持续的时间与心跳频率有关。成年人心率平均每分钟75次,每个心动周期持续0.8s。一个心动周期中,两心房首先收缩,持续0.1s,继而心房舒张,持续0.1s,继而心房舒张,持续0.7s。当心房收缩时,心室处于舒张期,心房进入舒张期后不久,心室开始收缩,持续0.3s,随后进入舒张期,占时0.5s。心室舒张的前0.4s期间,心房也处于舒张期,这一时期称为全心舒张期(图4~1)。可见,一次心动周期中,心房和心室各自按一定的时程进行舒张与收缩相交替的活动,而心房和心室两者的活动又依一定的次序先后进行,左右两侧心房或两侧心室的活动则几乎是同步的。另一方面,无论心房或心室,收缩期均短于舒张期。如果心率增快,心动周期持续时间缩短,收缩期和舒张期均相应缩短,但舒张期缩短的比例较大;因此,心率增快时,心肌工作的时间相对延长,休息时间相对缩短,这对心脏的持久活动是不利的。

图4~1 心动周期中心房和心室活动的顺序和时间关系
了解心脏的泵血功能,需要弄清以下三个问题:①血液在心脏内的单方向流动是怎样实现的?②动脉内压力比较高,心脏怎样将血液射入动脉的?③压力很低的静脉血液是怎样返回心脏的?
现以左心室为例,说明心室射血和充盈的过程,以便了解心脏泵血的机制。
(一)左心室的射血和充盈过程
左心室的一个心动周期,包括收缩和舒张两个时期,每个时期又可分为若干时相(图4~2)。通常以心房开始收缩作为描述一个心动周期的起点。
1.心房收缩期心房开始收缩之前,心脏正处于全心舒张期,这时,心房和心室内压力都比较低,接近于大气压,即约oPa(以大气压为零);然而,由于静脉血不断流入心房,心房压相对高于心室压,房室瓣处于开启状态,心房腔与心室腔相通,血液由心房顺房~室压力梯度进入心室,使心室充盈。而此时,心室内压远比主动脉压(约80mmHg即10.6kPa)为低,故半月瓣是关闭着的,心室腔与动脉腔不相连通。
心房开始收缩,心房容积缩小,内压升高,心房内血液被挤入已经充盈了血液但仍然处于舒张期状态的心室,使心室的血液充盈量进一步增加。心房收缩持续约0.1s,随后进入舒张期。
2.心室收缩期包括等容收缩相以及快速和减慢射血相。
(1)等容收缩相:心房进入舒张期后不久,心室开始收缩,心室内压力开始升高;当超过房内压时,心室内血液?
■[此处缺少一些内容]■
左右时间内,心室肌仍在作强烈收缩,由心室射入主动脉的血液量很大(约占总射血量的2/3左右),流速也很快,此时,心室容积明显缩小,室内压继续上升达峰值,这段时期称快速射血相(0.10s);由于大量血液进入主动脉,主动脉压相应增高.随后,由于心室内血液减少以及心室肌收缩强度减弱,心室容积的缩小也相应变得缓慢,射血速度逐渐减弱,这段时期称为减慢射血相(0.15s),晕一时期内,心室内压和主动脉压都相应由峰值逐步下降。
早期的实验表明,整个射血相内,心室压始终高于主动脉压,这种心室~动脉压力梯度是血液由心室进入动脉的推动力;然而,近代应用精确的压力测量方法观察到,在快速射血的中期或稍后,心室内压已经低于主动脉压(图4~2),不过此时,心室内血液因为受以心室肌收缩的作用而具有较高的动能,依其惯性作用可以逆着压力梯度继续射入主动脉。
3.心室舒张期包括等容舒张相和心室充盈相,后者又再细分为快速充盈、减慢充盈和心房收缩充盈三个时相。
(1)等容舒张相:心室肌开始舒张后,室内压下降,主动脉内血液向心室方向返流,推动半朋瓣关闭;这时室内压仍明显高于心房压,房室瓣仍然处于关闭状态,心室又成为封闭腔。此时,心室肌舒张,室心压极快的速度大幅度下降,但容积并不改变,从半月瓣关闭直到室内压下降到低于心房压,房室瓣开启时为止,称为等容舒张相,持续约0.06~0.08s。
(2)心室充盈相:当室内压下降到低于心房压时,血液顺着房~室压力梯度由心房向心室方向流动,冲开房室瓣并快速进入心室,心室容积增大,称快速充盈相,占时0.11s左右;其间进入心室的血液约为总充盈量的2/3。随后,血液以较慢的速度继续流入心室,心室容积进一步增大,称减慢充盈相(0.22s)。此后,进入下一个心动周期,心房开始收缩并向心室射血,心室充盈又快速增加。亦有人将这一时期称为心室的主动快速充盈相(占时0.1s)。
从以上对心室充盈和射血过程的描述中,不难理解左心室泵血的机制。室壁心收缩和舒张,是造成室内压力变化,从而导致心房和心室之间以及心室和主动脉之间产生压力梯度的根本原因;而压力梯度是推动血液在相应腔室内之间流动的主要动力,血液的单方向流动则是在瓣膜活动的配合下实现的。还应注意瓣膜的作用对于室内压力的变化起着重要作用,没有瓣膜的配合,等容收缩相和等容舒张相的室内压大幅度升降,是不能完满实现的。
(二)心动周期中心房压力的变化
每一心动周期中,左心房压力曲线依次出现三个小的正向波:a波、c波和v波,以及两个下降波:x降波和y降波。首先,疏收缩,房内压升高,形成a波,随后心房舒张,压力又回降。以后心室开始收缩,室内压升高,室内血液推顶并关闭了房室瓣,使瓣膜叶片向心房腔一侧凸出,造成房内压轻度上升,形成c波。随着心室射血时体积的缩小,心底部向下移动,房室瓣从而也被向下牵,以致心房的容积趋于扩大,房内压下降,形成x降波。以后,静脉血不断流入心房,而房室瓣尚关闭着,血液不能入心室,心房内血液量不断增加,房内压缓慢而持续升高,直到心室等容舒张相结束,心房血得以进入心室为止,由此形成的上升波称v波。随后房室瓣开放,血液由心房迅速进入心室,房内压下降,形成y降波。
一个心动周期中,心房压力波动的幅度较小。成年人于安静卧位,左房压变化幅度为0.3~1.6kPa(2~12mmHg);右房压为0~0.7kPa(0~5mmHg)。
(三)心房和心室在心脏泵血活动中的作用
心室~动脉压力梯度是引起半月瓣开放、推动血液由心室开始射入动脉的直接动力,这种压力梯度是由心室的强烈收缩千百万室内压由原来近于心房压水平升高到超过动脉压而形成的。同样,房~室压力梯度是由血液由心房流入心室的动力,但它的形成主要并不是来自心房收缩,而是依靠心室的舒张;即在心室等容舒张相,室内压大幅度下降,由开始时近于动脉压一直下降到低于心房压,房室瓣开放,血液由心房迅速进入心室。整个心室舒张充盈期内,房~室压力梯度始终存在;然而,这一时期的前一段时间内(即充盈期的前4/5时间内),心房也处于舒张状态,这时心房只 不过是静脉血液返回心室的一条通道,只有后1/5期间心房才收缩。由此可以看出,心房收缩对于心室充盈不起主要作用。故当民生心房纤维性颤动时,虽然心房已不能正常收缩,心室充盈量因此有所减少,但一般不致于严重影响心室的充盈和射血功能;如果发生心室纤维性颤动,心脏泵血活动立即停止,后果十分严重。
虽然心室的充盈绝大部分是在快速充公盈期内完成的,但心房收缩时又挤出部分血液以增加心室充盈(约占总充盈量的30%左右),使心室舒张末期容积和压力都有一定程度增加,这对于心室射血功能是有利的。另一方面,如果心房收缩缺失,将会导致房内压增加,不利于静脉血液回流,从而间接影响心室射血。可以认为,心房收缩起着初级泵的作用,对于心脏射血和血液的回流都是不利的。房泵作用的缺失,对静息状态下心脏泵血功能影响不大;但机体在运动和应急状态下,就可能出现心输出量不足等泵功能的严重损害。
三、心脏泵功能的评定
心脏泵功能是正常或是不正常,是增强或减弱,这是医疗实践以及实验研究工作中经常遇到的问题。因此,用什么样的方法和指标来测量和评定心脏功能,在理论和实践上都是十分重要的。
(一)心脏的输出量
心脏在循环系统中所起的主要作用就是泵出血液以适应机体新陈代谢的需要,不言而喻,心脏输出的血液量是衡量心脏功能的基本指标。
1.每分输出量和每搏输出量一次心跳一侧心室射出的血液量,称每捕输出量,简称搏出量。每分钟射出的血液量,称每分输出量,简称心输出量,等于心率与搏出量的乘积。左右两心室的输出量基本相等。
心输出量与机体新陈代谢水平相适应,可因性别、年龄及其它生理情况而不同。如健康成年男性静息状态下,心纺平均每分钟75次,搏出量约为70ml(60~80ml),心输出量为5L/min(4.5~6.0L/min)。女性比同体重男性的心输出量约低10%,青年时期心输出量高于老年时期。心输出量在剧烈运动时可高达25~35L/min,麻醉情况下则可降低到2.5L/min。
2.心指数心输出量是以个体为单位计算的。身体矮小的人和高大的人,新陈代谢总量不不相等,因此,用输出量的绝对值作为指标进行不同个体之间心功能的比较,是不全面的。群体调查资料表明,人体静息时的心输出时,也和基础代谢率一样,并不与体重成正比,而是与体表面积成正比的。以单位体表面积(m2)计算的心输出量,称为心指数;中等身体的成年人体表面积约为1.6~1.7m2,安静和空腹情况下心输出量约5~6L/min,故心指数约为3.0~3.5L/min·m2。安静和空腹情况下的心指数,称之为静息心指数,是分析比较不同个体心功能时常用的评定指标。
心指数随不同重量条件而不同。年龄在10岁左右时,静息心指数最大,可达4L/min·m2以上,以后随年龄增长而逐渐下降,到80岁时,静息心指数接近于2L/min·m2.肌肉运动时,心指数随运动强度的增加大致成比例地增高。妊娠、情绪激动和进食时,心指数均增高。
(二)射血分数
心室舒张末期充盈量最大,此时心室的容积称为舒张末期容积。心室射血期末,容积最小,这时的心室容积称为收缩末期容积。舒张末期容积与收缩末期容积之差,即为搏出量。正常成年人,左心室舒张末期容积估计约为145ml,收缩末期容积约75ml,搏出量为70ml。可见,每一次心跳,心室内血液并没有全部射出。搏出量占心室舒张末期容积的百分比,称为射血分数。健康成年人搏出量较大时,射血分数为55%~65%。
在评定心泵血功能时,单纯用搏出量作指标,不考虑心室舒张末期容积,是不全面的。正常情况下,搏出量始终与心室舒张末期容积相适应,即当心室舒张末期容积增大时,搏出量也相应增加,射血分数基本不变。但是,在心室异常扩大、心室功能减退的情况下,搏出量可能与正常人没有明显判别,但它并不与已经增大的舒张末期容积相适应,射血分数明显下降。若单纯依据搏出量来评定心泵血功能,则可能作出错误判断。
(三)心脏作功量
血液在心血管内流动过程中所消耗的能量,是由心脏作功所供给的;换句话说,心脏作功所释放的能量转化为压强能和血流的动能,血液才能循环流动。
心室一次收缩所作的功,称为每搏功,可以用搏出的血液所增加的动能和压强能来表示。心脏射出的血液所具有的动能在整个搏功中所占比例很小,可以略而不计。搏出血液的压强能可用平均动脉压表示,约相当于;舒张压+(收缩压~舒张压)×1/3。由于心室充盈是由静脉和心房输送回心的血液充盈心室造成的,计算心室收缩释放的能量时不应将充盈压(可用左室舒张末期压或平均左房压表示,约为0.8kPa[6mmHg])计算在内.搏功单位为g~m。搏功乘以心率即为每分功,单位为kg~m/min。计算左室搏功和每分功的简式如下:
搏功(g~m)=搏出量(cm3)×(1/1000)×(平均动脉压~平均左房压mmHg)×(13.6g/cm3)
每分功(kg~m/min)=搏功(g~m)×心率×(1/1000)
设搏出量为70ml,收缩压120mmHg,舒张压80mmHg,平均左房压6mmHg,心纺75次,代入上式,求得左心室搏功为83.1g~m;每分功为6.23kg~m/min。
右心室搏出量与左心室相等,但肺动脉平均压仅为主动脉平均压的1/6左右,故右心室作功量也只有左心室的1/6。
用作功量来评定心泵血功能,其意义是显而易见的,因为心脏收缩不仅仅是排出一定量的血液,而且这部分血液具有适用高的压强能(以及很快的流速)。在动脉压增高的情况下,心脏要射出与原先同等量的血液就必须加强收缩;如果此时心肌收缩的强度不变,那么,搏出量将会减少。实验资料表明,心肌的耗氧量与心肌的作轼量是相平行的,其中,心输出量的变动不如心室射血期压力和动脉压的变动对心肌耗氧量的影响大。这就是说,心肌收缩释放的能量主要用于维持血压。由此可见,作为评定心泵血功能的指标,心脏作功量要比单纯的心输出量,更为全面。在需要对动脉压不相等的各个人,以及同一个人动脉压发生变动前后的心脏泵血功能进行分析比较时,情况更是如此。
四、心脏泵功能的调节
机体在长期进化的过程中, 发生和发展了一套逐步完善的循环调节机构,使循环功能适应于不同生理情况下新陈代谢的需要。这种调节是在复杂的神经和体液机制参与下,通过对心脏和血管活动的综合调节而实现的(整体调节机制将后述)。本节主要从心脏本身来阐述控制心输出量的因素的作用机制。
心输出量取决于心率和搏出量,机体通过对心率和搏出量两方面的调节来调节心输出量。
(一)搏出量的调节
心室肌的收缩是面临着动脉压(后负荷)的阻挡进行的。等容收缩相内,心室肌收缩首先引起室内压升高,只有当室内压升高到超过动脉压时,心肌纤维才能缩短,心室容积才能缩小,血液才能射出。由此可见,在心率恒定情况下,心室每次收缩的射血量取决于心肌纤维缩短的程度和速度,这决定了心肌收缩产生张力(表现为心室内血液的压力)的程度和速度。凡是能影响心肌收缩强度和速度的因素都能影响搏出量,而搏出量的调节正是通过改变心肌收缩的强度和速度来实现的。
1.心肌收缩的“全或无”现象心肌细胞和骨骼肌细胞一样,收缩反应是由肌膜的兴奋通过兴奋~收缩耦联触发引起的;但是,从整块肌肉来看,在骨骼肌,一个细胞产生的兴奋不能扩布到另一个细胞,只有在支配一个肌细胞有神经纤维发放神经波动时,才会出现收缩效应;若发放冲动的神经纤维数目增加,可以引起更多的肌细胞兴奋和收缩,整块肌肉的收缩增强。因此,如果骨骼肌作单收缩,其收缩强度的改变可以来自两个方面,一是由于单个肌细胞收缩强度的改变,另一原因是参与收缩活动的肌细胞数目发生变化。心肌则不同,相邻的心肌细胞是由闰盘的特殊结构和特性,兴奋可以通过它由一个心肌细胞传播到另一个心肌细胞。因此,整个心室(或整个心房)可以看成是一个功能上互相联系的合胞体,产生于心室某一处的兴奋可以在心肌细胞之间迅速传递,引起组成心室的所有心肌细胞几乎同步收缩。从参与活动的肌细胞数目上看,心肌的收缩是“全或无”的。这就是说,心肌据要么不产生,一旦产生则全部心肌细胞都参与收缩。由此可见,心肌收缩的强度,不象骨骼肌那样可以因参加活动的细胞数目的不同而改变;各个心肌细胞收缩强度的变化是整块心肌收缩强度发生的唯一原因。所以搏出量的调节可以从单个心肌细胞收缩功能调控的角度来探讨。
2.搏出量的调节搏出量和搏功的调节,是心脏生理中最基本最重要地课题之一,从世纪末、本世纪初以来,众多学者对此进行了大量实验研究。50年代中期,Sarnoff对这些研究资料进行详细分析之后,将搏出量和搏功的调节归纳为:①由初长度改变引起的异长调节,以及②由心肌收缩能力改变引起的等长调节等方式。
(1)异长调节:前已述,控制骨骼股收缩强度和速度的一个重要因素就是肌肉本身的初长度,而初长度是被动地由该肌肉收缩前所随的负荷(前负荷)所决定的。前负荷和初长度对肌肉收缩强度和作功能力的影响是双相的,构成的长度~张力曲线类似抛物线,在前负荷和初长度达最适水平之前,肌肉收缩强度和作功能力随前负荷~初长度的增加而增加;超过最适水平,收缩效果将随前负荷~初长度的继续增加而降低(图4~3)。
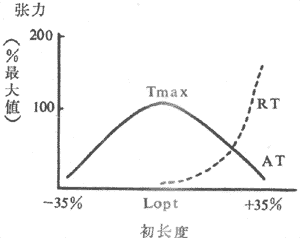
图4~3 骨骼肌的长度~张力曲线
AT:主动张力 RT:静息张力(被动张力)
Tmax:最大张力 Lopt:最适初长
在心肌,初长度同样是控制收缩功能最重要的因素,不过,初长度和收缩功能的关系具有某些特殊性。为了分析前负荷和初长度对心脏泵血功能的影响,可以在实验中逐步改变心室舒张末期压力(亦称充盈压)和容积(相当于前负荷或初长),并测量射血心室的搏功或等容心室的室内峰压,将一系列搏功或室内峰压数据对应心室舒张末期压力和容积,绘制成坐标图,即为心室功能曲线(图4~4)。心室功能曲线大致可分为三段:①充盈压1.6~2kPa(12~15mmHg)是人体心室最适前负荷,位于其左侧的一段为功能曲线升支,它与骨骼肌长度~长力曲张升支段相似;均表明当前负荷~初长度未达最适水平之前,搏功或等容峰压随初长度的增加而增加,通常情况下,左室充压约0.7~0.8kPa(5~6mmHg),可见正常心室是在功能曲线的升支段工作,前负荷~初长度尚远离其适水平.这一特征表明心室具有较大程度的初长度贮备,心室通过前负荷~初长度的增加即异长调节机制使泵血功能增强的容许范围是很宽的.而体内骨骼肌的自然长度已经接近最适长度,前负荷~初长度贮备很小,通过初长度调节其收缩功能的范围也很小;②充盈压2~2.7kPa(15~20mmHg)范围内,曲线逐渐平坦,说明前负荷在上限范围内变动时对泵血功能的影响不大;③随后的曲线呈平坦状,或轻度下倾,并不出现明显的降支,这一点明显不同于骨骼,说明正常心室充压即使超过2.7kPa(20mmHg),搏功不变或仅轻度减少,只有在民生严重病理变化的心室,功能曲线才出现降支。
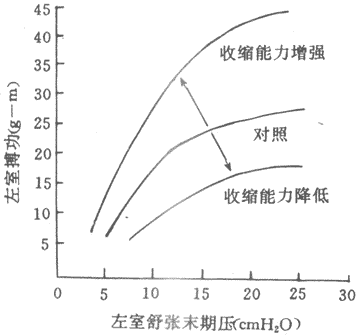
图4~4 心室功能曲线(lcmH2O=0.098kPa)
在一组心肌肌小节标本上的研究表明,在心室最适前负荷和最适初长度时,肌小节初长度为2.0~2.2μm,这正是肌小节的最适初长度,粗细肌丝处于最佳重叠状态。这种情况下,肌小节等长收缩产生的张力最大。达最适水平之前,随着前负荷和肌小的初长度的增加,粗细肌丝有效地重叠的程度增加,激活时可能形成的横桥联接的数目相应增加,肌小节以至整个心室的收缩强度增加,搏出量和搏功增加。由此可见,心室功能曲线的升支正是肌小节初长度~主动张力关系的升支在整个心室功能上的一种反映。在搏出量的这种调节机制中,引起调节的因素是心肌细胞本身初长度的改变,其效应是心肌细胞收缩强度的改变,因些将这种形式的调节称为异长调节。
为什么骨骼肌的长度~张力曲线出现降支,而正常心室的功能曲缍不再现降支?已知,一个具有弹性的物质受到外力作用时,一方面可被拉长,随之产生弹性张力,与此同时,这一个弹性张力又具有阻止它本身被进一步拉长的作用。当骨骼肌处于最适长度即肌小节初长度为2.0~2.2μm的状态下,所产生的静息张力较小,继续增加前负荷,肌细胞可被进一步延伸,肌小节初长度可大大超过2.2μm,肌丝重叠程度明显减小,收缩能力因此下降。但是,由于心肌细胞外间内含有大量劲度较大的胶原纤维,因而心肌的伸展性较小,处于最适初长度时,产生的静息张力已经很大,从而阻止心肌细胞继续被拉长。实验证明,即使在前负荷很大的情况下,心肌肌小节初长度一般也不会超过2.25~2.30μm。心肌细胞这种抵抗过度延伸的特性,对心脏泵血功能具有重要生理意义,它使心脏不致于被在前负荷明显增加时,引起搏出师长作功能力的下降。心室功能曲线不再现降支,并不是心肌初长度超过最适水平之后心肌的收缩功能依然不受影响,而只是在这种情况下初长度不再与前负荷呈平行关系。而在慢性过度扩张的病理心脏上观察到的功能曲线降支,是由于室壁心肌发生了组织学改变,心室容积扩大,心肌细胞收缩功能又严重损伤的缘故。
既然前负荷~初长度是调节搏出量的主要因素,那么在体情况下有哪些因素可以影响心室的前负荷和初长度?在心室其它条件(主要是心室肌的顺应性)不变的情况下,心室前负荷~舒张末期压是由心室舒张末期充盈的血液量来决定的,充盈量大,舒张末期容积也较大。可以设想,凡是影响心室充盈量的因素,都能够通过异长调节机制来使搏出量发生改变。
心室充盈的血量,是静脉回心血量和心室射血剩余血量两者的总和。静脉回心血量又受下述因素的影响:①心室舒张充盈期持续时间。例如,心率增快时,充盈期缩短,心室充盈不完全,充盈压降低,搏出量减少;②静脉回流速度。在充盈期持续时间不变的情况下,静脉内血液通过惊讶进入心室的速度愈快,充盈量愈大,搏出量相应增加。静脉加流速度取决于外周静脉压与心房压和心室压之差。外周静脉增高(如循环血量增加、外周静脉管壁张力增高等情况下)和(或)心房心室压力降低时,可促进静脉回流。心脏每次射血之后的剩余血液量,也影响心室的充盈量,但是,这种影响是多方面的;如果静脉回心血量不变,心室剩余血量的增加将导致部充盈量增加,充盈压增高,搏出量随之增加;但另一方面,当心室剩余血量增加时,心室舒张期内室压增高,静脉回心血量将因此减少,总充盈量不一定增加。总之,在心室射血功能不为的情况下,心室剩余血量的增减对搏出量是否有影响以及发生何种影响,取决于心室总充盈量是否改变以及发生何种改变。
早在1914~1918年,生理学家Starling在哺乳动物身上就观察到肌纤维初长度对心脏的功能的影响,因此异长调节也称为Starling机制,心室功能曲线也可称为Starling曲线。通常,心室射血量与静脉回心血量相平衡,从而维持心室舒张末期压力和容积于正常范围,如果因某种原因造成静脉回心血量超过射血量,则充盈压将增高,通过Starling机制增加搏出量使之与回流量重新达到平衡,否则舒张末期压力和容积将持续增高而得不到纠正。但Starling机制的主要作用是对搏出量进行精细的调节。例如,当体位改变以及当左右心室搏出量不平衡等情况下所出现的充盈量的微小变化,是通过异长调节机制来改变搏出量使之与充盈量达到平衡的;而对于持续的、剧烈的循环功能变化,例如体力劳动时搏出量持久且大幅度的增高,主要靠心肌收缩能力的变化来调节,这时异长调节机制的作用不大。
(2)等长调节:人们进行强体力劳动时,搏出量和搏功可成倍增加,而此时心脏舒张末期容积不一定增大,甚至有所减小;相反,心力衰竭病人,心脏容积扩大而其作功能力反而降低。由此推测,对于心脏的泵血功能,除异长调节处,还有另一种与心肌初长度无关的调节机制存在。精确的实验研究表明,将离体心有保持在最适长度情况下,支甲肾上腺素促使心肌等长收缩产生的最大张力和张力上升速率都增加,等张收缩的幅度增大,缩短速度加快,将一系列等长收缩或等张收缩的实验结果绘制成长度~张力曲线和张力~速度曲张,可以看到,在去甲肾上腺素作用下,长度~张力曲线升支向左上方移位,张力~速度曲张向右上方移位。这些结果表明,处于任何一种初长度下(不只是最适初长度)的心肌,在有去甲肾上腺素的情况下,等长收缩产生的张力都比没有去甲肾上腺素时为高;后一结果表明,任何一种后负荷情况下,受去甲肾腺素作用的心肌等张收缩的缩短速度增快。完整心室的结果类似:给予去甲肾上腺素后,心肺功能曲线左上移位,表明有同一前负荷~舒末容积条件下,等容心室的峰压增高,射血心室容积缩小程度增加;室内压上升速率和射血期容积缩小的速度也能增加。其结果,搏出量和搏功增加,心脏泵血功能明显加强。另一些因素,如乙酰胆碱,则引起相反效应。很明显,上述干预因素引起心肌收缩功能和心脏泵血功能改变的原因并不是初长度的变化,而是通过心肌另一种功能变数起作用的。这种功能变数称之为心肌收缩能力(myocardial contractility)。心肌收缩能力一般地定义为:心肌不依赖于负荷而改变其力学活动(包括收缩活动的强度和速度)的一种内在特性,因此,心肌收缩能力又称为心肌变力状态(inotropic state)。在某些因素作用下,心肌收缩能力发生改变,从而影响心肌细胞学活动的强度和速度,使心脏搏出量和搏功相应发生改变(图4~4)。心脏泵血功能的这种调节是通过收缩能力这个与初长度无关的、心肌内在功能变数的改变而实现的,故称等长调节。
心肌收缩能力受多种因素的影响,兴奋~收缩耦联过程中各个环节(参看第二章)都能影响收缩能力,其中活化横桥数和肌凝蛋白的ATP酶活性是控制收缩能力的主要因素,已知,粗肌丝上的横桥,只有与细肌丝的肌纤蛋白结合形成横桥联接并活化,才能导致肌丝滑行并产生力。在一定初长度的条件下,粗细肌丝的重叠区提供了可以形成横桥联接的最大横桥数,然而不是所有横桥都会形成活化横桥。海参化横桥数与最大横桥数的比例,取决于兴奋后胞浆Ca2+浓度的升高程度和肌钙蛋白对Ca2+的亲和力;凡能增加兴奋后胞浆Ca2+浓度(或)肌钙蛋白Ca2+亲和力的因素,均可增加活化横桥的比例,导致收缩能力的增强。例如儿茶酚胺增加收缩能力的原因之一,就是它通过激活β~肾上腺素能受体,增加胞浆cANP浓度,使肌膜Ca2+通道和肌浆网Ca2+的通道的开放程度增加,导致心肌兴奋后胞浆Ca2+浓度升高程度增加。一些钙增敏剂,如茶碱,可以增加肌钙蛋白对Ca2+的亲和力使肌钙蛋白结合形成活化横桥,肌凝蛋白的ATP酶就被激活,它分解ATP以提供肌丝滑行的能量。甲状腺激素和体育锻炼能提高肌凝蛋白ATP酶活性,促进心肌收缩能力增强;相反,老年人的心脏和甲状腺功能减退患者的心脏,心肌肌凝蛋白分子结构发生改变,其ATP酶的活性较低,收缩能力减弱。
心肌收缩能力的评定:
泵血功能反映的是心室前负荷的后负荷(见后文)、心肌收缩能力及及心率等变数的综合效果,而心肌收缩能力直接反映心肌本身的功能状态,收缩能力的改变具有极其重要的生理和病理意义。因此,理论研究和临床实践中都需要对收缩能力进行定量测量和评定,以了解收缩能力的水平和变化。由于收缩能力并不是某种可测量的单一变数,因此,对收缩能力的具体度量是比较困难的。衡量泵血功能的指标(如搏出量、搏功等)受前、后负荷影响,并不能直接反映收缩能力的水平,只有根据心肌长度~张力曲线或心室功能曲线的移位来判断收缩能力的变化(左上移位提示收缩能力增强,右下移位表明收缩能力低下,图4~4)。但这种评定方法具有操作繁杂、敏感性较低的缺点。目前,常用的方法是采用一系列速度指标来定量评定收缩能力。在离体心肌,最常采用的是张力变化速率(Dt/dt)和长度变化速率(Dl/dt);对完整心室,常采用的指标有:等容相室内压变化速率(Dp/dt)、射血相心室容积变化速率(dV/dt)或心室直径变化速率(dD/dt)等,以及心肌纤维收缩成分的缩短程度(VCE)等。这些速度指标受负荷改变的影响较小,对收缩能力的变化比较敏感,为国内外心脏学研究工作者广泛采用。
(3)后负荷对搏出量的影响:已知,离体肌肉的后负荷对收缩过程产生一定的影响,对心室而言,动脉压起着后负荷的作用,因此,动脉压的变化将影响心室肌的收缩过程,影响搏出量。在心率、心肌初长度和收缩能力不变的情况下,如果动脉压增高,等容收缩相室内压峰值必然也增高,从而使等容收缩相延长而射血相缩短,同时,射血相心室肌纤维缩短的程度和速度均减小,射血速度减慢,搏出量因此减少。应该看到,后负荷对心肌收缩活动的上述影响,是一种单纯机械效应,并不是某种功能调节机制进行调节的结果。从心肌收缩释放的能量的分配比例上,可以很容易理解这个问题。当心肌收缩能力不变时,收缩释放的能量是恒定的。如果室内压力升高,表示心肌产生张力消耗的能量相对增加,用于心肌纤维缩短将相对减少;如果肌肉作等长收缩,释放的能量几乎全部用于产生张力。另一方面,也应该看到,由于动脉压影响了搏出量,又常常继发地引起一些调节机制的活动。如上述,动脉压的突然升高首先导致搏出量减少,结果造成心室内剩余血量增加,充盈量增加,后者又再引起异长调节机制的调节,搏出量可以恢复正常水平,即通过异长调节可以使动脉压增高所招致的搏出量减少的现象得到纠正。但是,既然通过异长调节,搏出量已经恢复原有水平,那么,心室的充盈一不是将同时恢复原水平,异长调节的作用被取消,搏出量不是又因高动脉压状态的存在而减少了吗?这就是说,搏出量是否会出现时而降低、时而恢复的现象?许多实验都证明,随着搏出题的恢复,心室舒张末期容积确实也恢复到原水平,但此时,搏出量仍然维持高水平,并不出现再次减少的现象。进一步分析发现,后一情况的出现乃是心肌收缩能力增强所致。尽管此时产生的张力随负荷的增加而有所增加,但缩短的程度不但可以不降低,反而可能增加。至于这种情况下心肌收缩能力为什么增强,原因尚不十分清楚,可能是神经机液机制调节的结果。
综上所述,心室后负荷的本身直接着搏出量,随后通过异长和等长调节机制,使前负荷和心肌收缩能力与后负荷相匹配,从而使机体得在在动脉压增高的情况下,能够维持适当的心输出量。这种情况对于机体是有重要生理意义的。但也应看到,此时搏出量的维持,是心肌加强收缩的结果,如果动脉压持续增高,心室肌将因处于收缩强状太而逐渐肥厚,即发生了病理性改变,随后将导致泵血功能减退。
(二)心率及其对心输出量的影响
健康成年人的安静状态下,心率平均为每分钟75次(正常范围为每分钟60~100次)。不同生理条件下,心率有很大变动,可低到每分钟40~50次,高达每分钟200次。
心输出量是搏出量与心率的乘积,心率增快,心输出量增加;但这有一定的限度,如果心率增加过快,超过每分钟170~180次,心室充盆时间明显缩短,率盈量减少,搏出题可减少到仅有正常时的一半左右,心输出量亦开始下降。当心率增快但尚未超过此限度时,尽管此时心室充盈时间有所缩短,但由于回心血量中的绝大部分是在快速充盈期内进入心室的,因此,心室充盈量以及搏出量不致于减少或过分减少,而由于心庇护增加,每分钟的输出量增加。反之,如心率太慢,低于每分钟40次,心输出量亦减少。这是因为心室舒张期过长,心室充盈早已接近限度,再延长心舒时间也不能相应增加充盈量和搏出量。可见,心跳频率最适宜时,心输出量最大,心率过快或过慢,心输出量都会减少。
心率受自主神经的控制,交感神经活动增强时,心率增快;迷走神经活动增强时,心率减慢。影响心率的体液因素主要有循环血液中的肾上腺和去甲肾上腺素,以及甲状腺素。此外,心率受体温的影响,体温升高1℃,心率将增加12~18次。
(三)心脏泵功能的贮备
心脏的泵血功能能够广泛适应机体不同生理条件下的代谢需要,表现为心输出量可随机体代谢增长而增加。健康成年人静息状态下心率每分钟75次,搏出量约70ml,心输出量为5L左右。强体力劳动时,心率可达每分钟180~200次,搏出量可增加到150ml左右,心输出量可达25~30L,为静息时的5~6倍。心脏每分钟能射出的最大血量,称最大输出量。它反映心脏的健康程度。由上可以看出,在平时,心输出量产是最大的,但能够在需要时成倍地增长,表明健康人心脏泵血功能有一定的贮备力量。心输出量随机体代谢需要而增加的能力,称为泵功能贮备,或心力贮备。健康人有相当大的心力贮备,而某些心脏疾患的病人,静息时心输出量与健康人没明显差别,尚能够满足静息状态下代谢的需要,但在代谢活动增强时,输出量却不以相应增加,最大输出量较正常人为低;而训练有素的运动员,心脏的最大输出量远比一般人为主,可达35L以上,为静息时的8倍左右。
五、心音心音图
心动周期中,心肌收缩、瓣膜启闭、血液加速度和减速度对心血管壁的加压和减压作用以及形成的涡流等因素引起的机械振动,可通过周围组织传递到胸壁;如将听诊器放在胸壁某些部位,就可以听到声音,称为心音。若用换能器将这些机械振动转换成电信号记录下来,便得到了心音图。
心音发生在心动周期的某些特定时期,其音调和持续时间也有一定的规律;正常心脏可听到4个心音:即第一、第二、第三和第四心音。多数情况下只能听到第一和第二心音,在某些健康儿童和青年人也可听到第三心音,40岁以上的健康人也有可能出现第四心音。心脏某些异常活动可以产生杂音或其它异常心音。因些,听取心音或记录心音图对于心脏疾病的诊断有一定的意义。
第一心音发生在心缩期,音调低,持续时间相对较长,在心尖搏动处(左第五肋间隙锁骨中线)听得最清楚。在心缩期心室射血引起大血管扩张及产生的涡流发出的低频振动,有及由于房室瓣突然关闭所引起的振动,是听诊的第一心音的主要组成成分,因经,通常可用第一心音人选为心室收缩期开始的标志。第二心音发生在心脏舒张期,频率较主,持续时间较短。听诊的第二心音主要与主动脉瓣的关闭有关,故可用用标志心室舒张期开始。第三心音发生在快速充盈期末,是一种低频、低振幅的心音。它可能是由于心室快速充盈期末,血流充盈减,流速突然改变,形成一种力使心室壁和瓣膜发生振动而产生的。第四心音是与心房收缩有关的一组心室收缩期前的振动,故也称心房音。正常心房收缩,听不到声音,但在异常有力的心房收缩和左室壁变硬的情况下,心房收缩使心室充盈的血量增加,心室进一步扩张,引起左室肌及二尖瓣和血液的振动,则可产生第四心音。
第二节 心肌的生物电现象和生理特征
心房和心室不停歇地进行有顺序的、协调的收缩和舒张交替的活动,是心脏实现泵血功能、推动血液循环的必要条件,而细胞膜的兴奋过程则是触发收缩反应的始动因素。本节需要阐述的问题是:引起心脏收缩活动的兴奋来自何处?为什么心脏四个腔室能够作协调的收缩活动?为什么心脏的收缩活动始终是收缩和舒张交替而不出现强直收缩?要回答这些问题,必须了解心肌的生理特性,主要是心肌兴奋和兴奋传导的特征。兴奋和传导是以细胞膜的生物电活动为基础的。因此,首先叙述心肌细胞的生物电现象,然后,根据生物电现象分析叙述心肌兴奋和兴奋传播的规律和生理意义。
心肌细胞的类型组成心脏的心肌细胞并不是同一类型的,根据它们的组织学特点、电生理特性以及功能上的区别,粗略地分为两大类型:两类心肌细胞分别实现一定的职能,互相配合,完成心脏的整体活动。一类是普通的心肌细胞,包括心房肌和心室肌,含有丰富的肌原纤维,执行收缩功能,故又称为工作细胞。工作细胞不能自动地产生节律性兴奋,即不具有自动节律性;但它具有兴奋性,可以在外来刺激作用下产生兴奋;也具有传导兴奋的能力,但是,与相应的特殊传导组织作比较,传导性较低。另一类是一些特殊分化了的心肌细胞,组成心脏的特殊传导系统;其中主要包括P细胞和哺肯野细胞,它们除了具有兴奋性和传导性之外,还具有自动产生节律性兴奋的能力,故称为自律细胞,它们含肌原纤维甚小或完全缺乏,故收缩功能已基本丧失。还有一种细胞位于特殊传导系统的结区,既不具有收缩功能,也没有自律性,只保留了很低的传导性,是传导系统中的非自律细胞,特殊传导系统是心脏内发生兴奋和传播兴奋的组织,起着控制心脏节律性活动的作用。
心脏特殊传导系统的组成和分布心脏的特殊传导系统由不同类型的特殊分化的心肌细胞所组成。包括窦房结、房室交界、房室束和末梢浦肯野纤维网(图4-5)。
窦房结:位于右心房和上腔静脉连接处,主要含有P细胞和过渡细胞。P细胞是自律细胞,位于窦房结中心部分;过渡细胞位于周边部分,不具有自律性,其作用是将P细胞自动产生的兴奋向外传播到心房肌。
房室交界:又称为房室结区,是心房与心室之间的特殊传导组织,是心房兴奋传入心室的通道。房室交界主要包括以下三个功能区域:
房结区:位于心房和结区之间,具有传导性和自律性。
结区:相当于光学显微镜所见的房室结,具有传导性,无自律性。
结希区:位于结区和希氏束之间,具有传导性和自律性。
房室束(又称希氏束)及其分支:房室束走行于室间隔内,在室间隔膜部开始分为左右两支,右束支较细,沿途分支少,分布于右心室,左束支呈带状,分支多,分布于左心室,房室束主要含浦肯野细胞。

图4-5 心脏各部分心肌细胞的跨膜电位和兴奋传导速度
SAM:窦房结 AM:心房肌 AVN;结区 BH:希氏束 PE;哺肯野纤维
TPF:末梢浦肯野纤维 VM:心室肌传导速度单位m/s
浦肯野纤维网:是左右束支的最后分支,由于分支很多,形成网状,密布于左右心室的心内膜下,并垂直向心外膜侧伸延,再与普通心室肌细胞相连接。房室束及末梢浦肯野纤维网的作用,是将心房传来的兴奋迅速传播到整个心室。
关于是否存在心房传导束的问题,争论很多。60年代,Janes提出在窦房结和房室结区之间有三条由浦肯野细胞构成的心房传导束,分别称前、中、后结间束,其兴奋传导速度比一般心房肌为快。但是,近20年来的研究未能证实心房内有形态结构上不同于心房(工作)细胞的特殊传导组织组成的心房传导束存在;另一方面,研究结果表明,在右心房的某些部位(如卵圆窝前方和界嵴处)心房肌纤维排列方向一致,结构整齐,因此其传导速度较其它部位心房肌(这些心房肌被右心房壁上腔静脉开口卵圆窝所形成的孔穴所分割,形成断续状)为快,从而在功能上构成了将窦房结兴奋快速传播到房室交界处的所谓优势传导通路(preferential pathway) 。
一、心肌细胞的生物电现象
与骨骼肌相比,心肌细胞的跨膜电位在波形上和形成机制上要复杂得多;不但如此,上述不同类型的心肌细胞的跨膜电位(图4-5),不仅幅度和持续时间各不相同,而且波形和形成的离子基础也有一定的差别;各类心肌细胞电活动的不一致性,是心脏兴奋的产生以及兴奋向整个心脏传播过程中表现出特殊规律的原因。
(一)工作细胞的跨膜电位及其形成机制
1.静息电位和动作电位人和哺乳动物的心室肌细胞和骨骼肌细胞一样,在静息状态下膜两侧呈极化状态,膜内电位比膜外电位约低90mV,但两者的动作电位有明显不同。骨骼肌细胞动作电位的时程很短,仅持续几个毫秒,复极速度与去极速度几乎相等,记录曲线呈升支和降支基本对称的尖锋状。心室肌细胞动作电位的主要特征在于复极过程比较复杂,持续时间很长,动作电位降支与升支很不对称。通常用0、1、2、3、4等数字分别代表心室肌细胞动作电位和静息电位的各个时期。
(1)除极(去极)过程:除极过程又称0期。在适宜的外来刺激作用下,心室肌细胞发生兴奋,膜内电位由静息状态下的-90mV迅速上升到+30mV左右,即肌膜两侧原有的极化状态被消除并呈极化倒转,构成动作电位的升支。除极相很短暂,仅占1-2ms,而且除极幅度很大,为120mV;可见,心室肌细胞的除极速度很快,膜电位的最大变化速率可达800-1000V/s。
(2)复极过程:当心室细胞除极达到顶峰之后,立即开始复极,但整个复极过程比较缓慢,包括电位变化曲线的形态和形成机制均不相同的三个阶段:
1期复极:在复极初期,仅出现部分复极,膜内电位由+30mV迅速下降到0mV左右,故1期又称为快速复极初期,占时约10ms。0期除极和1期复极这两个时期的膜电位的变化速度都很快,记录图形上表现为尖锋状,故在心肌细胞习惯上常把这两部分合称为锋电位。
2期复极:当1期复极膜内电位达到0mV左右之后,复极过程就变得非常缓慢,膜内电位基本上停滞于0mV左右,细胞膜两侧呈等电位状态,记录图形比较平坦,故复极2期又称为坪或平台期,持续约100-150ms,是整个动作电位持续时间长的主要原因,是心室肌细胞以及其它心肌细胞的动作电位区别于骨骼肌和神经纤维的主要特征。
3期复极;2期复极过程中,随着时间的进展,膜内电位以较慢的速度由0mV逐渐下降,延续为3期复极,2期和3期之间没有明显的界限。在3期,细胞膜复极速度加快,膜内电位由0mV左右较快地下降到-90mV,完成复极化过程,故3期又称为快速复极末期,占时约100-150ms 。
4期:4期是膜复极完毕、膜电位恢复后的时期。在心室肌细胞或其它非自律细胞,4期内膜电位稳定于静息电位水平,因此,4期又可称为静息期。
2.形成机制与骨骼肌一样,离子在细胞膜两侧不均匀分布所形成的浓度梯度(浓度差)(表4-1)、驱动相应离子经过当时开放的细胞膜上特殊离子通道的跨膜扩散,是心肌细胞跨膜电位形成的主要基础,只是由于心肌细胞膜上具有数目较多的离子通道,跨膜电位形成机制中涉及的离子流远比骨骼肌要复杂得多。在电生理学中,电流的方向以正离子在膜两侧的流动方向来命名,正离子外流或负离子内流称外向电流,正离子内流或负离子外流称内向电流。外向电流导致膜内电位向负电性转化,促使膜复极,内向电流导致膜内电位向正电性转化,促使膜除极。
表4-1 心肌细胞中各种主要离子的浓度及平衡电位值
| 离 子 |
浓度(mmo1/L) 细胞内液 细胞外液 |
内/外比值 |
平衡电位(mV) (由Nernst公式计算) |
| Na+ |
30 |
140 |
1:4,6 |
+41 |
| K+ |
140 |
4 |
35:1 |
-94 |
| Ca2+ |
10-4 |
2 |
1:20,000 |
+132 |
| CI- |
30 |
104 |
1:3.5 |
-33 |
除离子跨膜扩散之外,由细胞上离子泵所实现的离子主动转运和离子交换,在心肌细胞电活动中也占有重要地位。
心室肌细胞静息电位的形成机制与骨骼肌相同,也就是说,尽管肌膜两侧上述几种离子都存在有浓度梯度,但静息状态下肌膜对K+的通透性较高,而对其它离子的通透性很低,因此,K+顺其浓度梯度由膜内向膜外扩散所达到的平衡电位,是静息电位的主要来源。
肌膜钠通道的大量开放和膜两侧浓度梯度及电位梯度的驱动从而出现Na+快速内流,是心室肌细胞0期去极形成的原因。进一步对整个去极过程进行分析就可以看到,与骨骼肌一样,在外来刺激作用下,首先引起部分电压门控式Na+通道开放和少量Na+内流,造成肌膜部分去极化,膜电位绝对值下降;而当膜电位由静息水平(膜内-90mV)去极化到阈电位水平(膜内-70mV)时,膜上Na+通道开放概率明显增加,出现再生性Na+内流(参看第二章),于是Na+顺其浓度梯度和电位梯度由膜外快速进入膜内,进一步使膜去极化,膜内电位向正电性转化。决定0期去极的Na+通道是一种快通道,它不但激活、开放的速度很快,而且激活后很快就失活,当膜除极到一定程度(omV左右)时,Na+通道就开始失活而关闭,最后终止Na+的继续内流。快Na+通道可被河豚毒(TTX)所阻断。由于Na+通道激活速度非常之快,又有再生性循环出现,这就是心室肌细胞0期去极速度很快,动作电位升支非常陡峭的原因。正因为如此,从电生理特性上,尤其是根据0期除极的速率,将心室肌细胞(以及具有同样特征的心肌细胞)称为快反应细胞,其动作电位称为快反应电位,以区别于以后将要介绍的慢反应细胞和慢反应电位。
复极1期是在0期除极之后出现的快速而短暂的复极期,此时快钠通道已经失活,同时激活一种一过性外向电流(Ito),从而使膜迅速复极到平台期电位水平(0~-20mV)。至于Ito的离子成分,70年代曾认为是Cl-(即Cl-内流)。近年来,根据Ito可被四乙基铵和4-氨基吡啶等K+通道阻滞剂所阻断的研究资料,认为K+才是Ito的主要离子成分。也就是说,由K+负载的一过性外向电流是动作电位初期快速复极的主要原因。目前对Ito的通道特征尚不十分清楚,但有资料提示,膜除极和细胞内Ca2+都可以使Ito的通道激活。
平台期初期,膜电位稳定于0mV左右,随后才非常缓慢地复极。膜电位的这种特征是由于平台期同时有内向电流和外向电流存在,初期,两种电流处于相对平衡状态,随后,内向电流逐渐减弱,外向电流逐渐增强,总和的结果是出现一种随时间推移而逐渐增强的、微弱的外向电流,导致膜电位缓慢地向膜内负电性转化。电压钳研究结果表明,在心室肌等快反应细胞,平台期外向离子流是由K+携带的(称Ik1)。静息状态下,K+通道的通透性很高,在0期除极过程中,K+的通透性显著下降,K+外流大大减少,除极相结束时,K+的通透性并不是立即恢复到静息状态下的那种高水平,而是极其缓慢地、部分地恢复,K+外流也就由初期的低水平而慢慢增加(图4-6)。平台期内向离子流主要是由Ca2+(以及Na+)负载的。已经证明,心肌细胞膜上有一种电压门控式的慢Ca2+通道,当膜除极到-40mV时被激活,Ca2+顺其浓度梯度向膜内缓慢扩散从而倾向于使膜除极,与此同时,上述微弱的K+外流倾向于使膜复极化,在平台期早期,Ca2+的内流和K+的外流所负载的跨膜正电荷时相等,膜电位稳定于1期复极所达到的电位水平。随着时间推移,Ca2+通道逐渐失活,K+外流逐渐增加,其结果,出膜的净正电荷量逐渐增加,膜内电位于是逐渐下降,形成平台期晚期。此后,Ca2+通道完全失活,内向离子流终止,外向K+流进一步增强,平台期延续为复极3期,膜电位较快地回到静息水平,完成复极化过程。
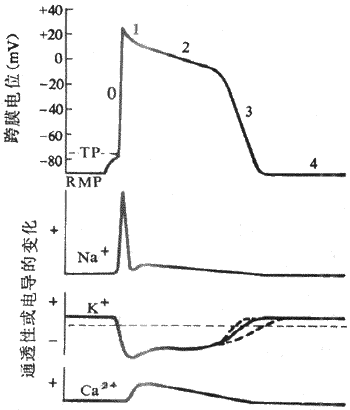
图4-6 心室肌细胞跨膜电位及其形成的离子机制
RMP:静息膜电位 TP :阈电位
肌膜上有Ca2+通道,是心室肌细胞和其它心肌细胞的重要特征。大量研究表明:①从一个心肌细胞的总体而言(不是从单个通道而言),Ca2+通道的激活、失活,以及再复活所需时间均比Na通道要长,经 Ca2+通道跨膜的Ca2+内流,起始慢,平均持续时间也较长。因此相应称为慢通道和慢内向离子流;②慢通道也是电压门控式的,激活慢通道的阈电位水平(-50~-35mV)高于快Na通道(-70~-55mV);③它对某些理化因素的敏感性和反应性不同于快通道,可被Mn2+和多种Ca2+阻断剂(如异博定,D-600等)所阻断,而对于可以阻断快通道的河豚毒和细胞膜的持续低极化状态(膜内电位-50Mv左右)却并不敏感。各种心肌细胞的肌膜上都具有这种慢通道,由此形成的跨膜离子流,是决定心肌细胞电活动以及心室肌等快反应细胞动作电位平台期的最重要的内向离子流之一。
平台期之后,膜的复极逐渐加速,因此时Ca2+通道已经失活,在平台期已经激活的外向K+流出现随时间而递增的趋势。其原因是,3期的复极K+流是再生性的,K+的外流促使膜内电位向负电性转化,而膜内电位越负,K+外流就越增高。这种正反馈过程,导致膜的复极越来越快,直至复极化完成。
在4期内,心室肌细胞膜电位基本上稳定于静息电位水平,但是,离子的跨膜转运仍然在活跃进行。因为,动作电位期间有Na+和Ca2+进入细胞内,而K+外流出细胞,因此,只有从细胞内排出多余的Na+和Ca2+,并摄入K+才能恢复细胞内外离子的正常浓度梯度,保持心肌细胞的正常兴奋性。这种离子转运是逆着浓度梯度进行的主动转运过程。像骨骼肌一样,通过肌膜上Na+-K+泵的作用,将Na+的外运和K+的内运互相耦联形成Na+-K+转运,同时实现Na+和K+的主动转运。关于主动转运Ca2+的转运机制,还没有完全弄清楚。目前大多数作者认为,Ca2+的逆浓度梯度的外运是与Na+的顺浓度的内流相耦合进行的。形成Na+-Ca2+交换。Ca2+的这种主动转运是由Na+ 的内向性浓度梯度提供能量的,由于Na+内向性浓度梯度的维持是依靠Na+-K+泵而实现的,因此,Ca2+主动转运也是由Na+-K+泵提供能量的。在4期开始后,膜的上述主动转运功能加强,细胞内外离子浓度梯度得以恢复。总的来看,这时转运过程引起的跨膜交换的电荷量基本相等,因此,膜电位不受影响而能维持稳定。
(二)自律细胞的跨膜电位及其形成机制
在没有外来刺激时,工作细胞不能产生动作电位,在外来刺激作用下,产生一次动作电位,但两次动作电位之间膜电位是稳定不变的。而在自律细胞,当动作电位3期复极未期达到最大值(称最大复极电位)之后,4期的膜电位并不稳定于这一水平,而是立即开始自动除极,除极达阈电位后引起兴奋,出现另一个动作电位。这种现象,周而复始,动作电位就不断地产生。出现于4期的这种自动除极过程,具有随时间而递增的特点,其除极速度远较0期除极缓慢;不同类型的自律细胞4期除极速度参差不一,但同类自律细胞4期除极速度比较恒定。这种4期自动除极(亦称4期缓慢除极或缓慢舒张期除极),是自律细胞产生自动节律性兴奋的基础。
根据细胞膜除极的跨膜电流的基本规律可分析自律细胞4期自动除极形成的机制。不难推测,自律细胞由于净外向电流使膜复极(3期)达最大复极电位后,在4期中又出现一种逐渐增强的净内向电流,从而使膜内正电位逐渐增加,膜便逐渐除极。这种进行性净内向电流的产生,有以下三种可能的原因:①内向电流的逐渐增强;②外向电流的逐渐衰退;③两者兼有。不同类型的自律细胞,4期自动除极都是由这种进行性净内向电流所引起,但构成净内向电流的离子流的方向和离子本质并不完全相同。
1.浦肯野细胞浦肯野细胞是一种快反应自律细胞。作为一种快反应型细胞,它的动作电位的形态与心室肌细胞相似,产生的离子基础也基本相同。
关于浦肯野细胞4期自动除极形成的机制,80年代研究资料表明,在浦肯野细胞,随着复极的进行,导致膜复极的外向K+电流逐渐衰减,而同时在膜电位4期可记录到一种随时间推移而逐渐增强的内向电流(If)(图4-7)。If通道在动作电位3期复极电位达-60mV左右开始被激活开放,其激活程度随着复极的进行、膜内负电性的增加而增加,至-100mV左右就充分激活。因此,内向电流表现出时间依从性增强,膜的除极程度因而也随时间而增加,一旦达到阈电位水平,便又产生另一次动作电位,与此同时,这种内向电流在膜除极达-50mV左右因通道失活而中止。可见,动作电位的复极期膜电位本身是引起这种内向电流启动和发展的因素,内向电流的产生和增强导致膜的进行性除极,而膜的除极一方面引起另一次动作电位,一方面又反过来中止这种内向电流。这一连串的过程是自律细胞“自我”启动、“自我”发展,又“自我”限制的,由此可以理解为什么自律细胞能够自动地、不断地产生节律性兴奋。
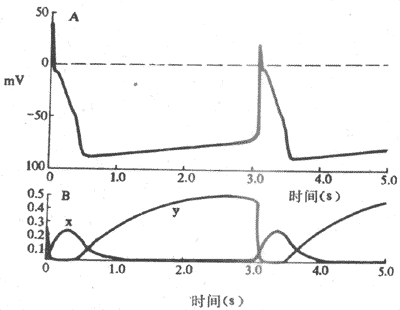
图4-7 浦肯野细胞起搏机制
A;跨膜电位 B:由х闸门控制的Ik衰减以及由у闸门控制的If,两者在形成起搏电位中的相对关系
这种4期内向电流,通常称为起搏电流,其主要离子成分为Na+ ,但也有K+参与。由于使它充分激活的膜电位为-100mV,因而认为,构成起搏内向电流的是一种被膜的超极化激活的非特异性内向(主要是是Na+)离子流,标志符号为If。If的通道允许Na+通过,但不同于快Na+通道,两者激活的电压水平不同;If可被铯(Cs)所阻断,而河豚毒却不能阻断它。目前,关于If及其通道的研究资料尚有若干不能充分予以解释的疑点,对If的进一步研究正受到心肌电生理学者们的高度关注。
2.窦房结细胞的跨膜电位及其形成机制 窦房结含有丰富的自律细胞,动作电位复极后出现明显的4期自动除极,但它是一种慢反应自律细胞,其跨膜电位具有许多不同于心室肌快反应细胞和浦肯野快反应自律细胞的特征:①窦房结细胞的最大复极电位(-70mV)和阈电位(-40mV)均高于(电位较正)浦肯野细胞;②0期除极结束时,膜内电位为0mV左右,不出现明显的极化倒转;③其除极幅度(70mV)小于浦肯野细胞(为120mV),而0期除极时程(7ms左右)却又比后者(1-2ms)长得多。原因是窦房结细胞0期除极速度(约10V/s)明显慢于浦肯野细胞(200-1000V/s),因此,动作电位升支远不如后者那么陡峭;④没有明显的复极1期和平台期;⑤4期自动除极速度(约0.1V/s)却比浦肯野细胞(约0.02V/s)要快,记录曲线上窦房结细胞4期膜电位变化的斜率大于浦肯野细胞.图4-8显示心室肌快反应细胞与窦房结细胞跨膜电位变化的差别。
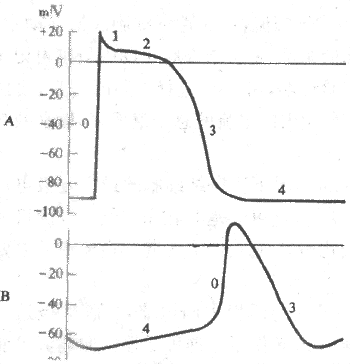
图4-8 心室肌(A)与窦房结(B)细胞跨膜电位的比较
窦房结细胞的直径很小,进行电生理研究有一定困难。直到70年代中期,才开始在窦房结小标本上采用电压钳技术对其跨膜离子流进行了定量研究,但目前尚未能充分阐明它的跨膜电位,尤其是4期起搏电流的离子基础。学者们观察到,窦房结细胞0期除极不受细胞外Na+浓度的影响,对河豚毒很不敏感;相反,它受细胞外Ca2+浓度的明显影响,并可被抑制钙通道的药物和离子(如异搏定、D-600和Mn2+等)所阻断。据此可以认为,引起窦房结细胞动作电位0期除极的内向电流是由Ca2+负载的。这种内向电流被称为第二内向电流;而引起快反应细胞(心室肌、心房肌和浦肯野细胞)0期除极的快Na+内流称为第一内向电流。根据已有的研究资料,可将窦房结细胞动作电位的形成过程描述如下:当膜电位由最大复极电位自动除极达阈电位水平时,激活膜上钙通道,引起Ca2+内向流(Ica),导致0期除极;随后,钙通道逐渐失活,Ca2+内流相应减少;另一方面,在复极初期,有一种K+通道被激活,出现K+外向流(Ik)。Ca2+内流的逐渐减少和K+外流的逐渐增加,膜便逐渐复极。由“慢”通道所控制、由Ca2+内流所引起的缓慢0期除极,是窦房结细胞动作电位的主要特征,因此,相应称为慢反应细胞和慢反应电位,以区别于前述心室肌等快反应细胞和快反应电位。
窦房结细胞的4期自动除极也由随时间而增长的净内向电流所引起,但其构成成分比较复杂,是几种跨膜离子流的混合。目前已知,在窦房结细胞4期可以记录到三种膜电流,包括一种外电流和两种内向电流,不过它们在窦房结细胞起搏活动中所起作用的大小以及起作用的时间有所不同。
(1)Ik通道的激活和逐渐增强所造成的K+外向流,是导致窦房结细胞复极的原因。Ik通道在膜复极达-40mV时便开始逐渐失活,K+外流因此渐渐减少,导致膜内正电荷逐渐增加而形成4期除极。目前认为,由于Ik通道的时间依从性逐渐失活所造成的K+外流进行性衰减,是窦房结细胞4期自动除极的最重要的离子基础(图4-9);
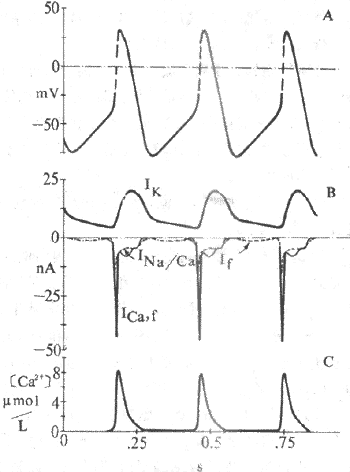
图4-9 窦房结动作电位和起搏电位的离子机制
A.跨膜电位 B.越膜电位C. 胞浆Ca2+浓度表示动作电位升支由Ica,
f构成,起搏电位 由Ik和If及Ina/Ca构成
(2)If:If是一种进行性增强的内向离子(主要为Na+)流,在浦肯野细胞起搏活动中,If起着极重要的作用,而Ik衰减的作用很小。与此恰相反,窦房结细胞4期虽也可记录到If ,但它对起搏活动所起的作用不如Ik衰减。实验证明,用Cs2+选择性阻断If后,窦房结自发放频率仅轻度减少;对家兔窦房结细胞4期净内向电流的总幅值而言,Ik衰减与If两者所起作用的比例为6:1。
If通道的最大激活电位为-100mV左右,而正常情况下窦房结细胞的最大复极电位为-70mV,在这种电位水平下,If通道的激活十分缓慢,这可能是If在窦房结4期除极过程中所起作用不大的原因。若窦房结细胞发生超级化时,If则可能成为起搏电流中的主要成分。
(3)此外,窦房结细胞4期中还存在一种非特异性的缓慢内向电流,在膜除极达-60mV时被激活,可见,它在自动除极过程的后1/3期间才起作用。这种缓慢内向电流可能是生电性Na+-Ca2+交换的结果(Na+-Ca2+交换时,心肌细胞排出一个Ca2+,摄入3个Na+,出/入细胞正电荷之比为2:3,形成内向电流)。
心肌细胞的类型 除了按照功能和电生理特性将心肌细胞分为工作细胞和自律细胞之外,还可以根据其生物活动的特征,特别是动作电位0期除极的速度,将心肌细胞分为快反应细胞和慢反应细胞,其动作电位相应称为快反应电位和慢反应电位;然后再结合其自律性,可将心肌细胞分为以下四种类型:
快反应非自律细胞:包括心房肌细胞和心室肌细胞;
快反应自律细胞:浦肯野自律细胞;
慢反应自律细胞:窦房结自律细胞,以及房结区和结希区的自律细胞;
慢反应非自律细胞:结区细胞。
心肌细胞的跨膜离子流 由多种离子通过细胞膜上的特异性或非特异性离子通道以及经离子交换转运形成的跨膜离子运动,是心肌细胞跨膜电位形成的基础。心肌细胞跨膜离子流的种类众多,性质很复杂,近年又取得许多进展。由于在实验研究中对这些离子通道的命名和认识比较混乱,甚至前后矛盾,故将目前比较肯定的主要几种离子流和通道的名称、存在的部位和作用归纳介绍如下:
1.内向离子流
(1)INa:称为快速Na+流,存在于快反应细胞,是引起快反应细胞0期除极的内向电流(称第一内向电流)的离子基础。
(2)Isi:称为缓慢内向电流,也称第二内向电流,过去认为它是一种由慢通道控制的缓慢Ca2+流,故标志为ICa,其功能是构成快反应细胞的平台期和慢反应细胞的除极期。新近的研究结果在很大程度上修正了对Ica的认识。目前认为,第二内向电流并不是单一的Ca2+流,而是由特性各异的三个组分所构成;第一组分称Ica.f,二、三组分别称Is1.2和Ica.s。其中①Ica.f是一种快速Ca2+流,其通道激活和失活的速度远比已往所认为的要快得多。它融合于快反应细胞Na+内流的最后部分,共同形成动作电位升支的上段,而对平台期的作用很小。它是慢反应细胞除极的离子基础。对工作细胞而言,肌浆网Ca2+再生性释放帅细胞外Ca2+进入胞浆触发的,既然Ica.f的激活十分迅速,那么Ca2+释放的触发有及兴奋-收缩耦联的启动速度都比以往认为的要快得多;②第三组分Ica.s,是一种较Ica.f微弱而缓慢的Ca2+流,主要作用是维持快反应细胞平台期;③Is1.2称第二内向电流第二组分,其离子本质不甚清楚,可能是Na+-Ca2+交换的生电电流,故也称为INa.Ca,在平台期起作用;慢反应自律细胞4期自动除极晚期也有它的作用。
(3)If:超极化激活的非特异性内向离子流,主要由Na+携带,存在于自律细胞4期。If是决定浦肯野快反应自律起搏活动的主要负离子流,而在窦房结慢反应自律细胞起搏活动中,其作用不如Ik衰减。
2.外向离子流
(1)Ikl:存在于快反应细胞,是决定快反应工作细胞静息电位的离子流,并在复极2期和3期起复极作用;
(2)Ik:这种外向电流主要由K+携带,但也有Na2+参加,不是单纯的K+流,故又称Ix,在快反应细胞复极3期起重要作用,故又称为复极电流,因而也决定着浦肯野细胞的最大复极电位;Ix也存在于慢反应自律细胞,促使膜复极,4期内呈进行性衰减,是形成4期除极的主要离子基础;
(3)Ito:是快反应细胞1期复极的离子流,离子成分主要为K+,也有Na+参与。
3.化学门控离子通道 近年相继证实,在心肌细胞膜上,除了电压门控通道外,还存在化学门控离子通道;它们的作用并不在于维持和产生正常跨膜电位(静息电位和动作电位),但对于心肌细胞活动的调节以及异常电活动的电生产有着特别重要的意义。重要的化学门控离子通道有以下三种;
(1)乙酰胆碱控制的K+通道(Ik-ACh):早年曾认为ACh激活的是Ikl,近年发现是通过G蛋白激活开放了另一种与在生物物理学特性和生理学特性上均不相同的K+通道。
(2)ATP依从性K+通道(Ik-ATP):ATP的作用并不是分解供能激活此通道,而是维持此通道在正常情况下处于关闭状态。当心肌细胞内ATP降到临界水平以下时(如心肌缺血时),此种特殊的K+通道开放。大量K+外漏以致缺血心肌细胞局部高钾而引起除极,诱发心律失常。硫脲类药物可阻断此通道。
(3)INa–k—Ca2+通道:是细胞内Ca2+增高时激活的一种非特异性正离子通道,载流离子是Na+和K+,形成一过性内向离子流(Iti)。实验表明,在某些情况下,浦肯野细胞在动作电位复极后可产生一种除极电位(延迟后除极电位),当它达阈电位时就可以诱发另一个新的动作电位,形成异位搏动。Iti就是延迟后除极电位的离子基础。洋地黄中毒,细胞外低K+或低Na+,以及咖啡因、儿茶酚胺等可引起细胞内Ca2+超负荷的因素,均可诱发或加强Iti和延迟后除极电位。
二、心肌的电生理特性
心肌组织具有兴奋性、自律性、传导性和收缩性四种生理特性。心肌的收缩性是指心肌能够在肌膜动作电位的触发下产生收缩反应的特性,它是以收缩蛋白质之间的生物化学和生物物理反应为基础的,是心肌的一种机械特性。兴奋性、自律性和传导性,则是以肌膜的生物电活动为基础的,故又称为电生理特性。心肌组织的这些生理特性共同决定着心脏的活动。
(一)心肌的兴奋性
所有心肌细胞都具有兴奋性,即具有在受到刺激时产生兴奋的能力。衡量心肌的兴奋性,同样可以采用刺激的阈值作指标,阈值大表示兴奋性低,阈值小表示兴奋性高。
1.决定和影响兴奋性的因素 从关于兴奋产生过程的叙述中可知,兴奋的产生包括静息电位去极化到阈电位水平以及Na+通道(以快反应型细胞为例)的激活这样两个环节;当这两方面的因素发生变化时,兴奋性将随之发生改变。
(1)静息电位水平:静息电位(在自律细胞,则为最大复极电位)绝对值增大时,距离阈电位的差距就加大,引起兴奋所需的刺激阈值增大,表现为兴奋性降低。反之,静息电位绝对值减少时,距阈电位的差距缩小,所需的刺激阈值减少,兴奋性增高。
(2)阈电位水平:阈电位水平上移,则和静息电位之间的差距增大,引起兴奋所需的刺激阈值增大,兴奋性降低。反之亦然。
静息电位水平和(或)阈电位水平的改变,都能够影响兴奋性,但在心脏,以静息电位水平改变为多见的原因。
(3)Na+通道的性状:上述兴奋的产生时,都是以Na+通道能够被激活作为前提。事实上,Na+通道并不是始终处于这种可被激活的状态,它可表现为激活、失活和备用三种功能状态:而Na+通道处于其中哪一种状态,则取决于当时的膜电位以及有关的时间进程。这就是说,Na+通道的活动是电压依从性和时间依从性的。当膜电位处于正常静息电位水平-90mV时,Na+通道处于备用状态。这种状态下,Na+通道具有双重特性,一方面,Na+通道是关闭的;另一方面,当膜电位由静息水平去极化到阈电位水平(膜内-70mV)时,就可以被激活,Na+通道迅速开放,Na+因而得以快速跨膜内流。Na+通道激活后就立即迅速失活,此时通道关闭,Na+内流迅速终止。Na+通道的激活和失活,都是比较快速的过程;前者在1ms 内,后者约在几毫秒到10ms内即可完成。处于失活状态的Na+通道不仅限制了Na+的跨膜扩散,并且不能被再次激活;只有在膜电位恢复到静息电位水平时,Na+通道才重新恢复到备用状态,即恢复再兴奋的能力,这个过程称为复活。由上可见,Na+通道是否处备用状态,是该心肌细胞当时是否具有兴奋性的前提;而正常静息膜电位水平又是决定Na+通道能否处于或能否复活到备用状态的关键。Na+通道的上述特殊性状,可以解释有关心肌细胞兴奋性的一些现象。例如,当膜电位由正常静息水平(-90mV)去极化到阈电位水平(-70mV)时,Na+通道被激活,出现动作电位;而如果静息状况下膜电位为-50mV左右,即肌膜处于持续低极化状态时,就不能引起Na+通道激活,表现为兴奋性的丧失。至于Na+通道上述三种状态的实质以及膜电位是如何影响Na+通道性状的问题,目前尚未彻底阐明。
2.一次兴奋过程中兴奋性的周期性变化心肌细胞每产生一次兴奋,其膜电位将发生一系列有规律的变化,膜通道由备用状态经历激活、失活和复活等过程,兴奋性也随之发生相应的周期性改变。兴奋性的这种周期性变化,影响着心肌细胞对重复刺激的反应能力,对心肌的收缩反应和兴奋的产生及传导过程具有重要作用。心室肌细胞一次兴奋过程中,其兴奋性的变化可分以下几个时期(图4-10):
(1)有效不应期:心肌细胞发生一次兴奋后,由动作电位的去极相开始到复极3期膜内电位达到约-55mV这一段时期内,如果再受到第二个刺激,则不论刺激有多强,肌膜都不会进一步发生任何程度的去极化;膜内电位由-55mV继续恢复到约-60mV这一段时间内,如果给予的刺激有足够的强度,肌膜可发生局部的部分去极化,但并不能引起扩播性兴奋(动作电位)。心肌细胞兴奋后不能立即再产生第二次兴奋的特性,称为不应性,不应性表现为可逆的、短暂的兴奋性缺失或极度下降。心肌细胞一次兴奋过程中,由0期开始到3期膜内电位恢复到-60mV这一段不能再产生动作电位的时期,称为有效不应期。其原因是这段时间内膜电位绝对值太低,Na+通道完全失活(前一阶段),或刚刚开始复活(后一阶段),但还远远没有恢复到可以被激活的备用状态的缘故。
(2)相对不应期:从有效不应期完毕(膜内电位约-60mV)到复极化基本上完成(约-80mV)的这段期间,为相对不应期。这一时期内,施加给心肌细胞以高于正常阈值的强刺激,可以引起扩播性兴奋。出现相对不应期的原因是:此期膜电位绝对值高于有效不应期末时的膜电位,但仍低于静息电位,这时Na+通道已逐渐复活,但其开放能力尚未恢复正常;故心肌细胞的兴奋性虽比有效不应期时有所恢复,但仍然低于正常,引起兴奋所需的刺激阈值高于正常,而所产生的动作电位(称期前兴奋)0期的幅度和速度都比正常为小,兴奋的传导也比较慢。此外,此期处于前一个动作电位的3期,尚有K+迅速外流的趋势,因此,在此期内新产生的动作电位,其时程较短(K+外流可使平台期缩短),不应期也较短。
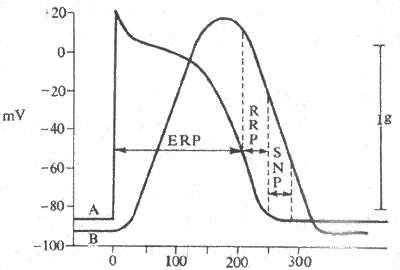
图4-10 心室肌动作电位期间兴奋性的变化及其与机械收缩的关系
A:动作电位 B:机械收缩ERP:有效不应期
RRP:相对不应期 SNP:超常期
(3)超常期:心肌细胞继续复极,膜内电位由-80mV恢复到-90mV这一段时期内,由于膜电位已经基本恢复,但其绝对值尚低于静息电位,与阈电位水平的差距较小,用以引起该细胞发生兴奋所需的刺激阈值比正常要低,表明兴奋性高于正常,故称为超常期。另一方面,此时Na+通道基本上恢复到可被激活的正常备用状态,但开放能力仍然没有恢复正常,产生的动力电位的0期去极的幅度和速度,兴奋传导的速度都仍然低于正常。
最后,复极完毕,膜电位恢复正常静息水平,兴奋性也恢复正常。
3.兴奋过程中,兴奋性周期性变化与收缩活动的关系细胞在发生一次兴奋过程中,兴奋性发生周期性变化,是所有神经和肌组织共同的特性;但心肌细胞的有效不应期特别长,一直延续到机械反应的舒张期开始之后。因此,只有到舒张早期之后,兴奋性变化进入相对不应期,才有可能在受到强刺激作用时产生兴奋和收缩。从收缩开始到舒张早期之间,心肌细胞不会产生第二个兴奋和收缩。这个特点使得心肌不会像骨骼肌那样产生完全强直收缩而始终作收缩和舒张相交替的活动,从而使心脏有血液回心充盈的时期,这样才可能实现其泵血功能。
以下实验可以说明心肌组织的这一特点。正常情况下,窦房结产生的每一次兴奋传播到心房肌或心室肌的时间,都是在它们前一次兴奋的不应期终结之后,因此,整个心脏能够按照窦房结的节律而兴奋。但在某些情况下,如果心室在有效不应期之后受到人工的或窦房结之外的病理性异常异常刺激,则可产生一次期前兴奋,引起期前收缩或额外收缩。期前兴奋也有它自己的有效不应期,这样,当紧接在期前兴奋之后的一次窦房结兴奋传到心室肌时,常常正好落在期前兴奋的有效不应期内,因而不能引起心室兴奋和收缩,形成一次“脱失”,必须等到再下一次窦房结的兴奋传到心室时才能引起心室收缩。这样,在一次期前收缩之后往往出现一段较长的心室舒张期,称为代偿性间歇(图4-11)。随之,才恢复窦性节律。
(二)心肌的自动节律性
组织、细胞能够在没有外来刺激的条件下,自动地发生节律性兴奋的特性,称为自动节律性,简称自律性。具有自动节律性的组织或细胞,称自律组织或自律细胞。组织、细胞单位时间(每分钟)内能够自动发生兴奋的次数,即自动兴奋的频率,是衡量自动节律性高低的指标。
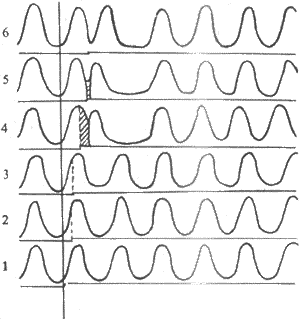
图4-11 期前收缩和代偿性间歇
每条曲线下的电磁标记号批示给予电刺激的时间,曲线1-3,
刺激落在有效不应期内,不引起反应;曲线4-6,
刺激落在相对不应期内,引起期前收缩和代偿性间歇
1.心肌的自动节律性和各自律级组织的相互关系很早以前就有人观察到,在适宜条件下,两栖类和哺乳类动物的离体心脏,在未受到任何刺激的情况下,可以长时间地、自动地、有节奏地进行兴奋和收缩。但是,只有到了近代,根据细胞内微电极技术记录的跨膜电位是否具有4期自动去极化这一特征,才确切地证明,并不是所有心肌细胞,而只是心脏特殊传导组织内某些自律细胞才具有自动节律性。特殊传导系统各个部位(结区除外)的自律性有等级差别;其中窦房结细胞自律性最高,自动兴奋频率约为每分钟100次,末梢浦肯野纤维网自律性最低(约每分钟25次),而房室交界(约每分钟50次)和房室束支的自律性依次介于两者之间。
由一个起搏点主宰整个心脏的整体活动具有极其重要的生理意义。那么,各部分自律组织的活动怎么能统一起来而不致于“各自为政”呢?实验中很容易观察到,心脏始终是依照当时情况下自律性最高的部位所发出的兴奋来进行活动的。这就是说,各部分的活动统一在自律性最高部位的主导作用之下。正常情况下,窦房结的自律性最高,它自动产生的兴奋向外扩布,依次激动心房肌、房室交界、房室束、心室内传导组织和心室肌,引起整个心脏兴奋和收缩。可见,窦房结是主导整个心脏兴奋和跳动的正常部位,故称为正常起搏点。其它部位自律组织并不表现出它们自身的自动节律性,只是起着兴奋传导作用,故称为潜在起搏点。在某种异常情况下,窦房结以外的自律组织(例如,它们的自律性增高,或者窦房结的兴奋因传导阻滞而不能控制某些自律组织)也可能自动发生兴奋,而心房或心室则依从当时情况下节律性最高部位的兴奋而跳动,这些异常的起搏部位则称为异位起搏点。
窦房结对于潜在起搏点的控制,通过两种方式实现:①抢先占领。窦房结的自律性高于其它潜在起搏点,所以,在潜在起搏点4期自动去极尚未达到阈电位水平之前,它们已经受到窦房结发出并依次传布而来的兴奋的激动作用而产生了动作电位,其自身的自动兴奋就不可能出现;②超速压抑或超速驱动压抑(overdrive suppression)。窦房结对于潜在起搏点,还可产生一种直接的抑制作用。例如,当窦房结对心室潜在起搏点的控制突然中断后,首先会出现一段时间的心室停搏,然后心室才能按其自身潜在起搏点的节律发生兴奋和搏动。出现这个现象的原因是:在自律性很高的窦房结的兴奋驱动下,潜在起搏点“被动”兴奋的频率远远超过它们本身的自动兴奋频率。潜在起搏长时间的“超速”兴奋的结果,出现了抑制效应;一旦窦房结的驱动中断,心室潜在起搏点需要一定的时间才能从被压抑状态中恢复过来,出现它本身的自动兴奋。另外还可以看到,超速压抑的程度与两个起搏点自动兴奋频率的差别呈平行关系,频率差别愈大,抑制效应愈强,驱动中断后,停搏的时间也愈长。因此,当窦房结兴奋停止或传导受阻后,首先由房室交界代替窦房结作为起搏点,而不是由心室传导组织首先代替;因为窦房结和房室交界的自动兴奋频率差距较小,超速压抑的程度较小。超速压抑产生的机制比较复杂,目前尚未完全弄清;但这一事实提示我们,在人工起搏的情况下,如因故需要暂时中断起搏器时,在中断之前其驱动频率应该逐步减慢,以避免发生心搏暂停。
2.决定和影响自律性的因素自律细胞的自动兴奋,是4期膜自动去极化使膜电位从最大复极电位达到阈电位水平而引起的。因此,自律性的高低,既受最大复极电位与阈电位的差距的影响,也取决于4期膜自动去极的速度(图4-12)。
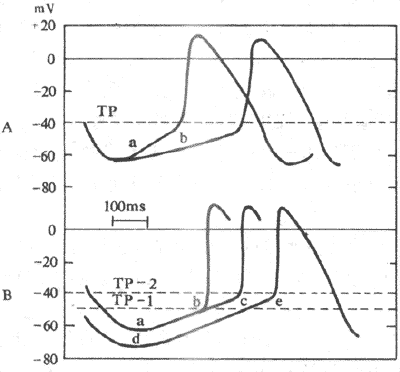
图4-12 影响自律性的因素
A:起搏电位斜率由a减少到b时,自律性降低
B:最大复极电位水平由a达到d,或阈电位由TP-1升到TP-2时,自律性均降低 Tp :阈电位
(1)最大复极电位与阈电位之间的差距:最大复极电位绝对值减少和(或)阈电位下移,均使两者之间的差距减少,自动去极化达到阈电位水平所需时间缩短,自律性增高;反之亦然。例如,迷走神经系统兴奋时可使窦房结自律细胞K+通道开放率增高,故其复极3期内K+外流增加,最大复极电位绝对值增大,自律性降低,心率减慢。
(2)4期自动除极速度:4期自动除极速度与膜电位从最大复极电位水平达到阈电梯水平所需时间密切相关;若除极速度增快,达阈电位水平所需时间缩短,单位时间内发生兴奋的次数增多,自律性增高。从前一节已知,4期自动除极速度取决于净内向电流增长的速度,即取决于膜内净正电荷增长速度。例如,儿茶酚胺可以增强If,因而加速浦肯野细胞4期除极速度,提高其自律性。
(三)心肌的传导性和心脏内兴奋的传导
心肌在功能上是一种合胞体,心肌细胞膜的任何部位产生的兴奋不但可以沿整个细胞膜传播,并且可以通过闰盘传递到另一个心肌细胞,从而引起整块心肌的兴奋和收缩。动作电位沿细胞膜传播的速度可作为衡量传导性的指标。
1.心脏内兴奋传播的途径和特点 正常情况下窦房结发出的兴奋通过心房肌传播到整个右心房和左心房,尤其是沿着心房肌组成的“优势传导通路”迅速传到房室交界区,经房室束和左、右束支传到浦肯野纤维网,引起心室肌兴奋,再直接通过心室肌将兴奋由内膜侧向外膜侧心室肌扩布,引起整个心室兴奋。由于各种心肌细胞的传导性高低不等,兴奋在心脏各个部分传播的速度是不相同的。在心房,一般心房肌的传导速度较慢(约为0.4m/s),而“优势传导通路”的传导速度较快,窦房结的兴奋可以沿着这些通路很快传播到房室交界区。在心室,心室肌的传导速度约为1m/s,而心室内传导组织的传导性却高得多,末梢浦肯野纤维传导速度可达4m/s,而且它呈网状分布于心室壁,这样,由房室交界传入心室的兴奋就沿着高速传导的浦肯野纤维网迅速而广泛地向左右两侧心室壁传导。很明显,这种多方位的快速传导对于保持心室的同步收缩是十分重要的。房室交界区细胞的传导性很低,其中又以结区最低,传导速度仅0.02m/s。房室交界是正常时兴奋由心房进入心室的唯一通道,交界区这种缓慢传导使兴奋在这里延搁一段时间(称房-室延搁)才向心室传播,从而可以使心室在心房收缩完毕之后才开始收缩,不致于产生房室收缩重叠的现象。可以看出,心脏内兴奋传播途径的特点和传导速度的不一致性,对于心脏各部分有次序地、协调地进行收缩活动,具有十分重要的意义。
2.决定和影响传导性的因素 心肌的传导性取决于心肌细胞某些结构特点和电生理特性。
(1)结构因素:细胞直径与细胞内电阻呈反变关系,直径小的细胞内电阻大,产生的局部电流小于粗大的细胞,兴奋传导速度也较后者缓慢。心房肌、心室肌和浦肯野细胞的直径大于窦房结和房室交界细胞,其中,末梢浦肯野细胞的直径最大(在某些动物,直径可达70μm),兴奋传导速度最快;窦房结细胞直径很小(约5-10μm),传导速度很慢;而结区细胞直径更小,传导速度也最慢。
在机体生命过程中,心肌细胞直径不会突然发生明显的变化,因此,它只是决定传导性的一个比较固定的因素,对于各种生理或某些病理情况下心肌传导性的变化,不起重要作用。
(2)生理因素:心肌细胞的电生理特性是决定和影响心肌传导性的主要因素。与其它可兴奋细胞相同,心肌细胞兴奋的传播也是通过形成局部电流而实现的(参看第二章)。因此,可以从局部电流的形成和邻近未兴奋部位膜的兴奋性这两方面来分析影响传导性的因素。这两方面因素是密切相关联的,为了方便才分别叙述。
动作电位0期除极的速度和幅度局部电流是兴奋部位膜0期去极所引起的,0期去极的速度愈快,局部电流的形成也就愈快,很快就促使邻近未兴奋部位膜去极达到阈电位水平,故兴奋传导愈快。另一方面,0期去极幅度愈大,兴奋和未兴奋部位之间的电位差愈大,形成的局部电流愈强,兴奋传导也愈快。问题是,为什么局部电流的强度能影响传导速度?可能是强的局部电流扩布的距离大,可以使距兴奋部位更远的下游部位受到局部电流的刺激而兴奋,故兴奋的传导较快。除了细胞直径这个因素之外,浦肯野纤维等快反应细胞0期去极速度和幅度明显高于窦房结等慢反应细胞,是前者传导性比后者为高的主要原因。
已知,各种心肌细胞0期去极速度和幅度的差别,主要由膜上(0期)离子通道的固有性质决定。那么,同一心肌细胞(以快反应细胞为例)0期去极速度和幅度又受什么因素的影响?在叙述兴奋性时已经指出,快Na+通道的性状,即激活、失活和复活状态是决定兴奋性正常、缺失和低下的主要因素;也就是说,对兴奋性而言,Na+通道的性状决定着通道能否被激活开放(兴奋性的有无)以及激活的难易程度(兴奋性的高低)。这里,将进一步讨论,Na+通道的性状还决定着膜去极达阈电位水平后通道开放的速度和数量,从而决定膜0期去极的速度和幅度。Na+通道开放速度和数量这种性状,称为Na+通道的效率或可利用率(通道开放数量称开放概率)。实验证明,Na+通道的效率也是电压依从性的,它依从于临受刺激前的膜静息电位值。定量地分析Na+通道的效率(用0期去极的最大速率反映Na+通道开放的速度)与静息膜电位值的函数关系的曲线为膜反应曲线(图4-13)。膜反应曲线呈S形。正常静息电位值(-90mV)情况下,膜受刺激去极达阈电位水平后,Na+通道快速开放,0期去极最大速度可达500V/s。如膜静息电位值(绝对值)降低,去极最大速度下降;若膜静息电位值(绝对值)进一步降低到膜内为-60~-55mV时,去极速度几乎为0,即Na+通道已失活而不能开放。上述这种现象称为Na+通道效率的电压依从性下降。需要引起注意的是,在静息膜电位值(绝对值)很低(膜内-60~-55mV)状况下,如果膜受到刺激,并不是根本不产生电位变化,而是产生一种0期去极速度和幅度都很小的动作电位。这是因为,在这种情况下快Na+通道已经失活,而慢Ca2+通道未受影响,因此,原来的快反应细胞此时出现了由Ca2+内流所致的慢反应电位的缘故;兴奋传导速度也就明显减慢。不过,这已经是膜0期去极的离子通道发生了更换,不再属于Na+通道效率的量变范畴。
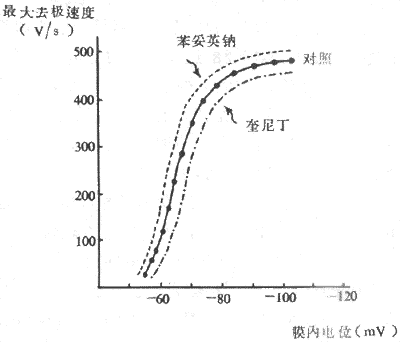
图4-13 膜反应曲线
除了静息膜电位之外,Na+通道开放的速度还受心肌细胞本身生理性质的影响。例如,苯妥英钠可使膜反应曲线左上移位,奎尼丁使之右下移位。这表明,在这些药物作用下,Na+通道开放效率仍然是电压依从性的,但是,同一静息膜电位水平的0期去极最大速度的数值并不相同,前者高于正常,后者低于正常。
膜反应曲线只描述了静息膜电位值对Na+通道开放速度即0期去极速度的影响,实际上,由Na+通道开放数量所决定的0期去极幅度也同样依从于静息膜电位值。正常静息膜电位情况下,Na+通道不但开放速度快,而且开放数量也多,动作电位0期去极的速度快,幅度也高(图4-14,左);若静息膜电位值(绝对值)低下,则产生升支缓慢、幅度低的动作电位(图4-14右)。
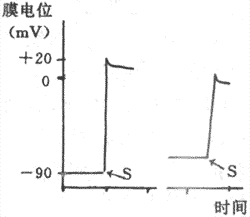
图4-14 静息膜电位对动作电位升支速度和幅度的影响
S:给予刺激
邻近未兴奋部位膜的兴奋性 兴奋的传导是细胞膜依次兴奋的过程,因此,膜的兴奋性必然影响兴奋的传导。前已述:①静息膜电位(或最大复极电位)与阈电位的差距及②邻近未兴奋部位膜上决定0期去极的离子通道的性状,是决定兴奋性从而也是影响传导性的主要因素。当差距扩大时,兴奋性降低(所需刺激阈值增高),同时,膜去极达阈电位水平所需时间延长,传导速度因此减慢。如在邻近部位形成额外刺激产生期前兴奋的情况,由兴奋部位形成的局部电流刺激就将在期前兴奋复极完成之前到达邻近部位,如落在期前兴奋的有效不应期内,则不能引起兴奋,导致传导阻滞;如落在期前兴奋的相对不应期或超常期内,可引起升支缓慢、幅度小的动作电位,兴奋传导因之减慢。可见,不应期的存在,是可能导致兴奋传导障碍的重要因素。
三、自主神经对心肌生物电活动和收缩功能的影响
支配心脏的自主神经及其递质对心肌生物电活动和收缩功能均产生明显影响,它们对心肌生物电活动和电生理特性的影响,主要是通过调节离子通道的开放而实现的,而对心肌收缩功能的调节机制则比较复杂;收缩功能的改变,除了是它们引起生物电改变的继发效应之外,还可能通过其它机制对收缩功能产生直接影响。
(一)迷走神经和乙酰胆碱的作用
迷走神经兴奋时,节后纤维释放递质乙酰胆碱,激动心肌细胞膜上M型胆碱能受体,产生负性压力、负性变时和负性传导性等效应。研究证明,乙酰胆碱能普遍提高K+通道的开放概率,促进外向K+流,是迷走神经心肌效应的主要机制。
K+外流的普遍增加将影响心肌细胞生物电活动的多个环节:①静息状态下K+外流的增加将导致静息电位绝对值增大;因此,静息电位与阈电位的差距扩大,心肌兴奋性有所下降;②在窦房结细胞,复极过程中K+外流增加的结果是最大复极电位绝对值增大;另一方面,其4期K+外流的增加将使Ik衰减过程减弱,自动除极速度减慢。这两方面因素均导致窦房结自律性降低,心率因而减慢;③复极过程中K+外流增加导致复极加速,动作电位时程缩短,有效不应期相应缩短,由于动作电位时程缩短,每一动作电位期间进入细胞内Ca2+量相应减少;除此之外,近年研究还发现,乙酰胆碱有直接抑制Ca2+通道、减少内向Ca2+流的作用。由于进入细胞内Ca2+量减少,心肌收缩能力相应降低,表现出负性变力效应。此外,当左侧迷走神经兴奋时,房室交界慢反应细胞动作电位幅度减小,兴奋传导速度减慢,这也是乙酰胆碱抑制Ca2+通道、减少Ca2+内流的结果。
(二)心交感神经和儿茶酚胺的作用
心交感神经末梢释放的递质是去甲肾上腺素,它与心肌细胞膜β型肾上腺素能受体相结合,通过某种机制(使通道蛋白质磷酸化)改变膜上离子通道的开放概率和其它亚细胞结构的功能,产生正性变力、正性变时和正性变传导性效应。肾上腺髓质分泌的去甲肾上腺素和肾上腺素,以及外源性β受体激动剂也有类似作用。乙酰胆碱心肌效应的机制相对比较单一,它主要是通过普遍提高膜的K+通道的开放概率而发挥作用的;儿茶酚胺的作用比较复杂,它除了能明显增加Ca2+通道的开放概率这一主要作用之外,还通过其它多种细胞和亚细胞机制调节心肌的电生理特性和收缩功能。其具体作用和作用机制归纳如下:①儿茶酚胺(去甲肾上腺素、肾上腺素)能加强自律细胞4期的跨膜内向电流If使4期自动除极速度加快,自律性增高;②在慢反应细胞,由于0期Ca2+内流加强加速,其动作电位上升速度和幅度均增加,房室交界区兴奋传导速度加快;③儿茶酚胺能使复极相K+外流增快,从而使复极过程加快,复极相因此缩短,不应期相应缩短。不应期缩短意味着0期离子通道复活过程加快,这与儿茶酚胺使窦房结兴奋发放频率增加的作用互相协调,使心率得以增加;④儿茶酚胺通过加强心肌收缩能力增强加速心肌的收缩,也加速心肌的舒张,其作用机制比较复杂。很明显,儿茶酚胺提高肌膜和肌浆网Ca2+通道开放概率的特性将导致细胞内Ca2+浓度增高,提供了促使心肌收缩能力增强的条件;另一方面,儿茶酚胺又促使肌钙蛋白对Ca2+亲和力下降,从而减弱心肌收缩能力。由于儿茶酚胺的前一种作用强于后者,因此,尽管它对心肌收缩能力的两种作用的方向相反,表现出的最终效果仍是强有力的正性变力作用。在儿茶酚胺作用下,心肌舒张速度增快,整个舒张过程明显加强,这是儿茶酚胺很具有特征性的一种效应。这种效应是三方面作用的结果:首先,儿茶酚胺促使肌钙蛋白对Ca2+的释放速率增加,这是因为儿茶酚胺降低了肌钙蛋白的Ca2+亲和力,Ca2+可以很快从与肌钙蛋白结合的状态下解离出来;其次,儿茶酚胺可以提高肌浆网重摄取Ca2+的速度,并可刺激Na+-Ca2+交换,使复极期向细胞排出Ca2+加速。综合上述,在儿茶酚胺作用下,舒张期胞浆Ca2+浓度下降速度增快,肌钙蛋白又很快与Ca2+解离,这些作用都有利于肌原纤维中粗、细肌丝的离解,心肌因而以较快的速度完成舒张过程。
心交感神经和儿茶酚胺对心肌的作用是多方面的,很复杂的,但这些效应是互相统一协调的。在心交感神经兴奋引起心率加快,从而使心缩期和心舒期都缩短的情况下,心肌舒张加速可以弥补因心室舒张期缩短带来的心室充盈不足的后果。另一方面,由于收缩能力增强,心肌收缩增强、增快,因此,心脏射血量也不致于因心缩期的缩短而减少;再加上兴奋传导加速,心房肌以及心室肌收缩的同步性有所加强,也促使心房或心室的收缩强度增加,有利于维持心输出量。这样,当心交感神经兴奋时,在心率加快的同时,搏出量增加或不变,心输出量因而得以大大增加。
四、体表心电图
在正常人体,由窦房结发出的一次兴奋,按一定的途径和进程,依次传向心房和心室,引起整个心脏的兴奋;因此,每一个心动周期中,心脏各部分兴奋过程中出现的电变化传播方向、途径、次序和时间等都有一定的规律。这种生物电变化通过心脏周围的导电组织和体液,反映到身体表面,使身体各部位在每一心动周期中也都发生有规律的电变化。将测量电极放置在人体表面的一定部位记录出来的心脏电变化曲线,就是临床上记录的心电图(electrocardiogram,ECG)。心电图反映心脏兴奋的产生、传导和恢复过程中的生物电变化,而与心脏的机械收缩活动无直接关系。
心肌细胞的生物电变化是心电图的来源,但是,心电图曲线与单个心肌细胞的生物电变化曲线有明显的区别(图4-15)。造成这种区别的主要原因有以下几点:①单个心肌细胞电变化是用细胞内电极记录法得到的,即一个测量电极放在细胞外表面而另一个电极插入到细胞膜内,所测到的电变化是同一细胞的膜内外的电位差,它不仅可测出膜的动作电位,也可测出膜的静息电位。心电图的记录方法原则上属于细胞外记录法,它只能测出已兴奋部位和尚处于兴奋状态的部位之间的电位差。在静息状态下,或是肌膜各部位都处于兴奋状态下时,膜外各部位之间没有电位差,细胞外记录曲线都将呈等电位线,不能加以区别;②心肌细胞电变化曲线是单个心肌细胞在静息时或兴奋时膜内外电位变化曲线;而心电图反映的是一次心动周期中整个心脏的生物电变化,因此,心电图上每一瞬间的电位数值,都是很多心肌细胞电活动的综合效应在体表的反映;③与细胞内记录法不同,心电图是在身体表面间接记录的心脏电变化,因此,电极放置的位置不同,记录的心电图曲线也不相同。
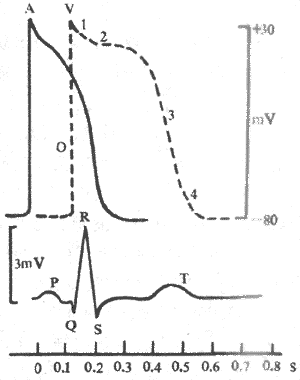
图4-15心肌细胞电变化曲线与常规心电图的比较
A:心房肌细胞电变化 V:心室肌细胞电变化
正常典型心电图的波形及其生理意义 心电图记录纸上有横线和纵线划出长和宽均为1mm的小方格。记录心电图时,首先调节仪器放大倍数,使输入1mV电压信号时,描笔在纵向上产生10mm偏移,这样,纵线上每一小格相当于0.1mV的电位差。横向小格表示时间,每一小格相当于0.04s(即走纸速度为每秒25mm)。因此,可以在记录纸上测量出心电图各波的电位数值和经历的时间。
测量电极安放位置和连线方式(称导联方式)不同所记录到的心电图,在波形上有所不同,但基本上都包括一个P波,一个QRS波群和一个T波,有时在T波后,还出现一个小的U波(图4-16)。
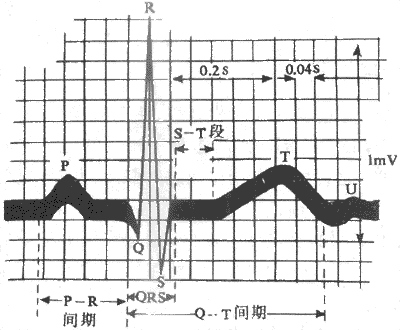
图4-16 正常人心电模式图
1.P波 反映在左右两心房的去极化过程。P波波形小而圆钝,历时0.08-0.11s,波幅不超过0.25mV。
2.Ta波(心房T波)代表心房复极过程所产生的电变化。它开始于P波之后,与P波的方向相反。P-Ta间期(从P波开始到Ta波终了的时程)为0.15-0.45s;故Ta波与P-R段、QRS波和ST段的初期重叠在一起,而且Ta波波幅很低,故通常心电图上看不出Ta波。
3.QRS波群代表左右两心室去极化过程的电位变化。典型的QRS波群,包括三个紧密相连的电位波动:第一个向下波为Q波,以后是高而尖峭的向上的R波,最后是一个向下的S波。但在不同导联中,这三个波不一定都出现。正常QRS波群历时约0.06-0.10s,代表心室肌兴奋扩布所需的时间;各波波幅在不同导联中变化较大。
4.T波 反映心室复极(心室肌细胞3期复极)过程中的电位变化,波幅一般为0.1-0.8mV。在R波较高的导联中T波不应低于R波的1/10。T波历时0.05-0.25s。T波的方向与QRS波群的主波方向相同。
5.U波 是T波后0.02-0.04s可能出现的一个低而宽的波;方向一般与T波一致,波宽约0.1-0.3s,波幅大多在0.05mV以下。U波的意义和成因均不十分清楚。
在心电图中,除了上述各波的形状有特定的意义之外,各波以及它们之间的时程关系也具有理论和实践意义。其中比较重要的有以下几项:
1.PR间期(或PQ间期) 是指从P波起点到QRS波起点之间的时程,为0.12-0.20s。PR间期代表由窦房结产生的兴奋经由心房、房室交界和房室束到达心室,并引起心室开始兴奋所需要的时间,故也称为房室传导时间;在房室传导阻滞时,PR间期延长。
2.PR段 从P波终点到QRS波起点之间的曲线,通常与基线同一水平。PR段形成的原因是由于兴奋冲动通过心房之后在向心室传导过程中,要通过房室交界区;兴奋通过此区传导非常缓慢,形成的电位变化也很微弱,一般记录不出来,故在P波之后,曲线又回到基线水平,成为PR段。
3.QT间期 从QRS波起点到T波终点的时程;代表心室开始兴奋去极到完全复极到静息状态的时间。
4.ST段 指从QRS波群终了到T波起点之间的与基线平齐的线段,它代表心室各部分心肌细胞均处于动作电位的平台期(2期),各部分之间没有电位差存在,曲线又恢复到基线水平。
第三节 血管生理
一、各类血管的功能特点
不论体循环或肺循环,由心室射出的血液都流经由动脉、毛细血管和静脉相互串联构成的血管系统,再返回心房。在体循环,供应各器官的血管相互间又呈并联关系(图4-17)。从生理功能上可将血管分为以下几类:
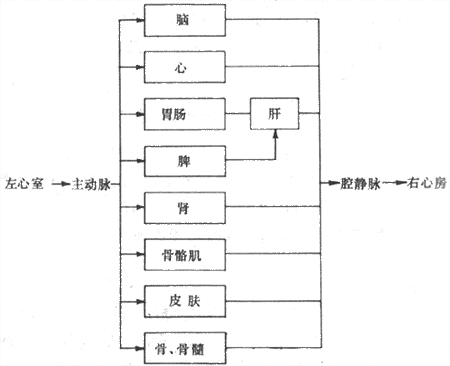
图4-17 体循环各器官血管并联关系示意图
1.左心室射血时,主动脉压升高,一方面推动动脉内的血液向前流动,另一方面使主动脉扩张,容积增大。因此,左心室射出的血液在射血期内只有一部分进入外周,另一部分则被贮存在大动脉内。主动脉瓣关闭后,被扩张的大动脉管壁发生弹性回缩,将在射血期多容纳的那部分血液继续向外周方向推动。大动脉的这种功能称为弹性贮器作用。
2.分配血管 从弹性贮器血管以后到分支为小动脉前的动脉管道,其功能是将血液输送至各器官组织,故称为分配血管。
3.毛细血管前阻力血管 小动脉和微动脉的管径小,对血流的阻力大,称为毛细血管前阻力血管。微动脉的管壁富含平滑肌,后者的舒缩活动可使血管口径发生明显变化,从而改变对血流的阻力和所在器官、组织的血流量。
4.毛细血管前括约肌 在真毛细血管的起始部常有平滑肌环绕,称为毛细血管前括肌(precapillary sphincter)。它的收缩或舒张可控制毛细血管的关闭或开放,因此可决定某一时间内毛细血管开放的数量。
5.交换血管 指真毛细血管。其管壁仅由单层内皮细胞构成,外面有一薄层基膜,故通透性很高,成为血管内血液和血管外组织液进行物质交换的场所。
6.毛细血管后阻力血管 指微静脉。微静脉因管径小,对血流也产生一定的阻力。它们的舒缩可影响毛细血管前阻力和毛细血管后阻力的比值,从而改变毛细血管压和体液在血管内和组织间隙内的分配情况。
7.容量血管 静脉和相应的动脉比较,数量较多,口径较粗,管壁较薄,故其容量较大,而且可扩张性较大,即较小的压力变化就可使容积发生较大的变化。在安静状态下,循环血量的60%-70%容纳在静脉中。静脉的口径发生较小变化时,静脉内容纳的血量就可发生很大的变化,而压力的变化较小。因此,静脉在血管系统中起着血液贮存库的作用,在生理学中将静脉称为容量血管。
8.短路血管 指一些血管床中小动脉和静脉之间的直接联系。它们可使小动脉内的血液不经过毛细血管而直接流入小静脉。在手指、足趾、耳廓等处的皮肤中有许多短路血管存在,它们在功能上与体温调节有关。
二、血流量、血流阻力和血压
血液在心血管系统中流动的一系列物理学问题属于血流动力学的范畴。血流动力学和一般的流体力学一样,其基本的研究对象是流量、阻力和压力之间的关系。由于血管是有弹性和可扩张的而不是硬质的管道系统,血液是含有血细胞和胶体物质等多种成分的液体,而不是理想液体,因此血流动力学除与一般流体力学有共同点之外,又有它自身的特点。
(一)血流量和血流速度
单位时间内流过血管某一截面的血量称为血流量,也称容积速度,其单位通常以ml/min或L/min来表示。血液中的一个质点在血管内移动的线速度,称为血流速度。血液在血管流动时,其血流速度与血流量成正比,与血管的截面成反比。
1.泊肃叶(Poiseuilli)定律泊肃叶研究了液体在管道系统内流动的规律,指出单位时间内液体的流量(Q)与管道两端的压力差P1-P2以及管道半径r的4次方成正比,与管道的长度L成反比。这些关系可用下式表示:
Q=K(r4/L)(P1-P2)
这一等式中的K为常数。后来的研究证明它与液体的粘滞度η有关。因此泊肃叶定律又可写为
Q=π(P1-P2)r4/8ηL
2.层流和湍流血液在血管内流动的方式可分为层流和湍流两类。在层流的情况下,液体每个质点的流动方向都一致,与血管的长轴平行;但各质点的流速不相同,在血管轴心处流速最快,越靠近管壁,流速越慢。因此可以设想血管内的血液由无数层同轴的圆柱面构成,在同一层的液体质点流速相同,由轴心向管壁,各层液体的流速依次递减,如图4-18所示。图中的箭头指示血流的方向,箭的长度表示流速,在血管的纵剖面上各箭头的连线形成一抛物线。泊肃叶定律适用于层流的情况。当血液的流速加快到一定程度后,会发生湍流。此时血液中各个质点的流动方向不再一致,出现旋涡。在湍流的情况下,泊肃叶定律不再适用,血流量不是与血管两端的压力差成正比,而是与压力差的平方根成正比。关于湍流的形成条件,Reynolds提出一个经验公式:
Re=VDσ/η
式中的V为血液在血管内的平均流速(单位为cm/s),D为管腔直径(单位为cm),σ为血液密度(单位为g/cm3),η为血液沾滞度(单位为泊),Re为Reynolds数,没有单位。一般当Re数超过2000时,就可发生湍流。由上式可知,在血流速度快,血管口径大,血液粘滞度低的情况下,容易产生湍流。
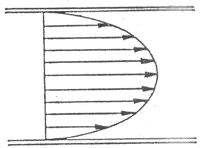
图4-18 层流情况下各层血液的流速
(二)血流阻力
血液在血管内流动时所遇到的阻力,称为血流阻力。血流阻力的产生,是由于血液流动时因磨擦而消耗能量,一般是表现为热能。这部分热能不可能再转换成血液的势能或动能,故血液在血管内流动时压力逐渐降低。在湍流的情况下,血液中各个质点不断变换流动的方向,故消耗的能量较层流时更多,血流阻力就较大。
血流阻力一般不能直接测量,而需通过计算得出。血液在血管中的流动与电荷在导体中流动有相似之处。根据欧姆定律,电流强度与导体两端的电位差成正比,与导体的电阻成反比。这一关系也适用于血流,即血流量与血管两端的压力差成正比,与血流阻力R成反比,可用下式表示:
Q=(P1-P2)/R
在一个血管系统中,若测得血管两端的压力差和血流量,就可根据上式计算出血流阻力。如果比较上式和泊肃叶定律的方程式,则可写出计算血流阻力的方程式,即
R=8ηL/πr4
这一算式表示,血流阻力与血管的长度和血液的粘滞度成正比,与血管半径的4次方成反比。由于血管的长度变化很小,因此血流阻力主要由血管口径和血液粘滞度决定。对于一个器官来说,如果血液粘滞度不变,则器官的血流量主要取决于该器官的阻力血管的口径。阻力血管口径增大时,血流阻力降低,血流量就增多;反之,当阻力血管口径缩小时,器官血流量就减少。机体对循环功能的调节中,就是通过控制各器官阻力血管和口径来调节各器官之间的血流分配的。
血液粘滞度是决定血流阻力的另一因素。全血的粘滞度为水的粘滞度的4-5倍。血液粘滞度的高低取决于以下几个因素:
1.红细胞比容一般说来,红细胞比容是决定血液粘滞度的最重要的因素。红细胞比容愈大,血液粘滞度就愈高。
2.血流的切率 在层流的情况下,相邻两层血液流速的差和液层厚度的比值,称为血流切率(shear rate)。从图4-18可见,切率也就是图中抛物线的斜率。匀质液体的粘滞度不随切率的变化而改变,称为牛顿液。血浆属于牛顿液。非匀质液体的粘滞度随着切率的减小而增大,称为非牛顿液。全血属非牛顿液。当血液在血管内以层流的方式流动时,红细胞有向中轴部分移动的趋势。这种现象称为轴流(axial flow)。当切率较高时,轴流现象更为明显,红细胞集中在中轴,其长轴与血管纵轴平行,红细胞移动时发生的旋转以及红细胞相互间的撞击都很小,故血液的粘滞度较低。在切率低时,红细胞可发生聚集,使血液粘滞度增高。
3.血管口径 血液在较粗的血管内流动时,血管口径对血液粘滞度不发生影响。但当血液在直径小于0.2-0.3mm的微动脉内流动时,只要切率足够高,则随着血管口径的进一步变小,血液粘滞度也变低。这一现象产生原因尚不完全清楚,但对机体有明显的益处。如果没有此种反应,血液在小血管中流动的阻力将会大大增高。
4.温度 血液的粘滞度随温度的降低而升高。人体的体表温度比深部温度低,故血液流经体表部分时粘滞度会升高。如果将手指浸在冰水中,局部血液的沾滞度可增加2倍。
(三)血压
血压是指血管内的血液对于单位面积血管壁的侧压力,也即压强。按照国际标准计量单位规定,压强的单位为帕(Pa),即牛顿/米2(N/m2)。帕的单位较小,血压数值通常用千帕(kPa)来表示(1mmHg等于0.133kPa)。
血压的形成,首先是由于心血管系统内有血液充盈。循环系统中血液充盈的程度可用循环系统平均充盈压来表示。在动物实验中,用电刺激造成心室颤动使心脏暂时停止射血,血流也就暂停,因此循环系统中各处的压力很快就取得平衡。此时在循环系统中各处所测得的压力都是相同的,这一压力数值即循环系统平均充盈压。这一数值的高低取决于血量和循环系统容量之间的相对关系。如果血量增多,或血管容量缩小,则循环系统平均充盈压就增高;反之,如果血量减少或血管容量增大,则循环系统平均充盈压就降低。用巴比妥麻醉的狗,循环系统平均充盈压约为0.93kPa(7mmHg)。人的循环系统平均充盈压估计接近这一数值。
形成血压的另一个基本因素是心脏射血。心室肌收缩时所释放的能量可分为两部分,一部分用于推动血液流动,是血液的功能;另一部分形成对血管壁的侧压,并使血管壁扩张,这部分是势能,即压强能。在心舒期,大动脉发生弹性回缩,又将一部分势能转变为推动血液的动能,使血液在血管中继续向前流动。由于心脏射血是间断性的,因此在心动周期中动脉血压发生周期性的变化。另外,由于血液从大动脉流向心房的过程中不断消耗能量,故血压逐渐降低。在机体处于安静状态时,体循环中毛细血管前阻力血管部分血压降落的幅度最大。
生物学实验中测量血压的经典方法,是将导管的一端插入动脉、静脉或心腔,将导管的另一端连至一装有水银的U形管,从U形管两边水银面高度的差即读得测定部位的血压值。水银检压计测得的压力读数为平均压。现在已有多种类型的压力换能器,可将压强能的变化转变为电能的变化,并精确地测出心动周期中各瞬间的血压数值。在临床上,常用听诊器间接测定肱动脉的收缩压和舒张压。在有些情况下,也可用导管插入血管直接测量血压。在用导管直接测量血压时,如果导管的开口正对血流,则血流的动能也转变成压强能,因此测得的血压值大于血液对血管壁的侧压。称为端压。当人体处于安静状态时,体循环中血流的动能部分在总的能量中只占很小比例,在心缩期主动脉压达最大值时,血流的动能也仅占总能量的3%。在肌肉运动时,血流速度大大加快,动能部分所占的比例增高。在肺循环中,由于肺动脉压较低,而血流速度和体循环中相近,因此血流的动能部分所占的比例较大。
三、动脉血压和动脉脉搏
(一)动脉血压
1.动脉血压的形成 前已述,循环系统同足够的血液充盈和心脏射血是形成血压的基本因素。在动脉系统,影响动脉血压的另一个因素是外周阻力。外周阻力(peripheral resistance)主要是指小动脉和微动脉对血流的阻力。假如不存在外周阻力,心室射出的血液将全部流至外周,即心室收缩释放的能量可全部表现为血流的动能,因而对血管壁的侧压不会增加。
左心室的射血是间断性的。在每个心动周期中,左心室内压随着心室的收缩和舒张发生较大幅度的变化。一般情况下,左心室每次收缩时向主动脉内射出60-80ml血液。由于小动脉和微动脉对血流有较高的阻力,以及主动脉和大动脉管壁具有较大的可扩张性,因此左心室一次收缩所射出的血液,在心缩期内大约只有三分之一流至外周,其余约三分之二被暂时贮存在主动脉和大动脉内,使主动脉和大动脉进一步扩张。主动脉压也就随之升高。这样,心室收缩时释放的能量中有一部分以势能的形式贮存在弹性贮器血管的管壁中。心室舒张时,半月瓣关闭,射血停止,被扩张的弹性贮器血管管壁发生弹性回缩,将在心缩期贮存的那部分血液继续推向外周,并使主动脉压在心舒期仍能维持在较高的水平,例如10.64kPa(80mmHg)左右,而不像心舒期的左心室内压接近0kPa。可见,由于弹性贮器血管的作用,使左心室的间断射血变为动脉内的连续血流;另一方面,还使每个心动周期中动脉血压的变动幅度远小于左心室内压的变动幅度。老年人的大动脉管壁硬化,主动脉的直径和容积增大,而可扩张性减小,弹性贮器的功能受损,因此每个心动周期中动脉血压的波动幅度明显增大。
2.动脉血压的正常值 心室收缩时,主动脉压急剧升高,在收缩期的中期达到最高值。这时的动脉血压值称为收缩压。心室舒张时,主动脉压下降,在心舒末期动脉血压的最低值称为舒张压。收缩压和舒张压的差值称为脉搏压。简称脉压。一个心动周期中每一个瞬间动脉血压的平均值,称为平均动脉压。简略计算,平均动脉压大约等于舒张压加1/3脉压。
一般所说的动脉血压是指主动脉压。因为在大动脉中血压降落很小,故通常将在上臂测得的肱动脉压代表主动脉压。我国健康青年人在安静状态时的收缩压为13.3-16.0kPa(100-120mmHg),舒张压为8.0-10.6kPa(60-80mmHg),脉搏压为4.0-5.3kPa(30-40mmHg),平均动脉压在13.3kPa(100mmHg)左右。
动脉血压 除存在个体差异外,还有性别和年龄的差异。一般说来,女性在更年期前动脉血压比同龄男性的低,更年期后动脉血压升高。男性和女性的动脉血压都随年龄的增长而逐渐升高,收缩压的升高比舒张压的升高更为显著。新生儿的收缩压仅为5.3kPa(40mmHg)左右。出生后第一个月内,收缩压很快升高,到第一月末约可达到10.6kPa(80mmHg)。以后,收缩压继续升高,到12岁时约为14.0kPa(105mmHg)。在青春期,收缩压又较快地上升,17岁的男性青年,收缩压可达16.0kPa(120mmHg)。青春期以后,收缩压随年龄增长而缓慢升高。至60岁时,收缩压约18.6kPa(140mmHg)。
当血液从主动脉流向外周时,因不断克服血管对血流的阻力而消耗能量,血压也就逐渐降低。在各段血管中,血压降落的幅度与该段血管对血流的阻力的大小成正比。在主动脉和大动脉段,血压降落较小。如果主动脉的平均压为13.3kPa(100mmHg)。则到直径为3mm的动脉处,平均压仍在12.6kPa(95mmHg)左右。到小动脉时,血流阻力大,血压降落的幅度也变大。在体循环中,微动脉段的血流阻力最大,血压降落也最为显著。如果微动脉起始端的血压为11.3kPa(85mmHg),则血液流经微动脉后压力降落 7.3kPa(55mmHg),故在毛细血管起始端,血压仅4.0kPa(30mmHg)。在不同的动脉段记录血压时,可以看到从主动脉到外周动脉,血压的波动幅度变大。和主动脉内的血压波动相比,外周动脉的收缩压较高,舒张压较低,故脉搏压较大,而平均压低于动脉压(图4-19)。产生这种现象的原因,主要是由于血压压力波的折返。当动脉的压力波动在传播至较小的动脉分支处,特别是到微动脉时,因受到阻碍而发生折返。折返的压力波逆流而上,如果遇到下行的波动,两者可发生叠加,形成一个较大的波。在股动脉记录血压时,常可看到在一个大的波后面有一个较小的返折波(图4-19),故股动脉的血压波动幅度大于主动脉的血压波动幅度。
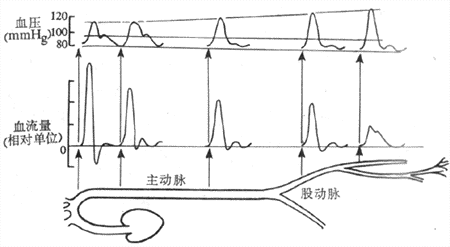
图4-19 主动脉和外周动脉的脉搏压、平均压和血流变化(1mmHg=0.133kPa)
3.影响动脉血压的因素,凡是能影响心输出量和外周阻力的各种因素,都能影响动脉血压。循环血量和血管系统容量之间的相互关系,即循环系统内血液充盈的程度,也能影响动脉血压。现将影响动脉血压因素分述如下:
(1)心脏每搏输出量:如果每搏输出量增大,心缩期射入主动脉的血量增多,心缩期中主动脉和大动脉内增加的血量变多,管壁所受的张力也更大,故收缩期动脉血压的升高更加明显。由于动脉血压升高,血流速度外周阻力和心率的变化不大,则大动脉内增多的血量仍可在心舒期流至外周,到舒张期末,大动脉内存留的血量和每搏输出量增加之前相比,增加并不多。因此,当每搏输出量增加而外周阻力和心率变化不大时,动脉血压的升高主要表现为收缩压的升高,舒张压可能升高不多,故脉压增大。反之,当每搏输出量减少时,则主要使收缩压降低,脉压减小。可见,在一般情况下,收缩压的高低主要反映心脏每搏输出量的多少。
(2)心率:如果心率加快,而每搏输出量和外周阻力都不变,由由于心舒期缩短,在心舒期内流至外周的血液就减少,故心舒期末主动脉内存留的血量增多,舒张期血压就升高。由于动脉血压升高可使血流速度加快,因此在心缩期内可有较多的血液流至外周,收缩压的升高不如舒张压的升高显著,脉压比心率增加前减小。相反,心率减慢时,舒张压降低的幅度比收缩压降低的幅度大,故脉压增大。
(3)外周阻力:如果心输出量不变而外周阻力加大,则心舒期中血液向外周流动的速度减慢,心舒期末存留在主动脉中的血量增多,故舒张压升高。在心缩期,由于动脉血压升高使血流速度加快,因此收缩压的升高不如舒张压的升高明显,故脉压加大。可见,在一般情况下,舒张压的高低主要反映外周阻力的大小。
外周阻力的改变,主要是由于骨骼肌和腹腔器官阻力血管口径的改变。原发性高血压的发病,主要是由于阻力血管口径变小而造成外周阻力过高。另外,血液粘滞度也影响外周阻力。如果血液粘滞度增高,外周阻力就增大,舒张压就升高。
(4)主动脉和大动脉的弹性贮器作用:如前所述,由于主动脉和大动脉的弹性贮器作用,动脉血压的波动幅度明显小于心室内压的波动幅度。老年人的动脉管壁硬化,大动脉的弹性贮器作用减弱,故脉压增大。
(5)循环血量和血管系统容量的比例:循环血量和血管系统容量相适应,才能使血管系统足够地充盈,产生一定的体循环平均充盈压。在正常情况下,循环血量和血管容量是相适应的,血管系统充盈程度的变化不大。失血后,循环血量减少。此时如果血管系统的容量改变不大,则体循环平均充盈压必然降低,使动脉血压降低。在另一些情况下,如果循环血量不变而血管系统容量增大时,也会造成动脉血压下降。
上述对影响动脉血压的各种因素,都是在假设其它因素不变的前提下,分析某一因素发生变化时对动脉血压可能发生的影响。实际上,在各种不同的生理情况下,上述各种影响动脉血压的因素可同时发生改变。因此,在某种生理情况下动脉血压的变化,往往是各种因素相互作用的综合结果。
(二)动脉脉搏
在每个心动周期中,动脉内的压力发生周期性的波动。这种周期性的压力变化可引起动脉血管发生搏动,称为动脉脉搏。在手术时暴露动脉,可以直接看到动脉随每次心搏而发生的搏动。用手指也可摸到身体浅表部位的动脉搏动。
1.动脉脉搏的波形 用脉搏描记仪可以记录浅表动脉搏的波形。这种记录图形称为脉搏图(图4-20)。动脉脉搏的波形可因描记方法和部位的不同而有差别,但一般都包括以下几个组成部分:
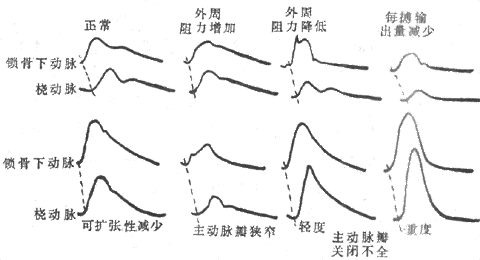
图4-20不同情况下锁骨下动脉与桡动脉的脉搏图
(1)上升支:在心室快速射血期,动脉血压迅速上升,管壁被扩张,形成脉搏波形中的上升支。上升支的斜率和幅度受射血速度、心输出量以及射血所遇的阻力的影响,射血遇到的阻力大,心输出量小,射血速度慢,则脉搏波形中上升支的斜率小,幅度也低;反之,射血所遇的阻力小,心输出量大,射血速度快,则上升支较陡,幅度也较大。大动脉的可扩张性减小时,弹性贮器作用减弱,动脉血压的波动幅度增大,脉搏波上升支的斜率和幅度也加大。主动脉瓣狭窄时,射血阻力高,脉搏波上升支的斜率和幅度都较小。
(2)下降支:心室射血的后期,射血速度减慢,进入主动脉的血量少于由主动脉流向外周的血量,故被扩张的大动脉开始回缩,动脉血压逐渐降低,形成脉搏波形中下降支的前段。随后,心室舒张,动脉血压继续下降,形成下降支的其余部分。在主动脉记录脉搏图时,其下降支上有一个切迹,称为降中峡。降中峡发生在主动脉瓣关闭的瞬间。因为心室舒张时室内压下降,主动脉内的血液向心室方向返流。这一返流使主动脉瓣很快关闭。返流的血液使主动脉根部的容积增大,并且受到闭合的主动脉瓣阻挡,发生一个返折波,因此在降中峡的后面形成一个短暂的向上的小波,称为降中波。动脉脉搏波形中下降支的形状可大致反映外周阻力的高低。外周阻力高时,脉搏波降支的下降速率较慢,切迹的位置较高。如果外周阻力较低,则下降支的下降速率较快,切迹位置较低,切迹以后下降支的坡度小,较为平坦。主动脉瓣关闭不全时,心舒期有部分血液倒流入心室。故下降支很陡,降中波不明显或者消失。
2.动脉脉搏波的传播速度 动脉脉搏可以沿着动脉管壁向外周血管传播,其传播的速度远较血流的速度为快。一般说来,动脉管壁的可扩张性愈大,脉搏波的传播速度就愈慢。由于主动脉的可扩张性最大,故脉搏波在主动脉的传播速度最慢,约3-5m/s,在大动脉的传播速度约为7-10m/s,到小动脉段可加快到15-35m/s。老年人主动脉管壁的可扩张性减小,脉搏波的传播速度可增加到大约10m/s。
由于小动脉和微动脉对血流的阻力很大,故在微动脉段以后脉搏波动即大大减弱。到毛细血管,脉搏已基本消失。
很早以来,医生在进行诊断时要按摸病人的脉搏,最通常的是按病人桡动脉的脉搏。按脉可以了解病人的脉搏频率和节律是否规则等情况,同时也在心理上构成了医生和病人之间的接触和联系。中医把切脉作为诊断疾病的重要手段之一。由于动脉脉搏与心输出量、动脉的可扩张性以及外周阻力等因素有密切的关系。因此,在某些情况下脉搏可以反映心血管系统的异常状况。中医学中的脉象,就是研究各种生理和病理情况下桡动脉脉搏的特征。在中医诊断学中,对脉象有很详细的描述。
四、静脉血压和静脉回心血量
静脉在功能上不仅仅是作为血液回流入心脏的通道,由于整个静脉系统的容量很大,而且静脉容易被扩张,又能够收缩,因此静脉起着血液贮存库的作用。静脉的收缩或舒张可有效地调节回心血量和心输出量,使循环机能能够适应机体在各种生理状态时的需要。
(一)静脉血压
当体循环血液经过动脉和毛细血管到达微静脉时,血压下降至约2.0-2.7kPa(15-20mmHg)。右心房作为体循环的终点,血压最低,接近于零。通常将右心房和胸腔内大静脉的血压称为中心静脉压,而各器官静脉的血压称为外周静脉压。中心静脉压的高低取决于心脏射血能力和静脉回心血量之间的相互关系。如果心脏射血能力较强,能及时地将回流入心脏的血液射入动脉,中心静脉压就较低。反之,心脏射血能力减弱时,中心静脉压就升高。另一方面,如果静脉回流速度加快,中心静脉压也会升高。因此,在血量增加,全身静脉收缩,或因微动脉舒张而使外周静脉压升高等情况下,中心静脉压都可能升高。可见,中心静脉压是反映心血管功能的又一指标。临床上在用输液治疗休克时,除须观察动脉血压变化外,也要观察中心静脉压的变化。中心静脉压的正常变动范围为0.4-1.2kPa(4-12mmH2O)。如果中心静脉压偏低或有下降趋势,常提示输液量不足;如果中心静脉压高于正常并有进行性升高的趋势,则提示输液过快或心脏射血功能不全。当心脏射血功能减弱而使中心静脉压升高时,静脉回流将会减慢,较多的血液滞留在外周静脉内,故外周静脉压升高。
静脉脉搏动脉脉搏波在到达毛细血管时已经消失,因此外周静脉没有脉搏波动。但是右心房在心动周期中的血压波动可以逆向传递到与心房相连续的大静脉,引起这些大静脉的周期性压力和容积变化,形成静脉脉搏。由于引起搏动的原因不同,故大静脉的脉搏波形和动脉脉搏的波形完全不同。正常情况下,静脉脉搏不很明显。但在心力衰竭时,静脉压升高,右心房内的压力波动也较容易传递至大静脉,故在心力衰竭病人的颈部常可见到较明显的静脉搏动。
(二)重力对静脉压的影响
血管系统内的血液因受地球重力场的影响,产生一定的静水压。因此,各部分血管的血压除由于心脏作功形成以外,还要加上该部分血管处的静水压。各部分血管的静水压的高低取决于人体所取的体位。在平卧时,身体各部分血管的位置大致都处在和心脏相同的水平,故静水压也大致相同。但当人体从平卧转为直立时,足部血管内的血压比卧位时高。其增高的部分相当于从足至心脏这样的一段血柱高度形成的静水压,约12kPa(90mmHg),见图4-21。而在心脏水平以上的部分,血管内的压力较平卧时为低,例如颅顶脑膜矢状窦内压可降至-1.33kPa(-10mmHg)。重力形成的静水压的高低,对于处在同一水平上的动脉和静脉是相同的,但是它对静脉功能的影响远比对动脉功能的影响大。因为静脉较动脉有一明显的特点,即其充盈程度受跨壁压的影响较大。跨壁压是指血管内血液对管壁的压力和血管外组织对管壁的压力之差。一定的跨壁压是保持血管充盈膨胀的必要条件。跨壁压减小到一定程度,血管就不能保持膨胀状态,即发生塌陷。静脉管壁较薄,管壁中弹性纤维和平滑肌都较少,因此当跨壁压降低时就容易发生塌陷。此时静脉的容积也减小。当跨壁压增大时,静脉就充盈,容积增大。当人在直立时,足部的静脉充盈饱满,而颈部的静脉则塌陷。静脉的这一特性在人类特别值得注意。因为当人在直立时,身体中大多数容量血管都处于心脏水平以下,如果站立不动,由于身体低垂部分的静脉充盈扩张,可比在卧位时多容纳400-600ml血液,这部分血液主要来自胸腔内的血管。这样就造成体内各部分器官之间血量的重新分配,并导致暂时的回心血量减少,中心静脉压降低,每搏输出量减少和收缩压降低。后文将述及,这些变化会发动神经和体液的调节机制,使骨骼肌、皮肤和肾、腹腔内脏的阻力血管收缩以及心率加快,故动脉血压可以恢复。许多动物由于四足站地,多数容量血管都处于心脏水平以上,故体位改变时血量分配的变化不像在人类中那样明显。

图4-21 直立体位对肢体动脉和静脉血压的影响(1mmHg=0.13kPa)
(三)静脉血流
1.静脉对血流的阻力 单位时间内由静脉回流入心脏的血量等于心输出量。在静脉系统中,由微静脉至右心房的压力降落仅约2kPa(15mmHg)。可见静脉对血流的阻力很小,约占整个体循环总阻力的15%。静脉在血液循环中是将血液从组织引流回心脏的通道,并且起血液贮存库的作用。小的血流阻力与静脉的功能是相适应的。
微静脉在功能上是毛细血管后阻力血管。毛细血管后阻力的改变可影响毛细血管血压。因为后者的高低取决于毛细血管前阻力和毛细血管后阻力的比值。微静脉收缩,使毛细血管后阻力升高,如果毛细血管前阻力不变,则毛细血管前阻力和毛细血管后阻力的比值变小,于是毛细血管血压升高,组织液的生成增多(见后)。因此,机体可通过对微静脉收缩状态的调节来控制血液和组织液之间的液体交换,并间接地调节循环血量。
前面提到,静脉的跨壁压改变时可改变静脉的扩张状态,从而也改变静脉对血流的阻力。大静脉在处于扩张状态时,对血流的阻力很小;但当管壁塌陷时,因其管腔截面由圆形变成椭圆形,截面积减小,因此对血流的阻力增大。另外,血管周围组织对静脉的压迫也可增加静脉对血流的阻力。例如锁骨下静脉在跨越第一肋骨处受肋骨的压迫;颈部皮下的颈外静脉直接受外界大气的压迫;腹腔内的大静脉受腹腔器官的压迫,等等。位于胸腔内的大静脉则因受胸膜腔内负压的作用,跨壁压较大,一般不会塌陷。颅腔、脊柱、骨和肝、脾等器官内的静脉,因受到血管周围结缔组织的支持,也不会塌陷。
2.静脉回心血量及其影响因素单位时间内的静脉回心血量取决于外周静脉压和中心静脉压的差,以及静脉对血流的阻力。故凡能影响外周静脉压、中心静脉压以及静脉阻力的因素,都能影响静脉回心血量。
(1)体循环平均充盈压:体循环平均充盈压是反映血管系统充盈程度的指标。实验证明,血管系统内血液充盈程度愈高,静脉回心血量也就愈多。当血量增加或容量血管收缩时,体循环平均充盈压升高,静脉回心血量也就增多。反之,血量减少或容量血管舒张时,体循环平均充盈压降低,静脉回心血量减少。
(2)心脏收缩力量:心脏收缩时将血液射入动脉,舒张时则可以从静脉抽吸血液。如果心脏收缩力量强,射血时心室排空较完全,在心舒期心室内压就较低,对心房和大静脉内血液的抽吸力量也就较大。右心衰竭时,射血力量显著减弱,心舒期右心室内压较高,血液淤积在右心房和大静脉内,回心血量大大减少。患者可出现颈外静脉怒张,肝充血肿大,下肢浮肿等特征。左心衰竭时,左心房压和肺静脉压升高,造成肺淤血和肺水肿。
(3)体位改变:前已述,当人体从卧位转变为立位时,身体低垂部分静脉扩张,容量增大,故回心血量减少。站立时下肢静脉容纳血量增加的程度可受到若干因素的限制,例如下肢静脉内的静脉瓣,以及下面将叙述的下肢肌肉收缩运动和呼吸运动等。下肢静脉瓣膜受损的人,常不能长久站立。即使在正常人,如长久站立不动,也会导致回心血量减少,动脉血压降低。体位改变对静脉回心血量的影响,在高温环境中更加明显。在高温环境中,皮肤血管舒张,皮肤血管中容纳的血量增多。因此,如果人在高温环境中长时间站立不动,回心血量就会明显减少,导致心输出量减少和脑供血不足,可引起头晕甚至昏厥。长期卧床的病人,静脉管壁的紧张性较低,可扩张性较高,加之腹腔和下肢肌肉的收缩力量减弱,对静脉的挤压作用减小,故由平卧位突然站起来时,可因大量血液积滞在下肢,回心血量过小而发生昏厥。
(4)骨骼肌的挤压作用:人体在站立位的情况下,如果下肢进行肌肉运动,回心血量和在没有肌肉运动时就不一样。一方面,肌肉收缩时可对肌肉内和肌肉间的静脉发生挤压,使静脉血流加快;另一方面,因静脉内有瓣膜存在,使静脉内的血液只能向心脏方向流动而不能倒流。这样,骨骼肌和静脉瓣膜一起,对静脉回流起着“泵”的作用,作为“静脉泵”或“肌肉泵”。下肢肌肉进行节律性舒缩活动时,例如步行,肌肉泵的作用就能很好地发挥。因为当肌肉收缩时,可将静脉内的血液挤向心脏,当肌肉舒张时,静脉内压力降低,有利于微静脉和毛细血管内的血液流入静脉,使静脉充盈。肌肉泵的这种作用,对于在立位情况下降低下肢静脉压和减少血液在下肢静脉内潴留有十分重要的生理意义。例如,在站立不动时,足部的静脉压为12kPa(90mmHg),而在步行时则降低至3.3kPa(25mmHg)以下。在跑步时,两下肢肌肉泵每分钟挤出的血液可达数升。在这种情况下,下肢肌肉泵的作功在相当程度上加速了全身的血液循环,对心脏的泵血起辅助的作用。但是,如果肌肉不是作节律性的舒缩,而是维持在紧张性收缩状态,则静脉持续受压,静脉回流反而减少。
(5)呼吸运动:呼吸运动也能影响静脉回流。在第五章会详述,胸膜腔内压是低于大气压的,称为胸膜腔负压。由于胸膜腔内压为负压,胸腔内大静脉的跨壁压较大,故经常处于充盈扩张状态。在吸气时,胸腔容积加大,胸膜腔负压值进一步增大,使胸腔内的大静脉和右心房更加扩张,压力也进一步降低,因此有利于外周静脉内的血液回流入右心房。由于回心血量增加,心输出量也相应增加。呼气时,胸膜腔负压值减小,由静脉回流入右心房的血量也相应减少。可见,呼吸运动对静脉回流也起着“泵”的作用。有些人在站立时呼吸加深,显然可以促进身体低垂部分的静脉血液回流。需要指出,呼吸运动对肺循环静脉回流的影响和对体循环的影响不同。吸气时,随着肺的扩张,肺部的血管容积显著增大,能贮留较多的血液,故由肺静脉回流至左心房的血量减少,左心室的输出量也相应减少。呼气时的情况则相反。
五、微循环
微循环是指微动脉和微静脉之间的血液循环。血液循环最根本的功能是进行血液和组织之间的物质交换,这一功能就是在微循环部分实现的。
(一)微循环的组成
各器官、组织的结构和功能不同,微循环的结构也不同。人手指甲皱皮肤的微循环形态比较简单,微动脉和微静脉之间仅由呈袢状的毛细血管相连。骨骼肌和肠系膜的微循环形态则比较复杂。典型的微循环由微动脉、后微动脉、毛细血管前括约肌、真毛细血管、通血毛细血管(或称直捷通路)、动-静脉吻合支和微静脉等部分组成。图4-22是一个典型的微循环单元。
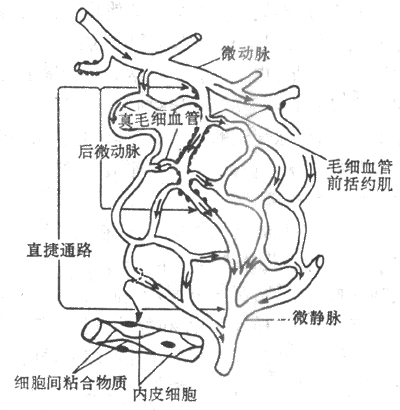
图4-22 肠系膜微循环模式图
微动脉管壁有环行的平滑肌,其收缩和舒张可控制微血管的血流量。微动脉分支成为管径更细的后微动脉。每根后微动脉向一根至数根真毛细血管供血。真毛细血管通常从后微动脉以直角方向分出。在真毛细血管起始后端通常有1-2个平滑肌细胞,形成一个环,即毛细血管前括约肌。该括约肌的收缩状态决定进入真毛细血管的血流量。
毛细血管的血液经微静脉进入静脉。最细的微静脉管径不超过20-30μm,管壁没有平滑肌,在功能上有交换血管的作用。较大的微静脉管壁有平滑肌,在功能上是毛细血管后阻力血管。微静脉的舒缩状态可影响毛细血管血压,从而影响毛细血管处的液体交换和静脉回心血量。
另外,微动脉和微静脉之间还可通过直捷通路和动-静脉短路发生沟通。直捷通路(thoroughfare channel)是指血液从微动脉经后微动脉和通血毛细血管进入微静脉的通路。通血毛细血管是后微动脉的直接延伸,其管壁平滑肌逐渐稀小以至消失。直捷通路经常处于开放状态,血流速度较快,其主要功能并不是物质交换,而是使一部分血液能迅速通过微循环而进入静脉。直捷通路在骨骼肌组织的微循环中较为多见。动-静脉短路(arteriovenous shunt)是吻合微动脉和微静脉的通道,其管壁结构类似微动脉。在人体某些部分的皮肤和皮下组织,特别是手指、足趾、耳廓等处,这类通路较多。动-静脉吻合支在功能上不是进行物质交换,而是在体温调节中发挥作用的。当环境温度升高时,动-静脉吻合支开放增多,皮肤血流量增加,皮肤温度升高,有利于发散身体热量。环境温度低时,则动-静脉短路关闭,皮肤血流量减少,有利于保存体热。动-静脉短路开放,会相对地减少组织对血液中氧的摄取。在某些病理状态下,例如感染性和中毒性休克时,动-静脉短路大量开放,可加重组织的缺氧状况。
(二)毛细血管的结构和通透性
毛细血管壁由单层内皮细胞构成,外面有基膜包围,总的厚度约0.5μm,在细胞核的部分稍厚。内皮细胞之间相互连接处存在着细微的裂隙,成为沟通毛细血管内外的孔道(图4-23)。
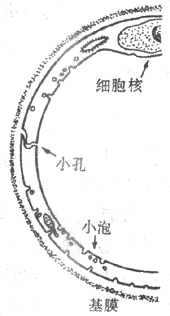
图4-23 毛细血管壁亚显微结构示意图
毛细血管内皮有四种主要类型:
1.连续内皮 分布在皮肤、骨骼肌、平滑肌、心肌、肺等多数器官组织。内皮细胞厚度为0.1-0.2μm,细胞核处稍厚。细胞之间有紧密连接(tight junction),其裂隙大小一般小于血浆蛋白质分子的大小,故水、离子,小于血浆蛋白的溶质分子都可以通过。这种内皮对血浆中各种溶质的通透性很小。脂浴性物质如O2和CO2以及水分子可以直接通过内皮细胞的细胞膜和胞浆。另外,内皮细胞还有吞饮功能,在细胞内可看到吞饮囊泡,囊泡内容是血浆或组织液,包含有蛋白质分子。有时数个囊泡可融合成一个贯通内皮细胞壁的暂时的通道。
2.有孔内皮分布在胃肠粘膜、腺体、肾小球和肾小管周围毛细血管。这类内皮在5%-50%的面积上细胞厚度不到0.05μm,并且有小孔。其余部分的结构与连续内皮相似。在肾小球毛细血管,管壁的小孔是直径为50-60nm的圆孔,小孔是开放的,外面被基膜覆盖。在胃肠粘膜和肾小管周围毛细血管,小孔被一层纤薄的隔膜封闭。有孔内皮对水和小的溶质的通透性高于连续内皮,但对血浆蛋白质的通透性仍很小。
3.非连续内皮 分布在肝、骨髓、脾的血窦。内皮细胞的间隙可宽达1μm,并且基膜也是不连续的。蛋白质和其它大分子可以自由通过这些间隙。
4.紧密连接内皮 分布在中枢神经系统和视网膜。这类内皮细胞较高大,故毛细血管管壁较厚。内皮细胞之间都是紧密连接。内皮细胞内很少见到吞饮囊泡。水和脂溶性分子可直接通过细胞,一些离子和小分子非脂溶性物质(如葡萄糖、氨基酸)则只能由特异的载体转运。
(三)毛细血管的数量和交换面积
有人粗略估计,人体全身约有400亿根毛细血管。不同器官组织中毛细血管的密度有很大差异,例如在心肌、脑、肝、肾,毛细血管的密度为每立方毫米组织2500-3000根;骨骼肌为每立方毫米组织100-400根;骨、脂肪、结缔组织中毛细血管密度较低。假设毛细血管的平均半径为3μm,平均长度为750μm,则每根毛细血管的表面积约为14000μm2。由于微静脉的起始段也有交换功能,故估计每根毛细血管的有效交换面积为22000μm2。由此可以估计全身毛细血管(包括有交换功能的微静脉)总的有效交换面积将近1000m2。
(四)策循环的血流动力学
微循环中的血流一般为层流。血液在流经微循环血管网时血压逐渐降低。在直径为8-40μm的微动脉处,对血流的阻力最大,血压降落也最大。到毛细血管的靠动脉端,血压约4.0-5.3kPa(30-40mmHg),毛细血管中段血压约3.3kPa(25mmHg),至靠静脉端约1.3-2.0kPa(10-15mmHg)。毛细血管血压的高低取决于毛细血管和前阻力和毛细血管后阻力的比值。一般说来,当这一比例为5:1时,毛细血管的平均血压约为2.7kPa(20mmHg)。这一比值增大时,毛细血管血压就降低;比值变小时毛细血管血压升高。某一组织中微循环的血流量与微动脉和微静脉之间的血压差成正比,与微循环中总的血流阻力成反比。由于在总的血流阻力中微动脉处的阻力占较大比例,故微动脉的阻力对血流量的控制起主要作用。
测量一个器官的血流量时,常可见到在一定时间内其血流量是稳定的。但如果在显微镜下观察微循环中单个血细胞的移动速度,则可看到在同一时间内不同微血管中的流速是有很大差别的,而且同一血管在不同时间内流速也有较大变化。其原因是由于后微动脉和毛细血管前括约肌不为发生每分钟约5-10次的交替性收缩和舒张,称为血管舒活动。后微动脉和毛细血管前括约肌收缩,其后的真毛细血管网关闭,舒张时真毛细血管网开放。在安静状态下,骨骼肌组织中在同一时间内只有20%-35%的真毛细血管处于开放状态。血管舒缩活动主要与局部组织的代谢有关。毛细血管关闭时,该毛细血管周围组织中代谢产物积聚,氧分压降低。代谢产物和低氧都能导致局部的后微动脉和毛细血管前括约肌舒张及毛细血管开放,于是局部组织内积聚的代谢产物被血流清除,后微动脉和毛细血管前括约肌又收缩,使毛细血管关闭。如此周而复始。当组织代谢活动加强时,愈来愈多的微动脉和毛细血管前括约肌发生舒张,使愈来愈多的毛细血管处于开放状态,从而使血液和组织、细胞之间发生交换的面积增大,交换的距离缩短。因此,微循环的血流量和组织的代谢活动水平相适应。
(五)血液和组织液之间的物质交换
组织、细胞之间的空间称为组织间隙,其中为组织液所充满。组织液是组织、细胞直接所处的环境。组织、细胞通过细胞膜和组织液发生物质交换。组织液与血液之间则通过毛细血管壁进行物质交换。因此,组织、细胞和血液之间的物质交换需通过组织液作为中介。
血液和组织液之间的物质交换主要是通过以下几种方式进行的:
1.扩散扩散是指液体中溶质分子的热运动,是血液和组织液之间进行物质交换的最主要的方式。毛细血管内外液体中的分子,只要其直径小于毛细血管壁的孔隙,就能通过管壁进行扩散运动。分子运动是可以向各个不同方向进行的杂乱的运动,故当血液流经毛细血管时,血液内的溶质分子可以扩散入组织液,组织液内的溶质分子也可以扩散入血液。对于某一种物质来说,其通过毛细血管壁进行的扩散的驱动力是该物质在管壁两侧的浓度差,即从浓度高的一侧向浓度低的一侧发生净移动。溶质分子在单位时间内通过毛细血管壁进行扩散的速率与该溶质分子在血浆和组织液中的浓度差、毛细血管壁对该溶质分子的通透性、毛细血管壁的有效交换面积等因素成正比,与毛细血管壁的厚度(即扩散距离)成反比。对于非脂溶性物质,毛细血管壁的通透性(紧密连接内皮除外)与溶质分子的大小有关,分子愈小,通透性愈大。毛细血管壁孔隙的总面积虽仅占毛细血管壁总面积的约千分之一,但由于分子运动的速度高于毛细血管血流速度数十倍,故血液在流经毛细血管时,血浆和组织液的溶质分子仍有足够的时间进行扩散交换。脂溶性物质如O2 、CO2等可直接通过内皮细胞进行扩散,因此整个毛细血管壁都成为扩散面,单位时间内扩散的速率更高。
2.滤过和重吸收当毛细血管壁两侧的静水压不等时,水分子就会通过毛细血管壁从压力高的一侧向压力低的一侧移动。水中的溶质分子,如其分子直径小于毛细血管壁的孔隙,也能随同水分子一起滤过。另外,当毛细血管壁两侧的渗透压不等时,可以导致水分子从渗透压低的一侧向渗透压高的一侧移动。由于血浆蛋白质等胶体物质较难通过毛细血管壁的孔隙,因此血浆的胶体渗透压能限制血浆的水分子向毛细血管外移动;同样,组织液的胶体渗透压则限制组织液的水分子向毛细血管内移动。在生理学中,将由于管壁两侧静水压和胶体渗透压的差异引起的液体由毛细血管内向毛细血管外的移动称为滤过,而将液体向相反方向的移动称为重吸收。血液和组织液之间通过滤过和重吸收的方式发生的物质交换,和通过扩散方式发生的物质交换相比,仅占很小的一部分,但在组织液的生成中起重要的作用。
3.吞饮在毛细血管内皮细胞一侧的液体可被内皮细胞膜包围交吞饮入细胞内,形成吞饮囊泡。囊泡被运送至细胞的另一侧,并被排出至细胞外。因此,这也是血液和组织液之间通过毛细血管壁进行物质交换的一种方式。一般认为,较大的分子如血浆蛋白等可以由这种方式通过毛细血管壁进行交换。
六、组织液的生成
正常成人的体重的60%左右是水,其中约5/8存在于细胞内,称为细胞内液;其余3/8存在于细胞外,称为细胞外液。细胞外液中,约有1/5在血管内,即血浆的水分;其余4/5在血管外,即组织液和各种腔室内液体(脑脊液、眼球内液等)的水分。组织液存在于组织、细胞的间隙内,绝大部分呈胶冻状,不能自由流动,因此不会因重力作用而流至身体的低垂部分;将注射针头插入组织间隙内,也不能抽出组织液。组织液凝胶的基质是胶原纤维和透明质酸细丝。组织液中有极小一部分呈液态,可自由流动。组织液中各种离子成分与血浆相同。组织液中也存在各种血浆蛋白质,但其浓度明显低于血浆。
(一)组织液的生成
组织液是血浆滤过毛细血管壁而形成的。如前所述,液体通过毛细血管壁的滤过和重吸收取决于四个因素,即毛细血管血压(Pc)、组织液静水压(Pif),血浆胶体渗透压(πp)和组织液胶体渗透压(πif)。其中,Pc和πif是促使液体由毛细血管内向血管外滤过的力量,而πp和Pif是将液体从血管外重吸收入毛细血管内的力量。滤过的力量(即Pc+πif)和重吸收的力量(即πp+Pif)之差,称为有效滤过压。单位时间内通过毛细血管壁滤过的液体量V等于有效滤过压与滤过系数Kf的乘积,即
V=Kf[(Pc+πif)-(πp+Pif)]
滤过系数的大小取决于毛细血管壁对液体的通透性和滤过面积。以图4-24所设的各种压力数值为例,可见在毛细血管动脉端的有效滤过压为1.3kPa(10mmHg),液体滤出毛细血管;而在毛细血管静脉端的有效滤过压力为负值,故发生重吸收。总的说来,流经毛细血管的血浆,约有0.5%在毛细血管动脉端以滤过的方式进行组织间隙,其中约90%在静脉端被重吸收回血液,其余约10%进行毛细淋巴管,成为淋巴液。
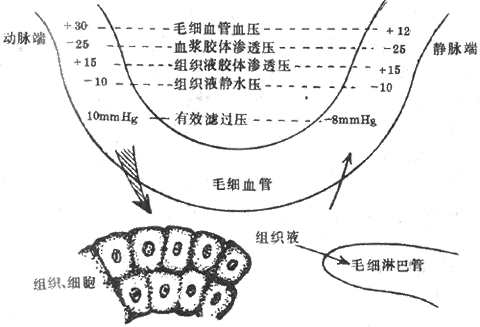
图4-24 组织液生成与回流示意图
+代表使液体滤出毛细血管的力量 -代表使液体吸收回毛细血管的力量
(1mmHg=0.133kPa)
(二)影响组织液生成的因素
在正常情况下,组织液不断生成,又不断被重吸收,保持动态平衡,故血量和组织液量能维持相对稳定。如果这种动态平衡遭到破坏,发生组织液生成过多或重吸收减少,组织间隙中就有过多的潴留,形成组织水肿。上述决定有效滤过压的各种因素,如毛细血管血压升高和血浆胶体渗透压降低时,都会使组织液生成增多,甚至引起水肿。静脉回流受阻时,毛细血管血压升高,组织液生成也会增加。淋巴回流受阻时,组织间隙内组织液积聚,可导致组织水肿。此外,在某些病理情况下,毛细血管壁的通透性增高,一部分血浆蛋白质滤过进行组织液,使组织液生成增多,发生水肿。
七、淋巴液的生成和回流
淋巴管系统是组织液向血液回流的一个重要的辅助系统。毛细淋巴管以稍膨大的盲端起始于组织间隙,彼此吻合成网,并逐渐汇合成大的淋巴管。全身的淋巴液经淋巴管收集,最后由右淋巴导管和胸导管导入静脉。
(一)淋巴液的生成
组织液进入淋巴管,即成为淋巴液。因此,来自某一组织的淋巴液的成分和该组织的组织液非常接近。在毛细淋巴管起始端,内皮细胞的边缘像瓦片般互相覆盖,形成向管腔内开启的单向活瓣。另外,当组织液积聚在组织间隙内时,组织中的胶原纤维和毛细淋巴管之间的胶原细丝可以将互相重叠的内皮细胞边缘拉开,使内皮细胞之间出现较大的缝隙。因此,组织液包括其中的血浆蛋白质分子可以自由地进入毛细淋巴管。
正常成人在安静状态下大约每小时有120ml淋巴液流入血液循环,其中约100ml经由胸导管,20ml经由右淋巴导管进入血液。以此推算,每天生成的淋巴液总量约为2-4L,大致相当于全身血浆总量。组织液和毛细淋巴管内淋巴液的压力差是组织液进入淋巴管的动力。组织液压力升高时,能加快淋巴液的生成速度。
(二)淋巴液的回流及影响淋巴液回流的因素
毛细淋巴管汇合形成集合淋巴管。后者的管壁中有平滑肌,可以收缩。另外,淋巴管中有瓣膜,使淋巴液不能倒流。淋巴管壁平滑肌的收缩活动和瓣膜共同构成“淋巴管泵”,能推动淋巴流动。淋巴管周围组织对淋巴管的压迫也能推动淋巴流动,例如肌肉收缩,相邻动脉的搏动,以及外部物体对身体组织的压迫和按摩等等。凡能增加淋巴生成的因素也都能增加淋巴液的回流量。
淋巴液回流的生理功能,主要是将组织液中的蛋白质分子带回至血液中,并且能清除组织液中不能被毛细血管重吸收的较大的分子以及组织中的红细胞和细菌等。小肠绒毛的毛细淋巴管对营养物质特别是脂肪的吸收起重要的作用。由肠道吸收的脂肪的80%-90%是经过这一途径被输送入血液的。因此小肠的淋巴呈乳糜状。淋巴回流的速度虽较缓慢,但一天中回流的淋巴液相当于全身血浆总量,故淋巴液回流在组织液生成和重吸收的平衡中起着一定的作用。
第四节 心血管活动的调节
人体在不同的生理状况下,各器官组织的代谢水平不同,对血流量的需要也不同。机体的神经和体液机制可对心脏和各部分血管的活动进行调节,从而适应各器官组织在不同情况下对血流量的需要,协调地进行各器官之间的血流分配。
一、神经调节
心肌和血管平滑肌接受自主神经支配。机体对心血管活动的神经调节是通过各种心血管反射实现的。
(一)心脏和血管的神经支配
1.心脏的神经支配支配心脏的传出神经为心交感神经和心迷走神经。
(1)心交感神经及其作用:心交感神经的节前神经元位于脊髓第1-5胸段的中间外侧柱,其轴突末梢释放的递质为乙酰胆碱,后者能激活节后神经元膜上的N型胆碱能受体。心交感节后神经元位于星状神经节或颈交感神经节内。节后神经元的轴突组织心脏神经丛,支配心脏各个部分,包括窦房结、房室交界、房室束、心房肌和心室肌。
在动物实验中看到,两侧心交感神经对心脏的支配有所差别。支配窦房结的交感纤维主要来自右侧心交感神经,支配房室交界的交感主要来自左侧心交感神经。在功能上,右侧心交感神经兴奋时以引起心率加快的效应为主,而左侧心交感神经兴奋则以加强心肌收缩能力的效应为主。
心交感节后神经元末梢释放的递质为去甲肾上腺素,与心肌细胞膜上的β型肾上腺素能受体结合,可导致心率加快,房室交界的传导加快,心房肌和心室肌的收缩能力加强。这些效应分别称为正性变时作用、正性变传导作用和正性变力作用。刺激心交感神经可使心缩期缩短,收缩期室内压上升的速率加大;室内压峰值增高,心舒早期室内压下降的速率加大。这些变化还有利于心室在舒张期的充盈。交感神经末梢释放的去甲肾上腺素和循环血液中的儿茶酚胺都能作用于心肌细胞膜的β肾上腺素能受体,从而激活腺苷酸环化酶,使细胞内cAMP的浓度升高,继而激活蛋白激酶和细胞内蛋白质的磷酸化过程,使心肌膜上的钙通道激活,故在心肌动作电位平台期Ca2+的内流增加,细胞内肌浆网释放的Ca2+也增加,其最终效应是心肌收缩能力增强,每搏作功增加。交感神经兴奋引起的正性变传导作用可使心室各部分肌纤维的收缩更趋同步化,这也有利于心肌收缩力的加强。
心交感神经对心肌的效应,主要是通过β肾上腺素能受体实现的。但心肌也有α肾上腺素能受体。激活心肌的α肾上腺素能受体主要引起正性变力效应,而心率的变化则不显著;另外,室内压上升和下降的速率并无明显加快,故心肌的收缩期延长。心肌α肾上腺素能受体的生理功能还不很清楚,有人认为,当β肾上腺素能受体功能受损时(例如长期使用β肾上腺素能受体拮抗剂),心肌α肾上腺素能受体可继续对交感神经和儿茶酚胺发生反应。在病理情况下,心肌α肾上腺素能受体可能在心肌缺血后再灌注引起的心律失常中起一定的作用。
(2)心迷走神经及其作用:支配心脏的副交感神经节前纤维行走于神经干中。这些节前神经元的细胞体位于延髓的迷走神经背核和疑核,在不同的动物中有种间差异。在胸腔内,心迷走神经纤维和心交感神经一起组成心脏神经丛,并和交感纤维伴行进入心脏,与心内神经节细胞发生突触联系。心迷走神经的节前和节后神经元都是胆碱能神经元。节后神经纤维支配窦房结、心房肌、房室交界、房室速及其分支。心室肌也有迷走神经支配,但纤维末梢的数量远较心房肌中为少。两侧心迷走神经对心脏的支配也有差别,但不如两侧心交感神经支配的差别显著。右侧迷走神经对窦房结的影响占优势;左侧迷走神经对房室交界的作用占优势。
心迷走神经节后纤维末梢释放的乙酰胆碱作用于心肌细胞膜的M型胆碱能受体,可导致心率减慢,心房肌收缩能力减弱,心房肌不应期缩短,房室传导速度减慢,即具有负性变时、变力和变传导作用。刺激迷走神经时也能使心室肌收缩减弱,但其效应不如心房肌明显。迷走神经减弱心肌收缩能力的机制是由于其末梢释放的乙酰胆碱作用于M胆碱能受体后,可使腺苷酸环化酶抑制,因此细胞内cAMP浓度降低,肌浆网释放Ca2+减少(参见本章第二节)。
一般说来,心迷走神经和心交感神经对心脏的作用是相对抗的。但是当两者同时对心脏发生作用时,其总的效应并不等于两者分别作用时发生效应的代数和。在多数情况下,心迷走神经的作用比交感神经的作用占有较大的优势。在动物实验中如同时刺激迷走神经和心交感神经,常出现心率减慢效应。其机制比较复杂。此外,在交感神经末梢上有接头前M型胆碱能受体,在迷走神经末梢上有接头前α肾上腺素能受体。迷走神经末梢释放的乙酰胆碱可作用于交感神经末梢的M型胆碱能受体,使交感神经末梢释放递质减少;交感神经末梢释放的去甲肾上腺素也可作用于迷走神经末梢的α肾上腺素能受体,使迷走神经末梢释放递质减少。这种通过接头前受体影响神经末梢递质释放的过程称为递质释放的接头前(或突触前)调制。
(3)支配心脏的肽能神经元:用免疫细胞化学方法证明,心脏中存在多种神经纤维,如神经肽Y、血管活性肠肽、降钙素基因相关肽、阿片肽等。现已知一些肽类递质可与其它递质,如单胺和乙酰胆碱,共存于同一神经元内,并共同释放。目前对于分布在心脏的肽神经元的生理功能还不完全清楚,但心脏内肽能神经纤维的存在说明这些肽类递质也可能参与对心肌和冠状血管作用,降钙素基因相关肽有加快心率的作用等。
2.血管的神经支配除真毛细血管外,血管壁都有平滑肌分布。不同血管的平滑肌的生理特性有所不同,有些血管平滑肌有自发的肌源性活动,而另一些血管平滑肌很少有肌源性活动。但绝大多数血管平滑肌都受局部组织代谢产物影响。支配血管平滑肌的神经纤维可分为缩血管神经纤维和舒血管神经纤维两大类,两者又统称为血管运动神经纤维。
(1)缩血管神经纤维:缩血管神经纤维都是交感神经纤维,故一般称为并感缩血管纤维,其节前神经元位于脊髓胸、腰段的中间外侧柱内,末梢释放的递质为乙酰胆碱。节后神经元位于椎旁和椎前神经节内,末梢释放的递质为去甲肾上腺素。血管平滑肌细胞有α和β两类肾上腺素能受体。去甲肾上腺素与α肾上腺素能受体结合,可导致血管平滑肌收缩;与β肾上腺素能受体结合,则导致血管平滑肌舒张。去甲肾上腺素与α肾上腺素能受体结合的能力较与β受体结合的能力强,故缩血管纤维兴奋时引起缩血管效应。
体内几乎所有的血管都受交感缩血管纤维支配,但不同部位的血管中缩血管纤维分布的密度不同。皮肤血管中缩血管纤维分布最密,骨骼肌和内脏的血管次之,冠状血管和脑血管中分布较少。在同一器官中,动脉中缩血管纤维的密度高于静脉,微动脉中密度最高,但毛细血管前括约肌中神经纤维分布很少。
人体内多数血管只接受交感缩血管纤维的单一神经支配。在安静状态下,并感缩血管纤维持续发放约1-3次/秒的低频冲动,称为交感缩血管紧张,这种紧张性活动使血管平滑肌保持一定程度的收缩状态。当交感缩血管紧张增强时,血管平滑肌进一步收缩;交感缩血管紧张减弱时,血管平滑肌收缩程度减低,血管舒张。在不同的生理状况下,交感缩血管纤维的放电频率在每秒低于1次至每秒8-10次的范围内变动。这一变动范围足以使血管口径在很大范围内发生变化,从而调节不同器官的血流阻力和血流量。当支配某一器官血管床的并感缩血管纤维兴奋时,可引起该器官血管床的血流阻力增高,血流量减少;同时该器官毛细血管前阻力和毛细血管后阻力的比值增大,使毛细血管血压降低,组织液的生成减少而有利于重吸收;此外,该器官血管床的容量血管收缩,器官内的血容量减少。
近年来,用免疫细胞化学等方法证明,缩血管纤维中有神经肽Y与去甲肾上腺素共存,神经兴奋时两者可共同释放。神经肽Y具有极强烈的缩血管效应。
(2)舒血管神经纤维;体内有一部分血管除接受缩血管纤维支配外,还接受舒血管纤维支配。舒血管神经纤维主要有以下几种:
1)交感舒血管神经纤维:有些动物如狗和猫,支配骨骼肌微动脉的交感神经中除有缩血管纤维外,还有舒血管纤维。交感舒血管纤维末梢释放的递质为乙酰胆碱,阿托品可阻断其效应。交感舒血管纤维在平时没有紧张性活动,只有在动物处于情绪激动状态和发生防御反应时才发放冲动,使骨骼肌血管舒张,血流量增多。在人体内可能也有交感舒血管纤维存在。
2)副交感舒血管神经纤维:少数器官如脑膜、唾液腺、胃肠外分泌腺和外生殖器等,其血管平滑肌除接受交感缩血管纤维支配外,还接受副交感舒血管纤维支配。例如面神经中有支配软脑膜血管的副交感纤维,迷走神经中有支配肝血管的副交感纤维,盆神经中有支配盆腔器官和外生殖器血管的副交感纤维等等。副交感舒血管纤维末梢释放的递质为乙酰胆碱,后者与血管平滑肌的M型胆碱能受体结合,引起血管舒张。副交感舒血管纤维的活动只对器官组织局部血流起调节作用,对循环系统总的外周阻力的影响很小。
3)脊髓背根舒血管纤维:皮肤伤害性感觉传入纤维在外周末梢可发生分支。当皮肤受到伤害性刺激时,感觉冲动一方面沿传入纤维向中枢传导,另一方面可在末梢分叉处沿其它分支到达受刺激部位邻近的微动脉,使微动脉舒张,局部皮肤出现红晕。这种仅通过轴突外周部位完成的反应,称为轴突反射。这种神经纤维也称背根舒血管纤维,其释放的递质还不很清楚,有人认为是P物质,也有人认为可能是组胺或ATP。近年来用免疫细胞化学方法证明,脊神经节感觉神经元中有降钙素基因相关肽与P物质共存;另外,在许多血管周围常可看到有降钙素基因相关肽神经纤维分布。降钙素基因相关肽有强烈的舒血管效应,故有人认为这种多肽可能是引起轴突反射舒血管效应的递质。
4)血管活性肠肽神经元:有些自主神经元内有血管活性肠肽和乙酰胆碱共存,例如支配汗腺的交感神经元和支配颌下腺的副交感神经元等。这些神经元兴奋时,其末稍一方面释放乙酰胆碱,引起腺细胞分泌;另一方面释放血管活性肠肽,引起舒血管效应,使局部组织血流增加。
(二)心血管中枢
神经系统对心血管活动的调节是通过各种神经反射来实现的。在生理学中将与控制心血管活动有关的神经元集中的部位称为心血管中枢。控制心血管活动的神经元并不是只集中在中枢神经系统的一个部位,而是分布在中枢神经系统从脊髓到大脑皮层的各个水平上,它们各具不同的功能,又互相密切联系,使整个心血管系统的活动协调一致,并与整个机体的活动相适应。
1.延髓心血管中枢一般认为,最基本的心血管中枢位于延髓。这一概念最早是在19世纪70年代提出的。它基于以下的动物实验结果:在延髓上缘横断脑干后,动物的血压并无明显的变化,刺激坐骨神经引起的升血压反射也仍存在;但如果将横断水平逐步移向脑干尾端,则动脉血压就逐渐降低,刺激坐骨神经引起的升血压反射效应也逐渐减弱。当横断水平下移至延髓闩部时,血压降低至大约5.3kPa(40mmHg)。这些结果说明,心血管的正常的紧张性活动不是起源于脊髓,而是起源于延髓,因为只要保留延髓及其以下中枢部分的完整,就可以维持心血管正常的紧张性活动,并完成一定的心血管反射活动。
延髓心血管中枢的神经元是指位于延髓内的心迷走神经元和控制心交感神经和交感缩血管神经活动的神经元。这些神经元在平时都有紧张性活动,分别称为心迷走紧张、心交感紧张和交感缩血管紧张。在机体处于安静状态时,这些延髓神经元的紧张性活动表现为心迷走神经纤维和交感神经纤维持续的低频放电活动。
一般认为,延髓心血管中枢至少可包括以下四个部位的神经元:
(1)缩血管区:引起交感缩血管神经正常的紧张性活动的延髓心血管神经元的细胞体位于延髓头端的腹外侧部,称为C1区。这些神经元内含有肾上腺素,它们的轴突下行到脊髓的中间外侧柱。心交感紧张也起源于此区神经元。
(2)舒血管区:位于延髓尾端腹外侧部A1区(即在C1区的尾端)的去甲肾上腺素神经元,在兴奋时可抑制C1区神经元的活动,导致交感缩血管紧张降低,血管舒张。
(3)传入神经接替站:延髓孤束核的神经元接受由颈动脉窦、主动脉弓和心脏感受器经舌咽神经和迷走神经传入的信息,然后发出纤维至延髓和中枢神经系统其它部位的神经元,继而影响心血管活动。
(4)心抑制区:心迷走神经元的细胞体位于延髓的迷走神经背核和疑核。
2.延髓以上的心血管中枢在延髓以上的脑干部分以及大脑和小脑中,也都存在与心血管活动有关的神经元。它们在心血管活动调节中所起的作用较延髓心血管中枢更加高级,特别是表现为对心血管活动和机体其它功能之间的复杂的整合。例如下丘脑是一个非常重要的整合部位,在体温调节、摄食、水平衡以及发怒、恐惧等情绪反应的整合中,都起着重要的作用。这些反应都包含有相应的心血管活动的变化。在动物实验中可以看到,电刺激下丘脑的一些区域,可以引起躯体肌肉以及心血管、呼吸和其它内脏活动的复杂的变化。这些变化往往是通过精细整合的,在生理功能上往往是相互协调的。例如电刺激下丘脑的“防御反应区”,可立即引起动物的警觉状态,骨骼肌肌紧张加强,表现出准备防御的姿势等行为反应,同时出现一系列心血管活动的改变,主要是心率加快,心搏加强,心输出量增加,皮肤和内脏血管收缩,骨骼肌血管舒张,血压稍有升高。这些心血管反应显然是与当时机体所处的状态相协调的,主要是使骨骼肌有充足的血液供应,以适应防御、搏斗或逃跑等行为的需要。
大脑的一些部位,特别是边缘系统的结构,如颞极、额叶的眶面、扣带回的前部、杏仁、隔、海马等,能影响下丘脑和脑干其它部位的心血管神经元的活动,并和机体各种行为的改变相协调。大脑新皮层的运动区兴奋时,除引起相应的骨骼肌收缩外,还能引起该骨骼肌的血管舒张。刺激小脑的一些部位也可引起心血管活动的反应。例如刺激小脑顶核可引起血压升高,心率加快。顶核的这种效应可能与姿势和体位改变时伴随的心血管活动变化有关。
(三)心血管反射
当机体处于不同的生理状态如变换姿势、运动、睡眠时,或当机体内、外环境发生变化时,可引起各种心血管反射,使心输出量和各器官的血管收缩状况发生相应的改变,动脉血压也可发生变动。心血管反射一般都能很快完成,其生理意义在于使循环功能能适应于当时机体所处的状态或环境的变化。
1.颈动脉窦和主动脉弓压力感觉反射当动脉血压升高时,可引起压力感受性反射,其反射效应是使心率减慢,外周血管阻力降低,血压回降。因此这一反射曾被称为降压反射。
(1)动脉压力感觉器:压力感受性反射的感受装置是位于颈动脉窦和主动脉弓血管外膜下的感觉神经末梢,称为动脉压力感受器(图4-25)。动脉压力感觉器并不是直接感觉血压的变化,而是感觉血管壁的机械牵张程度。当动脉血压升高时,动脉管壁被牵张的的程度就升高,压力感觉器发放的神经冲动也就增多。在一定范围内,压力感觉器的传入冲动频率与动脉管壁扩张程度成正比。由图4-26可见,在一个心动周期内,随着动脉血压的波动,窦神经的传入冲动频率也发生相应的变化。
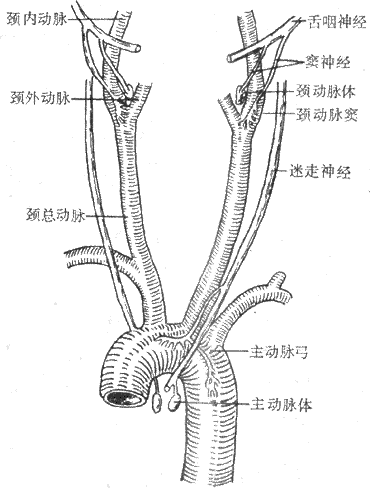
图4-25颈动脉窦区与主动脉弓区的压力感受器与化学感受器
(2)传入神经和中枢联系:颈动脉窦压力感受器的传入神经纤维组成颈动脉窦神经。窦神经加入舌咽神经,进入延髓,和孤束核的神经元发生突触联系。主动脉弓压力感受器的传入神经纤维行走于迷走神经干内,然后进入延髓,到达孤束核。兔的主动脉弓压力感受器传入纤维自成一束,与迷走神经伴行,称为主动脉神经。

图4-26单根窦神经压力感受器传入纤维在不同动脉压时的放电图
中最上方为主动脉血压波,左侧的数字为主动脉平均压(mmHg,1mmHg=0.133kPa)
压力感受器的传入神经冲动到达孤束核后,可通过延髓内的神经通路使延髓端腹外侧部C1区的血管运动神经元抑制从而使交感神经紧张性活动减弱;孤束核神经元还与延髓内其它神经核团以及脑干其它部位如脑桥、下丘脑等的一些神经核团发生联系,其效应也是使交感神经紧张性活动减弱。另外,压力感受器的传入冲动到达孤束核后还与迷走神经背核和疑核发生联系,使迷走神经的活动加强。
(3)反射效应:动脉血压升高时,压力感受器传入冲动增多,通过中枢机制,使心迷走紧张加强,心交感紧张和交感缩血管紧张减弱,其效应为心率减慢,心输出量减少,外周血管阻力降低,故动脉血压下降。反之,当动脉血压降低时,压力感受器传入冲动减少,使迷走紧张减弱,交感紧张加强,于是心率加快,心输出量增加,外周血管阻力增高,血压回升。
在动物实验中可将颈动脉窦区和循环系统其余部分隔离开来,但仍保留它通过窦神经与中枢的联系。在这样的制备中,人为地改变颈动脉窦区的灌注压,就可以引起体循环动脉压的变化,并画出压力感受性反射功能曲线(见图4-27)。由图可见,压力感受性反射功能曲线的中间部分较陡,向两端渐趋平坦。这说明当窦内压在正常平均动脉压水平(大约13.3kPa或100mmHg)的范围内发生变动时,压力感受性反射最为敏感,纠正偏离正常水平的血压的能力最强,动脉血压偏离正常水平愈远,压力感受性反射纠正异常血压的能力愈低。
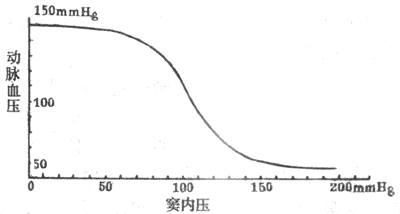
图4-27 在实验中测得的颈动脉窦内压力与动脉血压的关系(1mmHg=0.133kPa)
(4)压力感受性反射的生理意义:压力感受性反射在心输出量、外周血管阻力、血量等发生突然变化的情况下,对动脉血压进行快速调节的过程中起重要的作用,使动脉血压不致发生过分的波动,因此在生理学中将动脉压力感受器的传入神经称为缓冲神经。在动物实验中可看到,正常狗24小时内动脉血压的变化范围一般在平均动脉压(约13.3kPa或100mmHg)约1.3-2.0kPa(10-15mmHg)以内;而在切除两侧缓冲神经的狗,血压经常出现很大的波动,其变动范围可超过平均动脉压上下各6.7kPa(50mmHg)。但是,在切除缓冲神经的动物,一天中血压的平均值并不明显高于正常,因此认为压力感受性反射在动脉血压的长期调节中并不起重要作用。在慢性高血压患者或实验性高血压动物中,压力感受性反射功能曲线向右移位。这种现象称为压力感受性反射的重调定(resetting),表示在高血压的情况下压力感受性反射的工作范围发生改变,即在较正常高的血压水平上进行工作,故动脉血压维持在比较高的水平。压力感受性反射重调定的机制比较复杂。重调定可发生在感受器的水平,也可发生在反射的中枢部分。
2.心肺感受器引起的心血管反射在心房、心室和肺循环大血管壁存在许多感受器,总称为心肺感受器,其传入神经纤维行走于迷走神经干内。引起心肺感受器兴奋的适宜刺激有两大类。一类是血管壁的机械牵张。当心房、心室或肺循环大血管中压力升高或血容量增多而使心脏或血管壁受到牵张时,这些机械或压力感受器就发生兴奋。和颈动脉窦、主动脉弓压力感受器相比较,心肺感受器位于循环系统压力较低的部分,故常称之为低压力感受器,而动脉压力感受器则称为高压力感受器。在生理情况下,心房壁的牵张主要是由血容量增多而引起的,因此心房壁的牵张感受器也称为容量感受器。另一类心肺感受器的适宜刺激是一些化学物质,如前列腺素、缓激肽等。有些约物如藜芦碱等也能刺激心肺感受器。
大多数心肺感受器受刺激时引起的反射效应是交感紧张降低,心迷走紧张加强,导致心率减慢,心输出量减少,外周血管阻力降低,故血压下降。在多种实验动物中,心肺感受器兴奋时肾交感神经活动的抑制特别明显,使肾血流量增加,肾排水和排钠量增多。这表明心肺感受器引起的反射在血量及体液的量和成分的调节中有重要的生理意义。心肺感受器引起的反射的传出途径除神经外还有体液的成分。心肺感受器的传入冲动可抑制血管升压素的释放。血管升压素的减少导致肾排水增多(见后)。
3.颈动脉体和主动脉体化学感受性反射在颈总动脉分叉处和主动脉弓区域,存在一些特殊的感受装置,当血液的某些化学成分发生变化时,如缺氧、CO2分压过高、H+浓度过高等,可以刺激这些感受装置。因此这些感受装置被称为颈动脉体和主动脉体化学感受器。这些化学感受器受到刺激后,其感觉信号分别由颈动脉窦神经和迷走神经传入至延髓孤束核,然后使延髓内呼吸神经元和心血管活动神经元的活动发生改变。
化学感受性反射的效应主要是呼吸加深加快(详见第五章)。在动物实验中人为地维持呼吸频率和深度不变,则化学感受器传入冲动对心血管活动的直接效应是心率减慢,心输出量减少,冠状动脉舒张,骨骼肌和内脏血管收缩。由于外周血管阻力增大的作用超过心输出量减少的作用,故血压升高。在动物保持自然呼吸的情况下,化学感受器受刺激时引起的呼吸加深加快,心输出量增加,外周血管阻力增大,血压升高。
化学感受性反射在平时对心血管活动并不起明显的调节作用。只有在低氧、窒息、失血、动脉血压过低和酸中毒情况下才发生作用。
4.躯体感受器引起的心血管反射刺激躯体传入神经时可以引起各种心血管反射。反射的效应取决于感受器的性质、刺激的强度和频率等因素。用低至中等强度的低频电脉冲刺激骨骼肌传入神经,常可引起降血压效应;而用高强度高频率电刺激皮肤传入神经,则常引起升血压效应。在平时,肌肉活动,皮肤冷、热刺激以及各种伤害性刺激都能引起心血管反射活动。中医针刺治疗某些心血管疾病的生理基础,就在于激活肌肉或皮肤的一些感受器传入活动,通过中枢神经系统内复杂的机制,使异常的心血管活动得到调整。
5.其它内脏感受器引起的心血管反射扩张肺、胃、肠、膀胱等空腔器官,挤压睾丸等,常可引起心率减慢和外周血管舒张等效应。这些内脏感受器的传入神经纤维行走于迷走神经或交感神经内。
6.脑缺血反应当脑血流量减少时,心血管中枢的神经元可对脑缺血发生反应,引起交感缩血管紧张显著加强,外周血管高度收缩,动脉血压升高,称为脑缺血反应。
(四)心血管反射的中枢整合型式
在过去较长的时期中,生理学的一个概念是认为整个交感神经系统或者一起兴奋,或者一起抑制。但后来认识到,不同部分的交感神经、副交感神经的活动都是有分化的。具体地说,对于某种特定的刺激,不同部分的交感神经的反应方式和程度是不同的,即表现为一定整合型式的反应,使各器官之间的血流分配能适应机体当时功能活动的需要。例如当动物的安全受到威胁而处于警觉、戒备状态时,可出现一系列复杂的行为和心血管反应,称为防御反应。猫的防御反应表现为瞳孔扩大、竖毛、耳廓平展、弓背、伸爪、呼吸加深、怒叫,最后发展为搏斗或逃跑;伴随防御反应的心血管整合型式,最特征性的是骨骼肌血管舒张,同时心率加快,心输出量增加,内脏和皮肤血管收缩,血压轻度升高。人在情绪激动时也可发生这一整套心血管反应整合型式。肌肉运动时心血管活动的整合型式与防御反应相似,但血管舒张仅发生在进行运动的肌肉,不进行运动的肌肉的血管发生收缩。睡眠时心脏和血管的活动恰好与防御反应时相反,即心率减慢,心输出量稍减少,内脏血管舒张,骨骼肌血管收缩,血压稍降低。
二、体液调节
心血管活动的体液调节是指血液和组织液中一些化学物质对心肌和血管平滑肌的活动发生影响,从而起调节作用。这些体液因素中,有些是通过血液携带的,可广泛作用于心血管系统;有些则在组织中形成,主要作用于局部的血管,对局部组织的血流起调节作用。
(一)肾素-血管紧张素系统
肾素是由肾近球细胞合成和分泌的一种酸性蛋白酶,经肾静脉进入血循环。血浆中的肾素底物,即血管紧张素原,在肾素的作用下水解,产生一个十肽,为血管紧张素I。在血浆和组织中,特别是在肺循环血管内皮表面,存在有血管紧张素转换酶,在后者的作用下,血管紧张素I水解,产生一个八肽,为血管紧张素Ⅱ。血管紧张素Ⅱ在血浆和组织中的血管紧张素酶A的作用下,再失去一个氨基酸,成为七肽血管紧张素Ⅲ。上述过程可由图4-28表示。血管紧张素Ⅱ和血管紧张素Ⅲ作用于血管平滑肌和肾上腺皮质等细胞的血管紧张素受体,引起相应的生理效应。
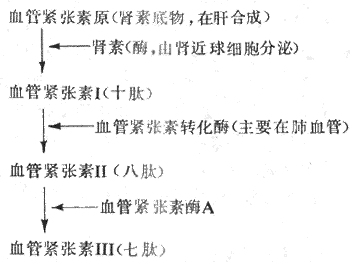
当各种原因引起肾血流灌注减少时,肾素分泌就会增多。血浆中Na+浓度降低时,肾素分泌也增加。肾素分泌受神经和体液机制的调节,详见第八章。
对体内多数组织、细胞来说,血管紧张素I不具有活性。血管紧张素中最重要的是血管紧张素Ⅱ。血管紧张素Ⅱ可直接使全身微动脉收缩,血压升高;也可使静脉收缩,回心血量增多。血管紧张素Ⅱ可作用于交感缩血管纤维末梢上的接头前血管紧张素受体,起接头前调制的作用,使交感神经末梢释放递质增多。血管紧张素Ⅱ还可作用于中枢神经系统内一些神经元的血管紧张素受体,使交感缩血管紧张加强。因此,血管紧张素Ⅱ可以通过中枢和外周机制,使外周血管阻力增大,血压升高。此外,血管紧张素Ⅱ可强烈刺激肾上腺皮质球状带细胞合成和释放醛固酮,后者可促进肾小管对Na+的重吸收,并使细胞外液量增加。血管紧张素Ⅱ还可引起或增强渴觉,并导致饮水行为。血管紧张素Ⅲ的缩血管效应仅为血管紧张素Ⅱ的10%-20%,但刺激肾上腺皮质合成和释放醛固酮的作用较强。
在某些病理情况下,如失血时,肾素-血管紧张素系统的活动加强,并对循环功能的调节起重要作用。
(二)肾上腺素和去甲肾上腺素
肾上腺素和去甲肾上腺素在化学结构上都属于儿茶酚胺。循环血液中的肾上腺素和去甲肾上腺素主要来自肾上腺髓质的分泌。肾上腺素能神经末梢释放的递质去甲肾上腺素也有一小部分进入血液循环。肾上腺髓质释放的儿茶酚胺中,肾上腺素约占80%,去甲肾上腺素约占20%。
血液中的肾上腺素和去甲肾上腺素对心脏和血管的作用有许多共同点,但并不完全相同,因为两者对不同的肾上腺素能受体的结合能力不同。肾上腺素可与α和β两类肾上腺素能受体结合。在心脏,肾上腺素与β肾上腺素能受体结合,产生正性变时和变力作用,使心输出量增加。在血管,肾上腺素的作用取决于血管平滑肌上α和β肾上腺素能受体分布的情况。在皮肤、肾、胃肠、血管平滑肌上α肾上腺素能受体在数量上占优势,肾上腺素的作用是使这些器官的血管收缩;在骨骼肌和肝的血管,β肾上腺素能受体占优势,小剂量的肾上腺素常以兴奋β肾上腺素能受体的效应为主,引起血管舒张,大剂量时也兴奋α肾上腺素能受体,引起血管收缩。去甲肾上腺素主要与α肾上腺素能受体结合,也可与心肌的β1肾上腺素能受体结合,但和血管平滑肌的β2肾上腺素能受体结合的能力较弱。静脉注射去甲肾上腺素,可使全身血管广泛收缩,动脉血压升高;血压升高又使压力感受性反射活动加强,压力感受性反射对心脏的效应超过去甲肾上腺素对心脏的直接效应,故心率减慢。
(三)血管升压素
血管升压素是下丘脑视上核和室旁核一部分神经元内合成的。这些神经元的轴突行走在下丘脑垂体束中并进入垂体后叶,其末梢释放的血管升压素作为垂体后叶激素进入血循环。血管升压素的合成和释放过程也称为神经分泌。
血管升压素在肾集合管可促进水的重吸收,故又称为抗利尿激素(见第八章)。血管升压素作用于血管平滑肌的相应受体,引起血管平滑肌收缩,是已知的最强的缩血管物质之一。在正常情况下,血浆中血管升压素浓度升高时首先出现抗利尿效应;只有当其血浆浓度明显高于正常时,才引起血压升高。这是因为血管升压素能提高压力感受性反射的敏感性,故能缓冲升血压效应。血管升压素对体内细胞外液量的调节起重要作用。在禁水、失水、失血等情况下,血管升压素释放增加,不仅对保留体内液体量,而且对维持动脉血压,都起重要的作用。
(四)血管内皮生成的血管活性物质
多年来一直以为血管内皮只是衬在心脏和血管腔面的一层单层细胞组织;在毛细血管处,通过内皮进行血管内外的物质交换。近年已证实,内皮细胞可以生成并释放若干种血管活性物质,引起血管平滑肌舒张或收缩。
1.血管内皮生成的舒血管物质血管内皮生成和释放的舒血管物质有多种。内皮细胞内的前列环素合成酶可以合成前列环素(也称前列腺素I2,即PGI2)。血管内的搏动性血流对内皮产生的切应力可使内皮释放PGI2,后者使血管舒张。
现在认为,内皮生成的另一类舒血管物质更重要,即内皮舒张因子(endothelium-derivedrelaxing factor, EDRF)。EDRF的化学结构尚未完全弄清,但多数人认为可能是一氧化氮(NO),其前体是L-精氨酸。EDRF可使血管平滑肌内的鸟苷酸环化酶激活,cGMP浓度升高,游离Ca2+浓度降低,故血管舒张。血流对血管内皮产生的切应力可引起EDRF的释放。低氧也可使内皮释放EDRF。此外,内皮细胞表面存在着一些受体,例如P物质受体、5-羟色胺受体、ATP受体、M型胆碱能受体等,这些受体被相应的物质激活后,可释放EDRF。有些缩血管物质,如去甲肾上腺素、血管升压素、血管紧张素Ⅱ等,也可使内皮释放EDRF,后者可减弱缩血管物质对血管平滑肌的直接收缩效应。在离体实验中可看到,将乙酰胆碱作用于内皮完整的血管,引起血管舒张;而将血管内皮去除后,乙酰胆碱则使血管收缩。
2.血管内皮生成的缩血管物质血管内皮细胞也可产生多种缩血管物质,称为内皮缩血因子(endothelum-derived vasoconstrictor factor,EDCF)。近年来研究得较深入的是内皮素。内皮素(endothelin)是内皮细胞合成和释放的由21个氨基酸构成的多肽,是已知的最强烈的缩血管物质之一。给动物注射内皮素可引起持续时间较长的升血压效应。但在升血压之前常先出现一个短暂的降血压过程。有人解释,内皮素也可引起EDRF的释放,故有一短暂的降血压反应。在生理情况下,血管内血流对内皮产生的切应力可使内皮细胞合成和释放内皮素。
(五)激肽释放酶-激肽系统
激肽释放酶是体内的一类蛋白酶,可使某些蛋白质底物激肽原分解为激肽。激肽具有舒血管活性,可参与对血压和局部组织血流的调节。
激肽释放酶可分为两大类,一类存在于血浆,称为血浆激肽释放酶;另一类存在于肾、唾液腺、胰腺等器官组织内,称为腺体激肽释放酶或组织激肽释放酶。激肽原是存在于血浆中的一些蛋白质,分为高分子量激肽原和低分子量激肽原。在血浆中,血浆激肽释放酶作用于高分子量激肽原,使之水解,产生一种九肽,即缓激肽。在肾、唾液腺、胰腺、汗腺以及胃肠粘膜等组织中,腺体激肽释放酶作用于血浆中的低分子量激肽原,产生一种十肽,为赖氨酰缓激肽,也称胰激肽或血管舒张素。后者在氨基肽酶的作用下失去赖氨酸,成为缓激肽。缓激肽在激肽酶的作用下水解失活。
激肽可使血管平滑肌舒张和毛细血管通透性增高;但对其它的平滑肌则引起收缩。在人体和动物实验中证实,缓激肽和血管舒张素是已知的最强烈的舒血管物质。在一些腺体器官中生成的激肽,可以使器官局部的血管舒张,血流量增加。
循环血液中的缓激肽和血管舒张素等激肽也参与对动脉血压的调节,使血管舒张,血压降低。
(六)心钠素
心钠素(cardionatrin)是由心房肌细胞合成和释放的一类多肽。在人的循环血液中,最主要的是一种由28个氨基酸构成的多肽。心钠素可使血管舒张,外周阻力降低;也可使每搏输出量减少,心率减慢,故心输出量减少。心钠素作用于肾的受体,还可以使肾排水和排钠增多,故心钠素也称为心房利尿钠肽(atrial natriuretic peptide)。此外,心钠素还能抑制肾的近球细胞释放肾素,抑制肾上腺球状带细胞释放醛固酮;在脑内,心钠素可以抑制血管升压素的释放。这些作用都可导致体内细胞外液量减少。
当心房壁受到牵拉时,可引起心钠素的释放。在生理情况下,当血容量增多、取头低足高的体位、身体浸入水中(头露出水面)时,血浆心钠素浓度升高,并引起利尿和尿钠排出增多等效应。因此,心钠素是体内调节水盐平衡的一种重要的体液因素。心钠素和另外一些体液因素在血压和水盐平衡的调节中还起相互制约的作用。内皮素和血管升压素也都能刺激心房肌细胞释放心钠素。
(七)前列腺素
前列腺素是一族二十碳不饱和脂肪酸,分子中有个环戊烷,其前体是花生四烯酸或其它二十碳不饱和脂肪酸。全身各部的组织细胞几乎都含有生成前列腺素的前体及酶,因此都能产生前列腺素。前列腺素按其分子结构的差别,可分为多种类型。各种前列腺素对血管平滑肌的作用是不同的,例如前列腺素E2具有强烈的舒血管作用,前列腺素F2α则使静脉收缩。前列环素(即前列腺素I2)是在血管组织中合成的一种前列腺素,有强烈的舒血管作用。
交感缩血管纤维末梢释放递质的过程受前列腺素调制。去甲肾上腺素和血管紧张素Ⅱ等缩血管物质作用于血管平滑肌相应的受体,引起血管平滑肌收缩,同时也使血管平滑肌生成前列腺素E2和前列环素。前列腺素E2和前列环素可使血管平滑肌对去甲肾上腺素和血管紧张素Ⅱ的敏感性降低。另一方面,血管平滑肌生成的前列腺素又可通过神经-平滑肌接头间隙作用于交感神经纤维末梢接头前的前列腺素受体,使交感纤维末梢释放递质减少。可见,前列腺素在交感神经-血管平滑肌接头处起着一种局部负反馈调节作用。
(八)阿片肽
体内的阿片肽有多种。垂体释放的β-内啡肽和促肾上腺皮质激素来自同一个前体。在应激等情况下,β-内啡肽和促肾上腺皮质激素一起被释放入血液。β-内啡肽可使血压降低。β-内啡肽的降血压作用可能主要是中枢性的。血浆中的β-内啡肽可进入脑内并作用于某些与心血管活动有关的神经核团,使交感神经活动抑制,心迷走神经活动加强。内毒素、失血等强烈刺激可引起β-内啡肽释放,并可能成为引起循环休克的原因之一。针刺穴位也可引起脑内阿片肽的释放。这可能是针刺使高血压患者血压下降的机制之一。
除中枢作用外,阿片肽也可作用于外周的阿片受体。血管壁的阿片受体在阿片肽作用下,可导致血管平滑肌舒张。另外,交感缩血管纤维末梢也存在接头前阿片受体,这些受体被阿片肽激活时,可使交感纤维释放递质减少。
(九)组胺
组胺是由组氨酸在脱羧酶的作用下产生的。许多组织,特别是皮肤、肺和肠粘膜的肥大细胞中含有大量的组胺。当组织受到损伤或发生炎症和过敏反应时,都可释放组胺。组胺有强烈的舒血管作用,并能使毛细血管和微静脉的管壁通透性增加,血浆漏入组织,导致局部组织水肿。
三、局部血流调节
体内各器官的血流量一般取决于器官组织的代谢活动,代谢活动愈强,耗氧愈多,血流量也就愈多。器官血流量主要通过对灌注该器官的阻力血管的口径的调节而得到控制。除了前述的神经调节和体液调节机制外,还有局部组织内的调节机制。在不同器官的血管,神经、体液和局部机制三者所起作用的相互关系是不同的,在多数情况下,几种机制起协同作用,但在有些情况下也可起相互对抗的作用。另外,不同器官的血流量变化范围也有较大的差别,功能活动变化较大的器官,如骨骼肌、胃肠、肝、皮肤等,血流量的变化范围较大;脑、肾等器官的血流量则比较稳定,在一定的血压变化范围内,器官血流量可保持稳定。
实验证明,如果将调节血管活动的外部神经、体液因素都去除,则在一定的血压变动范围内,器官、组织的血流量仍能通过局部的机制得到适当的调节。这种调节机制存在于器官组织或血管本身,故也称为自身调节。心脏的泵血功能也有自身的调节机制,已在本章第一节中叙述。关于器官组织血流量的局部调节机制,一般认为主要有以下两类:
(一)代谢性自身调节机制
组织细胞代谢需要氧,并产生各种代谢产物。局部组织中的氧和代谢产物对该组织局部的血流量起代谢性自身调节作用。当组织代谢活动增强时,局部组织中氧分压降低,代谢产物积聚增加。组织中氧分压降低以及多种代谢产物,如CO2、H+离子、腺苷、ATP、K+离子等,都能使局部的微动脉和毛细血管前括约肌舒张。因此,当组织的代谢活动加强(例如肌肉运动)时,局部的血流量增多,故能向组织提供更多的氧,并带走代谢产物。这种代谢性局部舒血管效应有时相当明显,如果同时发生交感缩血管神经活动加强,该局部组织的血管仍舒张。
前面提到,有一些体液因素也可在组织中形成,并对局部的血流量起调节作用,例如激肽、前列腺素、组胺等,由于这些物质都是特殊的体液因素,故在生理学中将它们归在体液调节中。
(二)肌源性自身调节机制
许多血管平滑肌本身经常保持一定的紧张性收缩,称为肌源性活动。血管平滑肌还有一个特性,即当被牵张时其肌源性活动加强。因此,当供应某一器官的血管的灌注压突然升高时,由于血管跨壁压增大,血管平滑肌受到牵张刺激,于是肌源性活动增强。这种现象在毛细血管前阻力血管段特别明显。其结果是器官的血流阻力增大,器官的血流量不致因灌注压升高而增多,即器官血流量能因此保持相对稳定。当器官血管的灌注压突然降低时,则发生相反的变化,即阻力血管舒张,血流量仍保持相对稳定。这种肌源性的自身调节现象,在肾血管表现特别明显,在脑、心、肝、肠系膜和骨骼肌的血管也能看到,但皮肤血管一般没有这种表现。在实验中用罂粟碱、水合氯醛或氰化钠等药物抑制平滑肌的活动后,肌源性自身调节现象也随之消失。
四、动脉血压的长期调节
动脉血压的神经调节主要是在短时间内血压发生变化的情况下起调节作用的。而当血压在较长时间内(数小时,数天,数月或更长)发生变化时,神经反射的效应常不足以将血压调节到正常水平。在动脉血压的长期调节中起重要作用的是肾。具体地说,肾通过对体内细胞外液量的调节而对动脉血压起调节作用。有人将这种机制称为肾-体液控制系统。此系统的活动过程如下:当体内细胞外液量增多时,血量增多,血量和循环系统容量之间的相对关系发生改变,使动脉血压升高;而当动脉血压升高时,能直接导致肾排水和排钠增加,将过多的体液排出体外,从而使血压恢复到正常水平。体内细胞外液量减少时,发生相反的过程,即肾排水和排钠减少,使体液量和动脉血压恢复。
肾-体液控制系统调节血压的效能取决于一定的血压变化能引起多大程度的肾排水排钠变化。实验证明,血压只要发生很小的变化,就可导致肾排尿量的明显变化。血压从正常水平(13.3kPa,100mmHg)升高1.3kPa(10mmHg),肾排尿量可增加数倍,从而使细胞外液量减少,动脉血压下降。反之,动脉血压降低时,肾排尿明显减少,使细胞外液量增多,血压回升。
肾-体液控制系统的活动也可受体内若干因素的影响,其中较重要的是血管升压素和肾素-血管紧张素-醛固酮系统。前已述,血管升压素在调节体内细胞外液量中起重要作用。血管升压素使肾集合管增加对水的重吸收,导致细胞外液量增加。当血量增加时,血管升压素减少,使肾排水增加。血管紧张素Ⅱ除引起血管收缩,血压升高外,还能促使肾上腺皮质分泌醛固酮。醛因酮能使肾小管对Na+的重吸收增加,并分泌K+和H+,在重吸收Na+时也吸收水,故细胞外液量和体内的Na+量增加,血压升高。
总之,血压的调节是复杂的过程,有许多机制参与。每一种机制都在一个方面发挥调节作用,但不能完成全部的、复杂的调节。神经调节一般是快速的、短期的调节,主要是通过对阻力血管口径及心脏活动的调节来实现的;而长期调节则主要是通过肾对细胞外液量的调节实现的。
第五节 器官循环
体内每一器官的血流量取决于主动脉压和中心静脉压之间的压力差,又取决于该器官阻力血管的舒缩状态。由于各器官的结构和功能各不相同,器官内部的血管分布又各有特征,因此其血流量的调节除服从前已述的一般规律外,还有其本身的特点。本节叙过心、肺、脑几个主要器官的血液循环特征。关于肾的血液循环特征,将在第八章叙述。
一、冠脉循环
(一)冠脉循环的解剖特点
心肌的血液供应来自左、右冠状动脉。冠状动脉的主干行走于心脏的表面,其小分支以垂直于心脏表面的方向穿入心肌,并在心内膜下层分支成网。这种分支方式使冠脉血管容易在心肌收缩进受到压迫。左、右冠状动脉及其分支的走向可有多种变异。在多数人中,左冠状动脉主要供左心室的前部,右冠状动脉主要供应左心室的后部和右心室。左冠状动脉的血液流经毛细血管和静脉后,主要经由冠状窦回流入右心房,而右冠动脉的血液则主要经较细的心前静脉直接回流入右心室。另外还有一小部分冠脉血液可通过心最小静脉直接流入左、右心房和心室腔内。
心肌的毛细血管网分布极为丰富。毛细血管数和心肌纤维数的比例为1:1。在心肌横截面上,每平方毫米面积内约有2500-3000根毛细血管。因此心肌和冠脉血液之间的物质交换可能很快地进行。冠状动脉之间有侧支互相吻合。在人类,这种吻合支戊内膜下较多。正常心脏的冠脉侧较细小,血流量很少。因此当冠状动脉突然阻塞时,不易很快建立侧支循环,常可导致心肌梗塞。但如果冠状动脉阻塞是缓慢形成的,则侧支可逐渐扩张,并可建立新的侧支循环,起代偿作用。
(二)冠脉血流的特点
在安静状态下,人冠脉血流量为每百克心肌每分钟60-80ml。中等体重的人,总的冠脉血流量为225ml/min,占心输出量的4%-5%。冠脉血流量的多少主要取决于心肌的活动,故左心室单位克重心肌组织的血流量大于右心室。当心肌活动加强,冠脉达到最大舒张状态时,冠脉血流量可增加到每百克心肌每分钟300-400ml。
由于肮脏血管的大部分分支深埋于心肌内,心脏在每次收缩时对埋于其内的血管产生压迫,从而影响冠脉血流。图4-29示狗的左、右冠状动脉血流在一个心动周期中的变化。在左心室等容收缩期,由于心肌收缩的强烈压迫,左冠状动脉血流急剧减少,甚至发生倒流。在左心室射血期,主动脉压升高,冠状动脉血压也随着升主,冠脉血流量增加。到慢速射血期,冠脉血流量又有下降。心肌舒张时,对冠脉血管的压迫解除,故冠脉血流的阻力显著减小,血流量增加。在等容舒张期,冠脉血流量突然增加,在舒张期的早期达到最高峰,然后逐渐回降,在左心室深层,心肌收缩对冠血流的影响更为明显。左心房收缩时对冠脉血流也可产生一定的影响,但并不显著。一般说来,左心室在收缩期血流量大约只有舒张期的20%-30%。当心肌收缩加强时,心缩期血流量所占的比例更小。由此可见,动脉舒张压的高低和心舒期的长短是影响冠脉血流量的重要因素。体循环外财阻力增大时,动脉舒张压升高,冠脉血流量增多。心率加快时,由于心动周期的缩短主要是心舒期缩短,故冠脉血流量也减少。右心室肌肉比较薄弱,收缩时对血流的影响不如左心室明显。在安静情况下,右心室收缩期的血流量和舒张期的血流量相差不多,或甚至多于后者。
(三)冠脉血流量的调节
对冠脉血流量进行调节的各种因素中,最重要的是心肌本身的代谢水平。交感和副交感神经也支配冠脉血管平滑肌,但它们的调节作用是次要的。
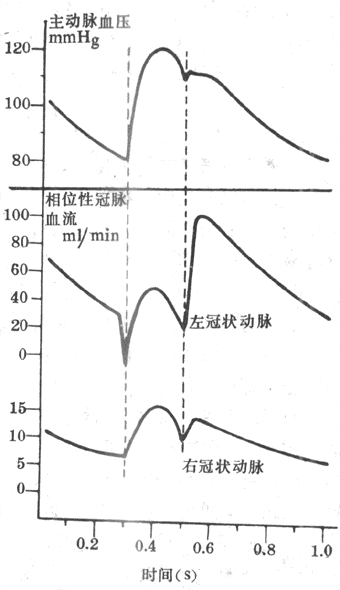
图4-29 一个心动周期中左、右冠状动脉血流变化情况(1mmHg=0.133kPa)
1.心肌代谢水平对冠脉血流量的影响 心肌收缩的能量来源几乎唯一地依靠有氧代谢。心肌因连续不断地进行舒缩,故耗氧量较大,即使在人体处于安静状态时,动脉血流经心脏后,其中65%-75%的氧被心肌摄取。因此心脏的动脉血和静脉血的含氧量差很大,换句话说,心肌提高从单位血液中摄取氧的潜力较不小。在肌肉运动、精神紧张等情况下,心肌代谢活动增强,耗氧量也随之增加。此时,机体主要通过冠脉血管舒张,即增加冠脉血流量来满足心肌对氧的需求。实验证明,冠脉血流量是和心肌代谢水平成正比的。在没有神经支配和循环激素作用的情况下,这种关系仍旧存在。目前认为,心肌代谢增强引起冠脉血管舒张的原因并非低氧本身,而是由于某些心肌代谢产物的增加。在各种代谢产物中,腺苷可能起最重要的作用。当心肌代谢增强而使局部组织中氧分压降低时,心肌细胞中的ATP分解为ADP和AMP。在冠脉血管周围的间质细胞中有5′-核苷酸酶,后者可使AMP分解产生腺苷。腺苷具有强烈的舒张小动脉的作用。腺苷生成的后,在几秒钟内即被破坏,因此不会引起其它器官的血管舒张。心肌的其它代谢产物如H+、CO2乳酸等,虽也能使冠脉舒张,但作用较弱。此外,缓激肽和前列腺素E等体液因素也能使冠脉血管舒张。
2.神经调节 冠状动脉受迷走神经和交感神经支配。迷走神经兴奋对冠状动脉的直接作用是引起舒张。但迷走神经兴奋又使心率减慢,心肌代谢率降低,这些因素可抵消迷走神经对冠状动脉的直接舒张作用。在动物实验中,如果使心率保持不变,则刺激迷走神经引起冠脉舒张。刺激心交感神经时,可激活冠脉平滑肌的α肾上腺素能受体,使血管收缩,但交感神经兴奋又同时激心肌的β肾上腺素能受体,使心率加快,心肌收缩加强,耗氧量增加,从而使冠脉舒张。给予β肾上腺素能受体拮抗剂后,刺激交感神经表现出直接的冠脉收缩反应。冠脉平滑肌上也有β肾上腺素能受体,后者被激活时引起冠脉舒张。交感神经兴奋对冠的β肾上腺至少能受体的激动一般不很明显。一些药物如异丙基肾上腺素对冠脉β肾上腺素能受体作用明显。
总之,在整体条件下,冠脉血流理主要是由心肌本身的代谢水平来调节的。神经因素对冠脉血流的影响在很短时间内就被心肌代谢改变所引起的血流变化所掩盖。
3.激素调节肾上腺素和去甲肾上腺素可通过增强心肌的代谢活动和耗氧量使冠脉血流量增加;也可直接作用于冠脉血管α或β肾上腺素能受体,引起冠脉血管收缩或舒张。甲状腺素增多时,心肌代谢加强,耗氧量增加,使冠状动脉舒张,血流量增加。大剂量血管升压素使冠状动脉收缩,冠脉血流量减少。血管紧张素Ⅱ也能使冠状动脉收缩,冠脉血流量减少。
二、肺循环
肺循环的功能是使血液在流经肺泡进和肺泡之间进行气体交换。呼吸性小支气管以上的呼吸道组织的营养物质收体循环的支气管的末梢之间有吻合支沟通。因此,有一部分支气管静脉血液可经过这些吻合支进入静脉和左心房,使主动脉血液中掺入1%-2%的静脉血。
(一)肺循环的生理特点
右心室的每分输出量和左心室的基本相同。肺动脉及其分支都较粗,管壁较主动脉及其分支薄。肺循环的全部血管都在胸腔内,而胸腔内的压力低于大气压。这些因素使肺循环有与体循环不同的一些特点。
1.血流阻力和血压 肺动脉管壁厚度仅为主动脉的三分之一,其分支短而管径较粗,故肺动脉的可扩张性较高,对血流的阻力较小。肺循环动脉部分总的阻力和静脉部分总的阻力大致相等,故血流在动脉部分的压力降落和在静脉部分的压力降落相等。肺循环毛细血管压大致在右心室压和左心房压数值的中点。由于肺循环血管对血流的阻力小,所以,虽然右心室的每分输出理和左心室每分输出量相等,但肺动脉压远较主动脉压为低。右心室压和肺动脉压可用插入导管的方法直接测量。在正常人,右心室收缩压平均约2.9kPa(22mmHg),舒张压为0-0.13kPa(0-1mmHg)。肺动脉的收缩压和右心室收缩压相同,平均为2.2kPa(22mmHg),舒张压为1.1kPa(8mmHg),平均压约1.7kPa(13mmHg)。用间接方法可测得肺循环行细血管平均压为0.9kPa(7mmHg)。肺循环的终点,即肺静脉和左心房内压为0.13-0.53kPa(1-4mmHg),平均约0.27kPa(2mmHg)。
2.肺的血容量 肺部的血容量约为450ml,占全身血量的9%。由于肺组织和肺血管的可扩张性大,故肺部血容量的变化范围较大。在用力呼气时,肺部血容量减少至约200ml;而在深吸气地可增加到约1000ml。由于肺的血容量较多,而且变化范围较大,故肺循环血管起着贮血库的作用。当机体失血时,肺循环可将一部分血液转移至体循环,起代偿作用。在每一个呼吸周期中,肺循环的血容量也发生周期性的变化,并对左心室输出量和动脉血压发生影响。在吸气时,由腔静脉回流入右心房的血量增多,右心室射出的血量也就增加。由于肺扩张时可将肺循环的血管牵拉扩张,使其容量增大,能容纳较多的血液而由肺静脉回流入左心房的血液则减少。但在几次心搏后,扩张的肺循环血管已被充盈,故肺静脉回流入左心房的血量逐渐增加。在呼气时,发生相反的过程。因此,在吸气开始时,动脉血压下降,到吸气相反相的后半期降至最低点,以后逐渐回升,在呼气相的后半期达到最高点。在呼吸周期中出现的这种血压波动,称为动脉血压的呼吸波。
3.肺循环毛细血管外的液体交换 如前所述,肺循环毛细血管平均约0.9kPa(7mmHg),而血浆胶体渗透压平均3.3kPa(25mmHg),故将组织中的液体吸收入毛细血管的力量较大。现在一般认肺部组织液的压力为负压。这一负压使肺泡膜和毛细血管管壁互相紧密相贴,有利于肺胞和血液之间的气体交换。组织液负压还有利于吸收肺泡内的液体,使肺泡内没有液体积聚。在某些病理情况下,如左心衰竭时,肺静脉压力升高,肺循环毛细血管压也随着升高,就可使液体积聚在肺泡或肺的组织间隙中,形成肺水肿。
(二)肺循环血流量的调节
1.神经调节 肺循环血管受交感神经和迷走神经支配。刺激交感神经对肺血管的直接作用是引起收缩和血流阻力增大。但在整体情况下,交感神经兴奋时体循环的血管收缩,将一部分血液挤入肺循环,使肺循环内血容量增加。循环血液中的儿茶酚胺也有同样的效应。刺激迷走神经可使肺血管舒张。乙酰胆碱也能使肺血管舒张,但在流经肺部后即分解失活。
2.肺泡气的氧分压 肺泡气的氧分压对肺部血管的舒缩活动有明显的影响。急性或慢性的低氧都能使肺部血管收缩,血流阻力增大。引起肺血管收缩的原因是肺泡气的氧分压低而不是血管内血液的氧张力低。当一部分肺泡内气体的氧分压低时,这些肺泡周围的微动脉收缩。在肺泡气的CO2分压升高时,低氧引起的肺部微动脉的收缩更加显著。可见肺循环血管对局部低氧发生的反应和体循环血管不同。肺部血管对低氧发生缩血管反应的机制,目前还不完全清楚。有人推测低氧可能使肺组织产生一种缩血管物质,也有人认为必需有血管内皮存在才能发生这种缩血管反应。肺泡氯低氧引起局部缩血管反应,具有一定的生理意义。当一部分肺泡因通气不足而氧分压降低时,这些肺泡周围的血管收缩,血流减少,而使较多的血液流经通气充足,肺泡气氧分压高的肺泡。假如没有这种缩血管反应,血液流经通气不足的肺泡时,血液不能充分氧合,这部分含氧较低的血液回流入左心房,就会影响体循环血液的含氧量。当吸入气氧分压过低时,例如在高海拔地区,可引起肺循环动脉广泛收缩,血流阻力增大,故肺动脉压显著升高。长期居住在高海拔地区的人,常可因肺动脉高压使右心室负荷长期加重而导致右心室肥厚。
3.血管活性物质对肺血管的影响 肾上腺素、去甲肾上腺素、血管紧张素Ⅱ、血栓素A2、前列腺素F2α等能使肺循环的微动脉收缩。组胺、5-羟色胺能使肺循环静脉收缩,但在流经肺循环后即分解失活。
三、脑循环
脑组织的代谢水平高,血流量较多。在安静情况下,每百克脑的血流量为50-60ml/min。整个脑的血流量约为750ml/min。可见,脑的比重虽仅占体重的约2%,但血流量却占心输出量的15%左右。脑组织的耗氧量也较大。在安静情况下,每百克脑每分钟耗氧3-3.5ml;或者说,整个脑的耗氧量约占全身耗氧量的20%。
(一)脑循环的特点
脑位于颅腔内。颅腔是骨性的,其容积是固定的。颇腔内为脑、脑血管和脑脊液所充满,三者的容积的总和也是固定的。由于脑组织是不可压缩的,故脑血管舒缩程度受到相当的限制,血流量的变化较其它器官的为小。
脑循环的毛细血管壁内皮细胞相互接触紧密,并有一定的重叠,管壁上没有小孔。另外,毛细血管和神经元之间并不直接接触,而为神经胶质细胞怕隔开。这一结构特征对于物质在血液和脑组织之间的扩散起着屏障的作用,称为血-脑屏障(blood-brain barrier)。
(二)脑血流量的调节
1.脑血管的自身调节 脑血流量取决于脑的动、静脉的压力差和脑血管的血流阻力。在正常情况下,颈内静脉压接近于右心房压,且变化不大,故影响血流量的主要因素是颈动脉压。政党情况下脑循环的灌注压为10.6-13.3kPa(80-100mmHg)。平均动脉压降低或颅内压升高都可以使脑的灌注压降低。但当平均动脉压在8.0-18.6kPa(60-140mmHg)范围内变化时,脑血管可通过自身调节的机制使脑血流量保持恒定。平均动脉压降低到8.0kPa(60mmHg)以下时,脑血流量就会显着减少,引起脑的功能障碍。反之,当平均动脉压超过脑血管自身调节的上限时,脑血流量显著增加。
2.CO2和O2分压对及脑血流量的影响血液CO2分压升高时,脑血管舒张,血流量增加。CO2过多时,通过使细胞外液H+浓度升高而使脑血管舒张。过度通气时,CO2呼出过多,动脉血CO2分压过低,脑血流量减少,可引起头晕等症状。血液O2分压降低时,也能使脑血管舒张。
3.脑的代谢对脑血流的影响 脑的各部分的血流量与该部分脑组织的代谢活动程度有关。实验证明,在同一时间内脑的没部分的血流量是不同的,当脑的某一部分活动加强时,该部分的血流量就增多。例如在握拳时,对侧大脑皮层运动区的血流量就增加;阅读时脑的许多区域血流量增加,特别是皮层枕叶和颞叶与语言功能有关的部分血流量增加更为明显。代谢活动加强引起的局部脑血流量增加的机制,可能是通过代谢产物如H+离子、K+离子、腺苷,以及氧分子降低,引起脑血管舒张的。
4.神经调节 颈上神经节发出的去甲云彩上腺素后纤维,其末梢分布至脑的动脉和静脉,并分布至软脑膜的血管,还有少量分布至脑实质的血管。脑实质内的小血管有起自蓝斑去甲肾上腺素神经元的轴突末梢的分布。副交感乙酰胆碱能神经末梢也分布至脑血管。此外,脑血管政治家血管活性肠肽等神经肽纤维末梢分布。神经对脑血管活动的调节作用不很明显。刺激或切除支配脑血管的交感或副交感神经,脑血流量没有明显变化。在多种心血管反射中,脑血流量一般变化都很小。
(三)脑脊液的生成和吸收
脑脊液存在于脑室系统、脑周围的脑池和蛛网膜下腔内,可被视为脑和脊髓的组织液和淋巴。成年人的脑脊液总量约150ml。每天生成的脑脊液约800ml,为脑脊液总量的5-6倍。但同时有等量的脑脊液被吸收入血液,可见脑脊液的更新率较高。
脑脊液主要由侧脑室、第三脑室和第四脑室的脉络丛分泌。侧脑室内的脑脊液经室间孔流入第三脑室,再经过导水管进入第四脑室,然后进入蛛网膜下腔。除脉丛外,室管膜细胞也能分泌脑脊液。软脑膜血管和脑的毛细血管滤过的液体,一部分被重吸收,其余的则沿着血管周围间隙进入蛛网膜下腔,成为脑脊液的一部分。
脑脊液主要通过蛛网膜绒毛被吸收入静脉的血液内。蛛网膜绒毛有活瓣状的细微的管道,其直径为4-12μm。当蛛网膜下腔的压力高于静脉窦的压力时,这些管道就开放。这时,脑脊液(包括其中所含的蛋白质分子甚至小的颗粒如红细胞等)可进入静脉窦血液。当蛛网膜下深的压力低于静脉窦压力时,管道关闭,液体不能由静脉窦向蛛网膜下腔倒流。脑脊液压力的高低取决于其生成和吸收之间的平衡关系。正常人在到卧位时,脑脊液压平均为1.3kPa(10mmHg)。当脑脊液有吸收受到阻碍时,脑脊液压就会升高,并影响脑血流和脑的功能。
脑脊液的主要功能是在脑、脊髓和颇腔、椎管之间起缓冲的作用,有保护性意义。脑浸浴于脑脊液中,由于浮力的作用,使脑的重量减轻到仅50g左右。另外,脑脊液还作为脑和血液之间进行物质交换的中介。脑组织中没有淋巴管,由毛细血管漏出的少量蛋白质,主要经过血管周围间隙进入蛛肉膜下腔的脑脊液中,然后通过蛛网膜绒毛回入血液。
(四)血-脑脊液屏障和血-脑屏障
脑脊液主要是由脉络丛分泌的,但其成分和血浆不脑脊液中蛋白质的含量极微,葡萄糖含量也较血浆为少,但Na+ 和Mg2+的浓度较血浆中的高,K+、HCO3-和Ca2+的浓度则较血浆中的低。可见,血液和脑脊液之间物质的转运并不是被动的过程,而是主动转运过程。另外,一些大分子物质较难从血液进入脑脊液,仿佛在血液和脑脊液之间存在着某种特殊的屏障,故称之为血-脑脊液屏障(blood-cerebrospinal fluid barrier)。这种屏障对不同物质的通透性上不同的。例如O2、CO2等脂溶性物质可很容易地通过屏障,但许多离子的通透性则较低。血-脑脊液屏障的基础是无孔的毛细血管壁和脉?
■[此处缺少一些内容]■
的浓度较低,即使在实验中使血浆K+浓度加倍,脑脊液中K+浓度仍能保持在正常水平。因此脑内神经元的兴奋性不会因血浆中K+浓度的变化而发生明显的变化。由于血-脑屏障的存在,循环血液中的乙酰胆碱、去甲肾上腺素、多巴胺、甘氨酸等物质就不易进入脑,否则,血浆中这些物质浓度的改变将会明显地扰乱脑内神经元的政党功能活动。
需要指出,脑的某些部分,如下丘脑第三脑室周围和延髓后缘区等处的室周器官,血-脑屏障比较薄弱,毛细血管壁对许多物质的通透性高于脑的其它部分。因此循环血液中的有些物质,如血管紧张素Ⅱ和其它肽类物质,可以在这些部位进入脑内,作用于相应的受体,引起各种效应。另外,当脑组织发生缺氧、损伤等情况以及在脑肿瘤部位,毛细血管壁的通透性增加,故平时不易透过血-脑屏障的物质进入受损部位的脑组织。在临床上可以用同位素标记的白蛋白注入体内,这些蛋白质进入正常脑组织的速度很慢,但较易进入脑肿瘤组织,因此可用这种方法匀来检查脑瘤的部位。在用药物治疗神经系统疾病时,必须明确所用的药物是否容易通过血-脑屏障。
在脑室系统,脑脊液和脑组织之间为室管所分隔;在脑的表面,脑脊液和脑组织之间为软脑膜所分隔。室管膜和软脑膜的通透性很高,脑脊液中的物质很容易通过室管膜或软脑膜进入脑组织。因此,在临床上可将不易通过血-脑屏障的药物直接注入脑脊液,使之能较快地进入脑组织。
参考资料
1.徐丰彦,张镜如主编,人体生理学。北京:人民卫生出版社,1989
2.何瑞荣主编,心血管生理学 北京:人民卫生出版社,1987
3.骆鸿,何瑞荣,延髓腹外侧部对心血管活动的调节。生理科学进展1987;18:224-229
4.姚泰,中枢神经系统对血压的调节,生理科学进展,1989;20:276-283
5.韩济生主编,神经科学纲要,第47章,北京:北京医科大学、中国协和医科大学联合出版社,1983
6.Little RC.Physiology of the Heart andCirculation 3rd ed,Year Book Medical Publishers,In,Chica-go,1985
7.Fozzard HA etal.The Heart and Cardiovascular Systen-Scientific Foundations,Raven Press,NewYork,1986
8.Noble D.Thesurprising teart, a revieq of recent progress in cardiac electrophysiology. JPhysiol 1984;353:1-50
9.Reuter H.Ionchannels in cardiac cell menbrane.Ann Rev Physiol 1984;46:473-484
10.Irisawa H et al.Pacemaker currents in mammalian nodal cells .J Mol cell Cardiol 1984;16:777-781
11.WinegradS.Regulation of cardiac contractle proteins.Circ Res 1984;55:565-574
12.Siegl PKS.Overviewof cardiac inotropic mechanisms.J Cardiovasc Pharmacol 1986;8(suppl 9):S1-S10
13 .Carafoli EIntracellular calcium homeostasis.Ann Rev Biochem 1987;56:395-433
14.Brown JH etal.Phosphoinositide-generated second messengers in cardiac signaltransduction.Trends in Cardiovascular Medicine 1922;2:199-213
15.BallermannVJ,Zeidel ML,Gunning ME,Brenner BM,Vasoactive piptides and the kidney.in Kidney4th ed, Brenner BM, Rector Jr FC ed,Chapter 14,Wb SaundersCo,Philadelphia,1991
16.Cowley JrAW,Long-term control of arterial blood pressure.Physiol Rev 1992;72:231-300
17.Guyton AC.Textbookof Medical Physiology 8th ed,Wb Saunders Co,Philadelphia,1991
18.JohnsonLR.Essential Medical Physiology,Raven Press,New York,1992
19.Mione MC,RalevicV,Burnstock G.Peptdes and vasomotor mechanisms.Pharmac Ther 1990;46:429-468
20 Patton HD,FuchsAF,Hille B,Scher AM,Steiner R.Textbook of Physiology 21sted,WBSaunders Co,Philadelphia,1989