消化系统和呼吸系统有着相同的胚层来源,其大多数器官都由原始消化管分化而成。
人胚发育至第3周末,三胚层胚盘的周边向腹侧卷折,头端形成头褶,尾端形成尾褶,两侧形成侧褶,致使胚体由盘状变成柱状。内胚层与脏壁中胚层位居胚体内,形成一条纵行的管道,称原始消化管(primitive gut)。原始消化管的中份腹侧与卵黄囊通连,称中肠(midgut);原始消化管的头侧份的尾侧份分别称前肠(foregut)和后肠(hindgut)。前肠的头端膨大成原始咽,与口凹相对处被口咽膜封闭;后肠的尾端膨大成泄殖腔,其腹侧与肛凹相对处有泄殖腔膜封闭。口咽膜和泄殖腔膜分别于第4周和第8周破裂消失。致使原始消化管的头尾两端与外界相通。随着胚体和原肠的增长,卵黄囊相对变小,卵黄囊与中肠的连接部逐渐变细,形成卵黄蒂(vitelline stalk)(图22-1)。
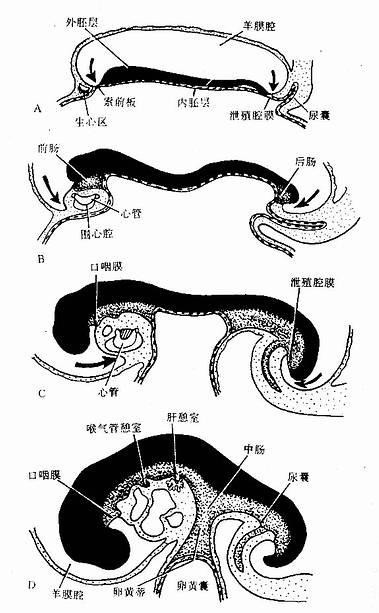
图22-1 原始消化管的形成和分段
A 18~19天胚 B 22天胚 C 25天胚 D28天胚
随着胚胎的发育,前肠分化成为咽、食管、胃和十二指肠的上段;还衍化出呼吸系统的原基。从十二指肠中段至横结肠的右2/3部,由中肠分化而成;从横结肠的左1/3至肛管上段,由后肠分化而来(图22-2)。
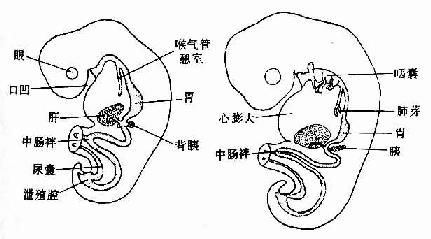
图22-2 原始消化管的早期演变
一、消化系统的发生
消化系统由消化管和消化腺组成,其上皮成分大部来自内胚层,其结缔组织和肌肉组织均由中有胚层分化而成。甲状腺、甲状旁腺、胸腺等器官虽然不属于消化系统,但其原基也来自原始消化管内胚层。舌的上皮也来自原始消化管内胚层。
(一)咽囊的演变
原始咽为前肠头端的一个膨大部,呈左右宽、背腹扁、头端粗、尾端细的漏斗状。在其侧有5对囊状突起,称咽囊,分别与其外侧的5对鳃沟相对,随着胚胎的发育,各对咽囊也先后发生重要的分化和演变。
第1对咽囊的外侧份膨大,形成中耳鼓室,其顶部的鳃膜分化为鼓膜,鼓膜外侧为第一鳃沟形成的外耳道。该咽囊的内侧份伸长,演化为咽鼓管(图22-3)。
第2对咽囊的外侧份退化,内侧份残留的浅窝演
■[此处缺少一些内容]■
第5对咽囊很小,形成一细胞团,称后鳃体(ultimobranchial body)。后鳃体的部分细胞迁入甲状腺原基,分化为甲状腺内的滤泡旁细胞。也有人认为,滤泡旁细胞来自神经嵴的外胚层细胞,并非来自后鳃体的内胚层细胞。
(二)甲状腺的发生
胚胎第4周初 ,在原始咽底壁正中线相当于第2、3对鳃弓的平面上,上皮细胞增生,形成一伸向尾侧的盲管,即甲状腺原基,称甲状舌管(thyroglossal duct)。此盲管沿颈部正中线下伸至未来气管前方,末端向两侧膨大,形成左右两个甲状腺侧叶(图22-3)。甲状舌管的上段退化消失,其起始段的开口仍残留一浅凹,称盲孔(foramen caecum)。如果甲状舌管的上段退化不全,残留部分可形成囊肿。胚胎第11周时,甲状腺原基中出现滤泡,第13周初甲状腺开始出现分泌活动。
(三)舌的发生
胚胎第4周末,左右两下颌隆起的内侧面细胞增生,形成3个隆起,头侧左右一对隆起较大,称侧舌隆起(lateral lingualswelling),尾侧一个隆起较小位居中线,称奇结节(tuberculum impar)。左右侧舌隆起迅速增大,并在中线愈合,形成舌体。奇结节生长缓慢,形成盲孔前方舌体的一部分。第2、3、4对鳃弓腹侧端之间的间充质增生,形成一凸向咽腔的隆起,称联合突(copula)。联合突的前部发育为舌根,后部发育为会厌。舌根与舌体的愈合线为一条“V”形界沟(图22-4)。故舌的表面上皮来自咽壁内胚层,舌内的结缔组织来自原始咽周围的间充质,舌肌则主要由头端体节的生肌节细胞迁移分化而成。
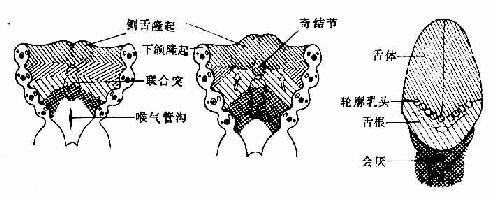
图22-4 舌的发生
(四)食管和胃的发生
食管由原始咽尾侧的一段原始消化管分化而来。胚胎第4周时,食管很短。随着颈的出现和心、肺的下降,食管也迅速增长,其表面上皮增生,由单层变为复层,致使管腔变窄,甚至闭锁。随着胚胎的发育,过度增生的上皮退化吸收,管腔重新出现,上皮仍保持为复层。上皮周围的间充质分化为食管壁的结缔组织和肌组织。
胚胎发育至第4周,在前肠尾端出现一前后略凸、左右稍扁的梭形膨大,这就是胃的原基。起初,胃原基紧靠原始横隔下方,其背系膜短,腹系膜长。之后,随着咽和食管的伸长,胃也向尾侧移动,其背侧缘生长迅速,形成胃大弯;腹侧缘生长缓慢,形成胃小弯。胃大弯的头端膨出,形成胃底。由于胃背系发育为突向左侧的网膜囊,致使胃大弯由背侧转向左侧,胃小弯由腹侧转向右侧,使胃沿胚体纵轴向右旋转90度。由于肝的增大,胃的头端被推向左侧;由于十二指肠的固定,胃的尾端被固定于腹后壁上。结果,胃由原来的垂直方位变成了由左上至右下的斜行方位(图22-5)。
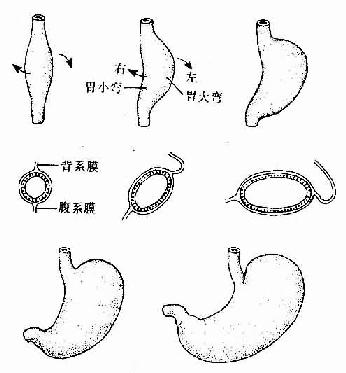
图22-5 胃的发生
(五)肠的发生
胚胎第4周时,随着胃原基的出现,肠管的端被确定,肠起初为一条与胚体长轴平行的直管,肠的头侧部(即十二指肠),由于其背系膜与腹后壁融合而被固定,其它部分的背系膜则随着肠管的生长而增长。肠的腹系膜很早即全部退化消失。由于肠的增长速度远比胚体快,致使肠管形成一凸向腹侧的“U”形弯曲,称中肠袢(midgut loop)(图22-6)。肠袢顶部与卵黄蒂通连,肠系膜上动脉走行于肠袢系膜的中轴部位。肠袢与卵黄蒂相连的头侧段为肠袢的头支,尾侧段为肠袢尾支。
胚胎第6周,肠袢生长迅速,腹腔容积相对变小,加之肝和中肾的增大,致使肠袢进入脐带内的胚外体腔(即脐腔,umbilical coelom),形成胚胎性的生理性脐疝。肠袢在脐腔中继续增长的同时,以肠系膜上动脉为轴心作逆时针方向旋转90度,致使肠袢由矢状方向转向水平方向,即头支从胚体头侧至吞侧,尾支从尾侧转至左侧,并出现一囊状突起,为盲肠始基。胚胎第10周时,由于中肾萎缩、肝生长减缓和腹腔的增大,肠袢开始从脐腔退回腹腔,脐腔随之闭锁。在肠袢退回腹腔时,头支在先,尾支在后,并且逆时针方向再旋转180度,使头支转至左侧,尾支转至右侧。肠袢通过增长、定向旋转和退腹腔,为建立正常的解剖方位和毗邻关系奠定了基础。在肠袢退回腹腔的初期。空肠和回肠位居腹腔中部;盲肠位置较高,在肝的下方;结肠前段横过十二指肠腹侧,后段被推向左侧,成为降结肠。之后,盲肠从肝下方下降至右髂窝,升结肠随之形成,盲肠始基的远侧份萎缩退化,形成阑尾。降结肠尾段移向中线。形成乙状结肠(图22-6)。
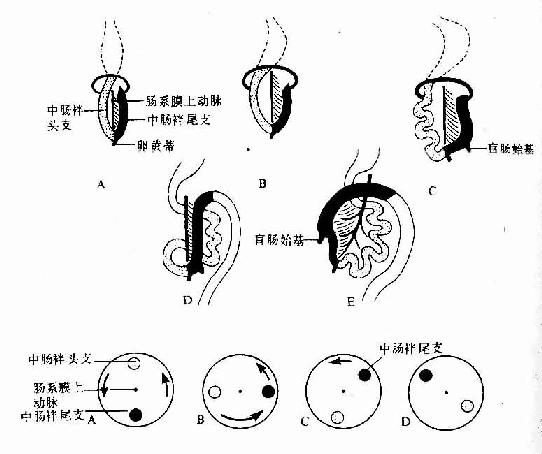
图22-6 肠的发生示中肠的旋转
直肠和肛管是泄殖腔分隔、分化的产物。泄殖腔(cloaca)是后肠末端的膨大部分,腹侧与尿囊相连,尾端由泄殖腔膜封闭。胚胎第6~7周,尿囊起始部分与后肠之间的间充质增生,形成一镰刀状隔膜突入泄殖腔内,称尿直肠隔(urorectal septum)。此隔迅速增长,并与泄殖腔膜相连,于是泄殖腔被分隔为背腹两份。腹侧份称尿生殖窦(urogenital sinus),主要分化为膀胱和尿道;背侧份为原始直肠,分化为直肠和肛管上段(图22-7)。泄殖腔膜也被分为背腹两分,腹侧份称尿生殖膜(urogenital membrane),背侧份称肛膜(anal membrane)。肛膜外周为一浅凹,称肛凹或原肛(proectoduem)。肛膜破裂吸收后,消化管尾端与外界相通,肛凹加深,并演变为肛管的下段。肛管上段的上皮来自内胚层,下段的上皮来自外胚层,两者之间的分界线称齿状线。尿生殖窦的分化详见第二十三章泌尿系统和生殖系统的发生。
图22-7 泄殖腔的分隔↑示尿直肠隔
(六)肝和胆的发生
胚胎发育至第4周初,前肠末端腹侧壁的上皮增生,形成一个向外突出的囊状突起,称肝憩室(hepatic diverticulum),是肝与胆的始基。肝憩室迅速增大,很快长入原始横隔,其末端膨大,并分为头、尾两支(图22-8)。头支较大且生长迅速,其上皮细胞增殖,形成许多细胞索并分支吻合,是为肝索。肝索上下叠加,形成肝板。肝板围绕中央静脉呈放射状排列,形成肝小叶。肝板最初由2~3层肝细胞组成,胎儿后期逐渐变为单层肝细胞。胚胎第2个月,肝细胞之间形成胆小管,内胚层上皮也相继形成肝内胆管。原始横隔中的间充质分化为肝内结缔组织和肝被膜。
胚胎肝的功能上分活跃。第3个月,肝细胞开始分泌胆汁,并开始生物转化等功能。第6周时,造血干细胞从卵黄囊壁迁入肝,并开始造血,主要产生红细胞。也可产生部分粒细胞和巨核细胞。第6个月后,肝内造血组织逐渐减少,出生前肝基本停止造血。应用分离的胎肝造血干细胞可治疗几种血液病。胎肝很早就开始合成和分泌白蛋白等多种血浆蛋白质,还合成大量甲胎蛋白(α-fetal protein, αFP)。第6个月前,几科所有的胎肝细胞都能合成甲胎蛋白,此后逐渐减少。出生后很快停止合成甲胎蛋白。
肝憩室的尾支发育为胆囊和胆囊管,肝憩室的根产则发育为总胆管。由于上皮的过度增生,胆囊管和总胆管的管腔曾一度消失。随着腔内上皮细胞的退化吸收,管腔重新出现。最初,总胆管开口于十二指肠的腹侧壁,随着十二指肠的转位及右侧壁的发育快于左侧壁,致使总胆管的开逐渐移至十二指肠的背内侧,并与胰腺导管合并共同开口于十二指肠(图22-8)
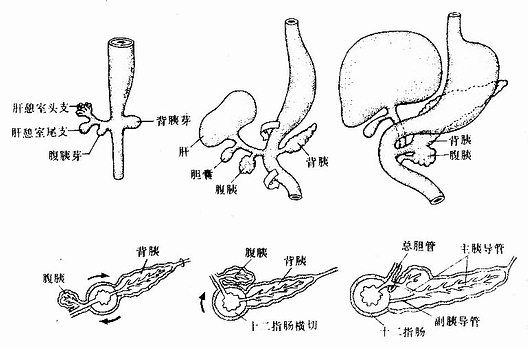
图22-8 肝、胆道及胰的发生
(七)胰腺的发生
胰腺来源于两个原基,即背胰芽(dorsalpancreatic bud)和腹胰芽(ventral pancreatic bud)。胚胎第4周末,在前肠末端腹侧靠近肝憩室的尾缘,内胚层上皮增生,形成腹胰芽。背胰芽由腹胰芽对侧的上皮增生而成,位置稍高,体积略大(图22-8)。背、腹两个胰芽的上皮细胞不断增生并反复分支,其末端形成腺泡,与腺泡相连的各级分支形成各级导管,于是由背、腹两个胰芽分化成了背胰(dorsal pancreas)和腹胰(ventral pancreas)。在背胰和腹胰的中轴线上均有一条贯穿腺体全长的总导管,分别称背胰管和腹胰管。由于胃和十二指肠方位的变化和肠壁的不均等生长,致使腹胰和腹胰管的开口转至背侧,并与背胰融合,形成一个单一的胰腺(图22-8)。腹胰构成胰头的下份,背胰构成胰头上份、胰体和胰尾。腹胰管与背胰管远侧段通连,形成胰腺的主胰导管,它与总胆管汇合后共同开口于十二指肠乳头。背胰管的近侧段或退化或形成副胰导管,开口于十二指肠副乳头。
在胰腺原基的分化过程中,上皮细胞索中的部分细胞脱离细胞索,形成孤立存在的细胞团,由此分化为胰岛,并于第5个月开始分泌胰岛素等。
(八)消化系统的常见畸形
1.甲状舌管囊肿连接舌与甲状腺的甲状舌管通常都会全部退化消失。如果未完全退化,残存部分便形成小的囊肿,并可随吞咽活动而上下移动,即称甲状舌管囊肿(thyroglossal cyst)。如果甲状舌管全部残存,便可在舌与甲状腺之间有一条细管相连。
2.消化管闭锁或狭窄在消化管的发生过程中,管壁上皮细胞在一定时期过度增生,致使消化管某部的管腔闭锁或狭窄。之后,过度增生的细胞发生程序性死亡,上皮变薄,狭窄或闭锁的管腔随之恢复正常。如果过度增生的上皮不发生程序性死亡,上皮不再变薄,就会形成消化管某段的闭锁或狭窄。常见于食管和十二指肠(图22-9)。
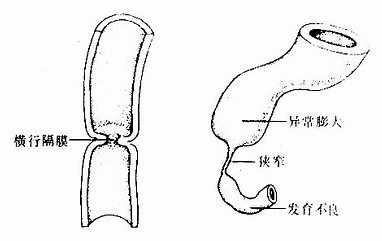
图22-9 消化管狭窄或闭锁
3.回肠憩室 又称麦克尔憩室(Meckels 'diverticulum),是距回盲部40~50cm处回肠壁上的一个小的囊状突起,有的在其顶端尚有一纤维索连于脐(图22-10)。这种畸形是由于卵黄蒂退化不全引起的。患者多无症状,但在感染时可出现腹痛等病症,偶尔可引起肠梗阻。
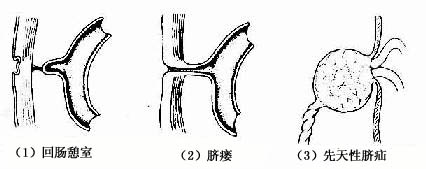
图22-10 肠管先天性畸形
(1)回肠憩室 (2)脐瘘 (3)先天性脐疝
4.脐瘘 脐瘘(umbilical fistula)是由于卵黄蒂未退化,以致在肠与脐之间残存一瘘管(图22-10)。当腹压增高时,粪便可通过瘘管从脐部溢出。
5.先天性脐疝 先天性脐疝(congenital umbilical hernia)是由于脐腔未能闭锁所致(图22-10)。在胎儿出生脐带剪断后,脐部仍留有一腔与腹腔相通。当腹内压增高时,肠管便从脐部膨出,甚至造成嵌顿疝。
6.先天性无神经节性巨结肠 先天性无神经节性巨结肠(congenitalaganglionical megacolon)又称Hirschsprung病,多见于乙状结肠。由于神经嵴细胞未能迁至该处肠壁中,致使壁内副交感神经节细胞缺如,肠壁收缩无力,肠腔内容物不能很好地排出,因而肠管扩大。
7.不通肛 肛门闭锁不通称不通肛(imperforate anus)。有时是由于肛膜未破所致,有时因肛凹未能与直肠末端相通引起,肛管上皮过度增生后未能再度吸收也可引起此种畸形。这种畸形常常伴有直肠阴道瘘或直肠尿道瘘(图22-11)。
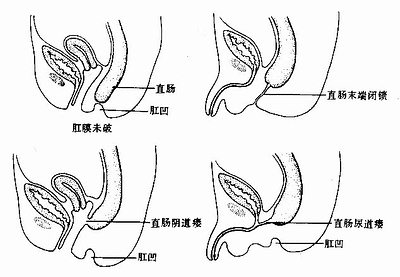
图22-11 不通肛
8.肠袢转位异常 当肠袢从脐腔退回腹腔时,应发生逆时针方向旋转180度。如果未发生旋转,或转位不全,或反向转位,就会形成各种各样的消化管异位,并且常常伴有肝、脾、胰、甚至心、肺的异位。
9.胆管闭锁 在肝、胆的发生中,肝内外形成连贯的胆汁排放管道。如果肝内胆管不通,称肝内胆管闭锁(intrahepatic biliary atresia);如果肝外胆管不通,称肝外胆管闭锁(extrahepatic biliary atresia)。由于胆汁不能排放,便出现先天性新生儿阻塞性黄疸。
10.环状胰 由于腹胰移位及背腹两胰融合过程的异常,形成一环形胰腺,环绕十二指肠。环状胰(anular pancreas)可压迫十二指肠和总胆管,甚至引起十二指肠梗阻。
消化系统除上述常见畸形外,还有一些少见或罕见畸形,如腹裂、双胆囊、无胆囊、肝下盲肠、肝下阑尾、肝囊肿等。
二、呼吸系统的发生
(一)喉、气管和肺的发生
除鼻腔上皮来自表面外胚层外,呼吸系统其他部分的上皮均由原始消化管内胚层分化而来。
胚胎第4周时,原始咽的尾端底壁正中出现一纵行浅沟,称喉气管沟(laryngotracheal groove)(图22-12)。此沟逐渐加深,并从其尾端开始愈合,愈合过程向头端推移,最后形成一个长形盲囊,称气管憩室(laryngotracheal diverticulum),是喉、气管、支气管和肺的原基(图22-12)。喉气管憩室位于食管的腹侧,两者之间的间充质隔称气管食管隔(tracheoesophageal septum)(图22-12)。
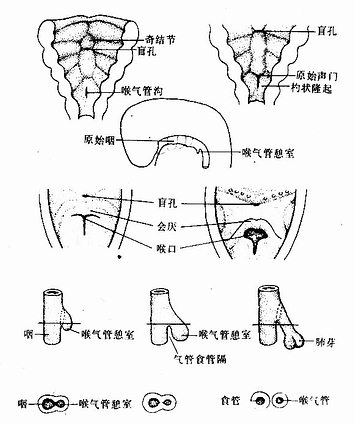
图22-12 喉气管憩室的发生和演化
喉气管憩室的上端开口于咽的部分发育为喉,其余部分发育为气管。憩室的末端膨大并分成左右两支,称肺芽(lung bud),是支气管和肺的原基。肺芽迅速生长并成树状分支。左肺芽分为两支,右肺芽分为三支,分别形成左肺和右肺的肺叶支气管。至第2个月末,肺叶支气管分支形成肺段支气管,左肺8~9支,右肺10支(图22-13)。第6个月时,分支达17级左右,最终出现了终末细支气管和有气体交换功能的呼吸细支气管、肺泡管和肺泡囊。至第7个月,肺泡数量增多,肺泡上皮除Ⅰ型细胞外,还出现了有分泌功能的Ⅱ型细胞,并开始分泌表面活性物质。此时,肺内血液循环完善,肺泡壁上有密集的毛细血管,故在此时早产的胎儿可进行正常的呼吸功能。喉气管憩室和肺芽周围的间充质分化为喉、气管和各级支气管壁的结缔组织、软骨和平滑肌,并分化为肺内间质中的结缔组织。
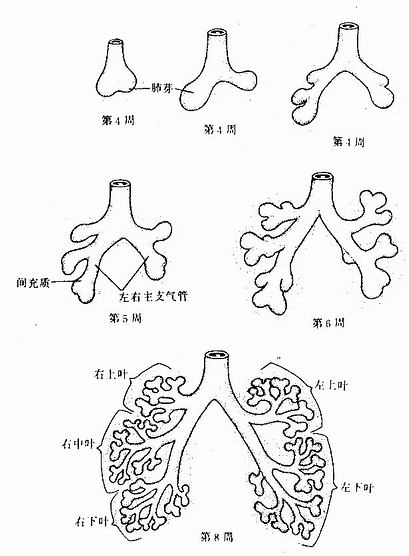
图22-13 肺的发生
早期的肺内间质较多,肺泡较少,至胎儿后期,间质逐渐减少,肺泡逐渐增多。出生后,随着呼吸的开始,空气进入肺泡,开始气体交换过程,Ⅱ型细胞分泌的表面性物质增多,降低了肺泡表面的表面张力,使肺泡得以适度的扩张和回缩。从新生儿至幼儿期,肺仍继续发育,肺泡的数量仍在不断增多。
(二)呼吸系统的常见畸形
1.喉气管狭窄或闭锁 在喉气管的发生过程中,上皮细胞一度增生过度,致使管腔闭锁或狭窄。之后,过度增生的上皮退变吸收,使管腔恢复通畅。如果过度增生的上皮不退变吸收,就会出现管腔狭窄,甚至闭锁。
2.气管食管瘘 由喉气管沟发育为喉气管憩室的过程中,如果气管食管隔发育不良,气管与食管的分隔不完全,两者间有瘘管相连,即称气管食管瘘(tracheoesophageal fistula)。在瘘管开口的上方或下方,常伴有不同形式的食管闭锁(图22-14)。
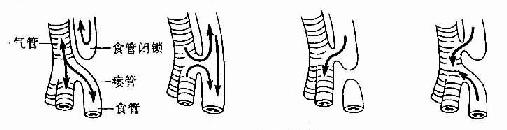
图22-14 气管食管瘘
3.透明膜病 由于肺泡Ⅱ型细胞分化不良,不能分泌表面活性物质,致使肺泡表面张力增大,胎儿出生后肺泡不能随呼吸运动而扩张。显微镜检查显示,肺泡萎陷,间质水肿,肺泡上皮表面覆盖一层血浆蛋白膜,称为透明膜病(hyaline membrane disease)
呼吸系统的先天畸形还有单侧肺不发生(unilateral pulmonary agenesis)、异位肺叶(ectopic lung lobe)、先天性肺肿囊肿(congenital pulmonary cyst)、肺膨胀不全(atelectasis)等。