肝脏在人体生命活动中占有十分重要作用。在消化、吸收、排泄、生物转化以及各类物质的代谢中均起着重要的作用,被誉为“物质代谢中枢”。
肝脏具有肝动脉和门静脉的双重血液供应,具有丰富的血窦,肝细胞膜通透性大,利于进行物质交换。从消化道吸收的营养物质经门静脉进入肝脏被改造利用,有害物质则可进行转化和解毒。肝脏可通过肝动脉获得充足的氧以保证肝内各种生化反应的正常进行。肝脏还通过胆道系统与肠道沟通,将肝脏分泌的胆汁排泄入肠道。
肝细胞亚微结构与其生理机能相适应。肝细胞内有大量的线粒体、内质网、微粒体及溶酶体等,适应肝脏活跃的生物氧化、蛋白质合成、生物转化等多种功能。
第一节 肝脏的化学组成特点
正常人肝脏重约1-1.5kg,其中水份占70%。除水外,蛋白质含量居首位。已知肝脏内的酶有数百种以上,而且有些酶是其它组织中所没有或含量极少的。例如合成酮体和尿素的酶系;催化芳香族氨基酸及含硫氨基酸代谢的酶类主要存在于肝脏中。
正常人肝脏化学组成见表11-1。肝脏成分常随营养及疾病的情况而改变。例如,饥饿多日后,肝中蛋白质及糖原含量下降,磷脂及甘油三酯的含量升高。肝内脂类含量增加时,水分含量下降。如患脂肪肝时,水分可降至50%-5%左右。
表11-1 正常人肝脏的化学组成(按新鲜组织重量百分率计算)
| 成分 |
百分率 |
成分 |
百分率 |
| 水 |
70 |
Na |
0.190 |
| 蛋白质* |
15 |
K |
0.215 |
| 糖质 |
5-10 |
Cl |
0.016 |
| 葡萄糖 |
0.1 |
Ca |
0.012 |
| 甘油三酯 |
2 |
Mg |
0.022 |
| 磷脂 |
2.5 |
Fe |
0.010 |
| 胆固醇 |
0.3 |
Zn |
0.006 |
|
|
Cu |
0.002 |
*其中86.6%为球蛋白,6.6%为白蛋白
此外,肝脏含铁蛋白较多,是机本贮存铁最多的器官。
第二节 肝脏在物质代谢中的作用
一、肝脏在糖代谢中的作用
肝脏是调节血糖浓度的主要器官。当饭后血糖浓度升高时,肝脏利用血糖合成糖原(肝糖原约占肝重的5%)。过多的糖则可在肝脏转变为脂肪以及加速磷酸戊糖循环等,从而降低血糖,维持血糖浓度的恒定。相反,当血糖浓度降低时,肝糖原分解及糖异生作用加强,生成葡萄糖送入血中,调节血糖浓度,使之不致过低。因此,严重肝病时,易出现空腹血糖降低,主要由于肝糖原贮存减少以及糖异生作用障碍的缘故。临床上,可通过耐量试验(主要是半乳糖耐量试验)及测定血中乳酸含量来观察肝脏糖原生成及糖异生是否正常。
肝脏和脂肪组织是人体内糖转变成脂肪的两个主要场所。肝脏内糖氧化分解主要不是供给肝脏能量,而是由糖转变为脂肪的重要途径。所合成脂肪不在肝内贮存,而是与肝细胞内磷脂、胆固醇及蛋白质等形成脂蛋白,并以脂蛋白形式送入血中,送到其它组织中利用或贮存。
肝脏也是糖异生的主要器官,可将甘油、乳糖及生糖氨基酸等转化为葡萄糖或糖原。在剧烈运动及饥饿时尤为显著,肝脏还能将果糖及半乳糖转化为葡萄糖,亦可作为血糖的补充来源。
糖在肝脏内的生理功能主要是保证肝细胞内核酸和蛋白质代谢,促进肝细胞的再生及肝功能的恢复。(1)通过磷酸戊糖循环生成磷酸戊糖,用于RNA的合成;(2)加强糖原生成作用,从而减弱糖异生作用,避免氨基酸的过多消耗,保证有足够的氨基酸用于合成蛋白质或其它含氮生理活性物质。
肝细胞中葡萄糖经磷酸戊糖通路,还为脂肪酸及胆固醇合成提供所必需的NADPH。通过糖醛酸代谢生成UDP?葡萄糖醛酸,参与肝脏生物转化作用。
二、肝脏在脂类代谢中的作用
肝脏在脂类的消化、吸收、分解、合成及运输等代谢过程中均起重要作用。
肝脏能分泌胆汁,其中的胆汁酸盐是胆固醇在肝脏的转化产物,能乳化脂类、可促进脂类的消化和吸收。
肝脏是氧化分解脂肪酸的主要场所,也是人体内生成酮体的主要场所。肝脏中活跃的β-氧化过程,释放出较多能量,以供肝脏自身需要。生成的酮体不能在肝脏氧化利用,而经血液运输到其它组织(心、肾、骨骼肌等)氧化利用,作为这些组织的良好的供能原料。
肝脏也是合成脂肪酸和脂肪的主要场所,还是人体中合成胆固醇最旺盛的器官。肝脏合成的胆固醇占全身合成胆固醇总量的80%以上,是血浆胆固醇的主要来源。此外,肝脏还合成并分泌卵磷脂?胆固醇酰基转移酶(LCAT),促使胆固醇酯化。当肝脏严重损伤时,不仅胆固醇合成减少,血浆胆固醇酯的降低往往出现更早和更明显。
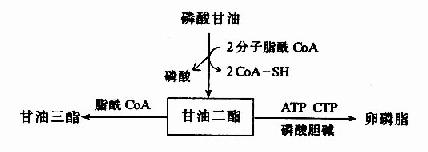
肝脏还是合成磷脂的重要器官。肝内磷脂的合成与甘油三酯的合成及转运有密切关系。磷脂合成障碍将会导致甘油三酯在肝内堆积,形成脂肪肝(fatty liver)。其原因一方面由于磷脂合成障碍,导致前β?脂蛋白合成障碍,使肝内脂肪不能顺利运出;另一方面是肝内脂肪合成增加。卵磷脂与脂肪生物合成有密切关系。卵磷脂合成过程的中间产物——甘油二酯有两条去路:即合成磷脂和合成脂肪,当磷脂合成障碍时,甘油二酯生成甘油三酯明显增多。
三、肝脏在蛋白质代谢中的作用
肝内蛋白质的代谢极为活跃,肝蛋白质的半寿期为10天,而肌肉蛋白质半寿期则为180天,可见肝内蛋白质的更新速度较快。肝脏除合成自身所需蛋白质外,还合成多种分泌蛋白质。如血浆蛋白中,除γ-珠蛋白外,白蛋白、凝血酶原、纤维蛋白原及血浆脂蛋白所含的多种载脂蛋白(ApoA,Apo B,C.E)等均在肝脏合成。故肝功能严重损害时,常出现水肿及血液凝固机能障碍。
肝脏合成白蛋白的能力很强。成人肝脏每日约合成12g白蛋白,占肝脏合成蛋白质总量的四分之一。白蛋白在肝内合成与其它分泌蛋白相似,首先以前身物形式合成,即前白蛋白原(preproalbumin),经剪切信号肽后转变为白蛋白原(proalturnin)。再进一步修饰加工,成为成熟的白蛋白(alturnin)。分子量69,000,由550个氨基酸残基组成。血浆白蛋白的半寿期为10天,由于血浆中含量多而分子量小,在维持血浆胶体渗透压中起着重要作用。
肝脏在血浆蛋白质分解代谢中亦起重要作用。肝细胞表面有特异性受体可识别某些血浆蛋白质(如铜兰蛋白、α1抗胰蛋白酶等),经胞饮作用吞入肝细胞,被溶酶体水解酶降解。而蛋白所含氨基酸可在肝脏进行转氨基、脱氨基及脱羧基等反应进一步分解。肝脏中有关氨基酸分解代谢的酶含量丰富,体内大部分氨基酸,除支链氨基酸在肌肉中分解外,其余氨基酸特别是芳香族氨基酸主要在肝脏分解。故严重肝病时,血浆中支链氨基酸与芳香族氨基酸的比值下降。
在蛋白质代谢中,肝脏还具有一个极为重要的功能:即将氨基酸代谢产生的有毒的氨通过鸟氨酸循环的特殊酶系合成尿素以解氨毒。鸟氨酸循环不仅解除氨的毒性,而且由于尿素合成中消耗了产生呼吸性H+的CO2,故在维持机体酸碱平衡中具有重要作用。
肝脏也是胺类物质解毒的重要器官,肠道细菌作用于氨基酸产生的芳香胺类等有毒物质,被吸收入血,主要在肝细胞中进行转化以减少其毒性。当肝功不全或门体侧支循环形成时,这些芳香胺可不经处理进入神经组织,进行β-羟化生成苯乙醇胺和β-羟酪胺。它们的结构类似于儿茶酚胺类神经递质,并能抑制后者的功能,属于“假神经递质”,与肝性脑病的发生有一定关系。
四、肝脏在维生素代谢中的作用
肝脏在维生素的贮存、吸收、运输、改造和利用等方面具有重要作用。肝脏是体内含维生素较多的器官。某些维生素,如维生素A、D、K、B2、PP、B6、B12等在体内主要贮存于肝脏,其中,肝脏中维生素A的含量占体内总量的95%。因此,维生素A缺乏形成夜盲症时,动物肝脏有较好疗效。
肝脏所分泌的胆汁酸盐可协助脂溶性维生素的吸收。所以肝胆系统疾患,可伴有维生素的吸收障碍。例如严重肝病时,维生素B1的磷酸化作用受影响,从而引起有关代谢的紊乱,由于维生素K及A的吸收、储存与代谢障碍而表现出血倾向及夜盲症。
肝脏直接参与多种维生素的代谢转化。如将β-胡罗卜素转变为维生素A,将维生素D3转变为25-(OH)D3。多种维生素在肝脏中,参与合成辅酶。例如将尼克酰胺(维生素PP)合成NAD+及NADP+;泛酸合成辅酶A;维生素B6合成磷酸吡哆醛;维生素B2合成FAD,以及维生素B1合成TPP等,对机体内的物质代谢起着重要作用。
五、肝脏在激素代谢中的作用
许多激素在发挥其调节作用后,主要在肝脏内被分解转化,从而降低或失去其活性。此过程称激素的灭活(inactivation)。灭活过程对于激素的作用具调节作用。
肝细胞膜有某些水溶性激素(如胰岛素、去甲肾上腺素)的受体。此类激素与受体结合而发挥调节作用,同时自身则通过肝细胞内吞作用进入细胞内。而游离态的脂溶性激素则通过扩散作用进入肝细胞。
一些激素(如雌激素、醛固酮)可在肝内与葡萄糖醛酸或活性硫酸等结合而灭活。垂体后叶分泌的抗利尿激素亦可在肝内被水解而“灭活”。因此肝病时由于对激素“灭活”功能降低,使体内雌激素、醛固酮、抗利尿激素等水平升高,则可出现男性乳房发育、肝掌、蜘蛛痣及水钠潴溜等现象。
许多蛋白质及多肽类激素也主要在肝脏内“灭活”。如胰岛素和甲状腺素的灭活。甲状腺素灭活包括脱碘、移去氨基等,其产物与葡萄糖醛酸结合。胰岛素灭活时,则包括胰岛素分子二硫键断裂,形成A、B链,再在胰岛素酶作用下水解。严重肝病时,此激素的灭活减弱,于是血中胰岛素含量增高。
第三节 肝脏的生物转化作用
一、肝脏生物转化的概述
生物转化的定义 机体将一些内源性或外源性非营养物质进行化学转变,增加其极性(或水溶性),使其易随胆汁或尿液排出,这种体内变化过程称为生物转化(biotransformation)。
日常生活中,许多非营养性物质由体内外进入肝脏。这些非营养物质椐其来源可分为:(1)内源性物质:系体内代谢中产生的各种生物活性物质如激素、神经递质等及有毒的代谢产物如氨、胆红素等。(2)外源性物质:系由外界进入体内的各种异物,如药品、食品添加剂、色素及其它化学物质等。这些非营养物质既不能作为构成组织细胞的原料,又不能供应能量,机体只能将它们直接排出体外,或先将它们进行代谢转变,一方面增加其极性或水溶性,使其易随尿或胆汁排出,另一方面也会改变其毒性或药物的作用。
一般情况下,非营养物质经生物转化后,其生物活性或毒性均降低甚至消失,所以曾将此种作用称为生理解毒(physiological detoxification)。但有些物质经肝脏生物转化后其毒性反而增强,许多致癌物质通过代谢转化才显示出致癌作用,如3,4-苯并芘的致癌。因而不能将肝脏的生物转化作用一概称为“解毒作用”。
肝脏是生物转化作用的主要器官,在肝细胞微粒体、胞液、线粒体等部位均存在有关生物转化的酶类。其它组织如肾、胃肠道、肺、皮肤及胎盘等也可进行一定的生物转化,但以肝脏最为重要,其生物转化功能最强。
二、生物转化反应类型
肝脏内的生物转化反应主要可分为氧化(oxidation)、还原(reduction)、水解(hydrolysis)与结合(conjugation)等四种反应类型。
(一)氧化反应
1.微粒体氧化酶系
微粒体氧化酶系在生物转化的氧化反应中占有重要的地位。它是需细胞色素P450的氧化酶系,能直接激活分子氧,使一个氧原子加到作用物分子上,故称加单氧酶系(monooxygenase)。由于在反应中一个氧原子掺入到底物中,而一个氧原子使NADPH氧化而生成水,即一种氧分子发挥了两种功能,故又称混合功能氧化酶(mixedfunction oxidase)。亦可称为羟化酶。加单氧酶系的特异性较差,可催化多种有机物质进行不同类型的氧化反应。
(1)加单氧酶系的组成
加单氧酶系由NADPH,NADPH?细胞色素P450还原酶及细胞色素P450组成。NADPH-细胞色素P450还原酶以FAD和FMN为辅基。二者比例为1:1。细胞色素P450是以铁卟啉原IX为辅基的b族细胞色素,含有与氧和作用物结合的部位。
(2)加单氧酶系反应过程
加单氧酶系催化总反应式如下:
NADPH+H++O2+RH→NADP++H2O+ROH
反应中作用物氧化生成羟化物。细胞色素P450含单个血红素辅基,只能接受一个电子,而NADPH是2个电子供体,NADPH-P450还原酶则既是2个电子受体又是1个电子的供体。正好沟通此电子传递链。作用物经加单氧酶系氧化的步骤见图11-2。
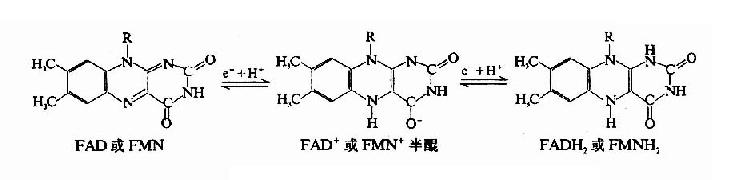
图11-1 氧化与还原型FAD与FMN
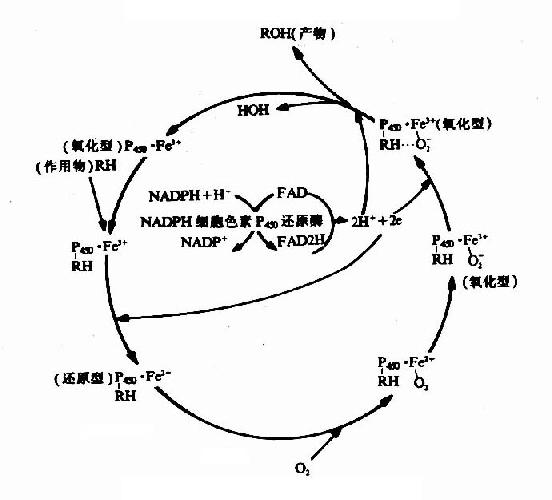
图11-2 加单氧酶系的反应过程
(3)加单氧酶系的生理意义及作用特点
加单氧酶系的生理意义是参与药物和毒物的转化。经羟化作用后可加强药物或毒物的水溶性有利于排泄。如甲苯为常用化工原料,在肝脏经加氧羟化生成对-甲酸,极性增强,易于排出体外。另外,维生素D3羟化为具有生物活性的25-(OH)D3。
加单氧酶系酶可诱导生成,如苯巴比妥类药物可诱导加单氧酶的合成,长期服用此类药物的病人,对异戊巴比妥,氨基比林等多种药物的转化及耐受能力亦同时增强。
2.线粒体单胺氧化酶系
胺氧化酶属于黄素酶类,存在于线粒体中,可催化组胺、酪胺、尸胺、腐胺等肠道腐败产物氧化脱胺,生成相应的醛类。例如:
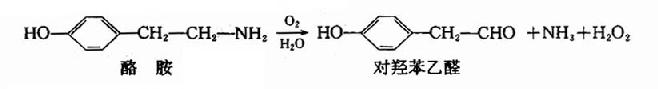
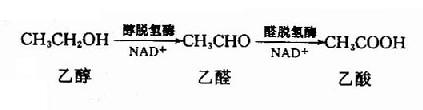
3.脱氢酶系
胞液中含有以NAD+为辅酶的醇脱氢酶与醛脱氢酶,分别催化醇或醛脱氢,氧化生成相应的醛或酸类。如:
(二)还原反应
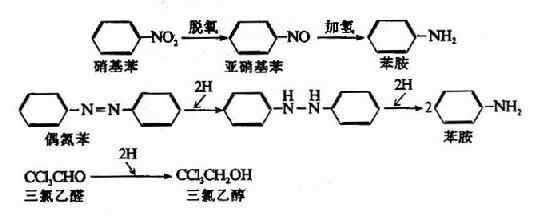
肝微粒体中存在着由NADPH及还原型细胞色素P450供氢的还原酶,主要有硝基还原酶类和偶氮还原酶类,均为黄素蛋白酶类。还原的产物为胺。如硝基苯在硝基还原酶催化下加氢还原生成苯胺,偶氮苯在偶氮还原酶催化下还原生成苯胺。此外,催眠药三氯乙醛也可在肝脏被还原生成三氯乙醇而失去催眠作用。
(三)水解反应
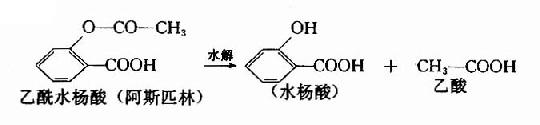
肝细胞中有各种水解酶。如酯酶、酰胺酶及糖苷酶等,分别水解各种酯键、酰胺键及糖苷键。分布广泛,人肝脏中水解酶类可催化乙酰苯胺、普鲁卡因、利多卡因及简单的脂肪族酯类的水解。如
(四)结合反应
结合反应是体内最重要的生物转化方式。凡含有羟基、羧基或氨基等功能基的非营养物质,在肝内与某种极性较强的物质结合,增加水溶性、同时也掩盖了作用物上原有的功能基团,一般具有解毒功能。某些非营养物质可直接进行结合反应,有些则先经氧化、还原、水解反应后再进行结合反应。结合反应可在肝细胞的微粒体、胞液和线粒体内进行。椐参加反应的结合剂不同可分为多种反应类型:
1.葡萄糖醛酸结合反应
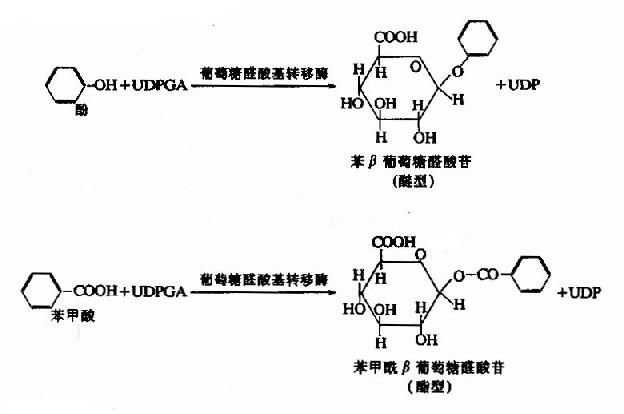
葡萄糖醛酸结合是最为重要和普遍的结合方式。尿苷二磷酸葡萄糖醛酸(UDPGA)为葡萄糖醛酸的活性供体,由糖醛酸循环产生。肝细胞微粒体中有UDP?葡萄糖醛酸转移酶,能将葡萄糖醛酸基转移到毒物或其他活性物质的羟基、氨基及羧基上,形成葡萄糖醛酸苷。结合后其毒性降低,且易排出体外。胆红素、类固醇激素、吗啡、苯巴比妥类药物等均可在肝脏与葡萄糖醛酸结合而进行生物转化。临床上,用葡萄糖醛酸类制剂(如肝泰乐)治疗肝病,其原理即增强肝脏的生物转化功能。
2.硫酸结合反应
以3′-磷酸腺苷5′-磷酸硫酸(PAPS)为活性硫酸供体,在肝细胞胞液中有硫酸转移酶,能催化将PAPS中的硫酸根转移到类固醇、酚类的羟基上,生成硫酸酯。雌酮在肝内与硫酸结合而失活。

3.乙酰基结合反应
在乙酰基转移酶的催化下,由乙酰CoA作乙酰基供体,与芳香族胺类化合物结合生成相应的乙酰化衍生物。如磺胺类药物及抗结核药异烟肼在肝脏经乙酰化而失去作用。
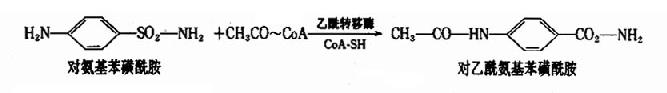
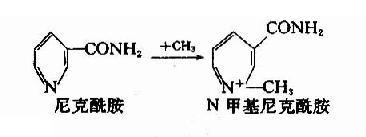
4.甲基结合反应
肝细胞液及微粒体中具有多种转甲基酶,含有羟基、巯基或氨基的化合物可进行甲基化反应,甲基供体是S?腺苷蛋氨酸(SAM)。例如,尼克酰胺可甲基化生成N甲基尼克酰胺。
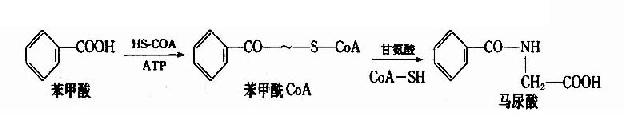
5.甘氨酸结合反应
某些毒物、药物的羧基与辅酶A结合形成酰基辅酶A后,在酰基CoA:氨基酸N-酰基转移酶催化下与甘氨酸结合,生成相应的结合产物。如马尿酸的生成。
由上可见,肝脏的生物转化作用范围是很广的。很多有毒的物质进入人体后迅速集中在肝脏进行解毒,这是一方面,然而另一方面,正是由于这些有害物质容易在肝脏聚集,如果毒物的量过多,也容易使肝脏本身中毒,因此,对肝病患者,要限制服用主要在肝内解毒的药物、以免中毒。
上面列举的一些生物转化反应包括药物、毒物或腐败产物,经转化后毒性或生物活性减弱。然而有些物质,通过生物转化、其活性或毒性反而加强,即不是灭活而是激活。如苯骈芘(致癌物)是在肝内经过生物转化才形成终致癌物的。
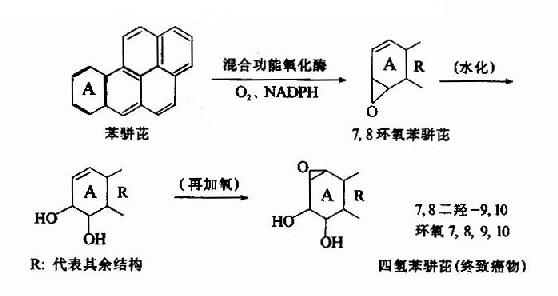
还有些致癌物在体内存在多种转化方式,有的属于致癌(活化),有的则属于解毒,例如黄曲霉素B1的生物转化。
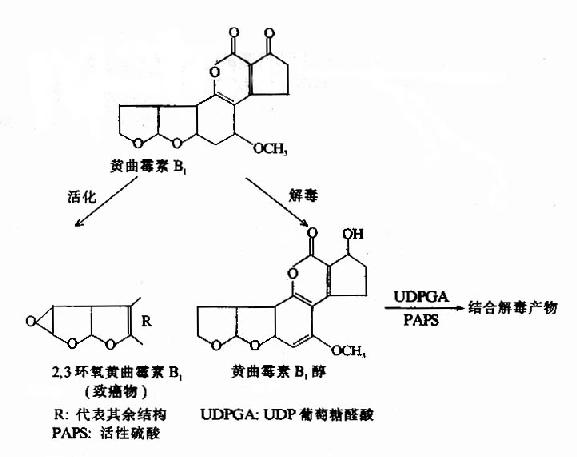
三、影响生物转化的因素
生物转化作用受年龄、性别、肝脏疾病及药物等体内外各种因素的影响。例如新生儿生物转化酶发育不全,对药物及毒物的转化能力不足,易发生药物及毒素中毒等。老年人因器官退化,对氨基比林、保泰松等的药物转化能力降低,用药后药效较强,副作用较大。此外,某些药物或毒物可诱导转化酶的合成,使肝脏的生物转化能力增强,称为药物代谢酶的诱导。例如,长期服用苯巴比妥,可诱导肝微粒体加单氧酶系的合成,从而使机体对苯巴比妥类催眠药产生耐药性。同时,由于加单氧酶特异性较差,可利用诱导作用增强药物代谢和解毒,如用苯巴比妥治疗地高辛中毒。苯巴比妥还可诱导肝微粒体UDP-葡萄糖醛酸转移酶的合成,故临床上用来治疗新生儿黄疸。另一方面由于多种物质在体内转化代谢常由同一酶系催化,同时服用多种药物时,可出现竞争同一酶系而相互抑制其生物转化作用。临床用药时应加以注意,如保泰松可抑制双香豆素的代谢,同时服用时双香豆素的抗凝作用加强,易发生出血现象。
肝实质性病变时,微粒体中加单氧酶系和UDP-葡萄糖醛酸转移酶活性显著降低,加上肝血流量的减少,病人对许多药物及毒物的摄取、转化发生障碍,易积蓄中毒,故在肝病患者用药要特别慎重。
第四节 胆汁酸代谢
肝细胞分泌的胆汁具有双重功能:一是作为消化液,促进脂类的消化和吸收,二是作为排泄液,将体内某些代谢产物(胆红素、胆固醇)及经肝生物转化的非营养物排入肠腔,随粪便排出体外。胆汁酸是胆汁的主要成分,具有重要生理功能。
一、胆汁酸的种类
正常人胆汁中的胆汁酸(bileacid)按结构可分为两大类:一类为游离型胆汁酸,包括胆酸(cholic acid)、脱氧胆酸(deoxycholic acid)、鹅脱氧胆酸(chenodeoxy cholicacid)和少量的石胆酸(litho chalic acid):另一类是上述游离胆汁酸与甘氨酸或牛磺酸结合的产物、称结合型胆汁酸。主要包括甘氨胆酸、甘氨鹅脱氧胆酸,牛磺胆酸及牛磺鹅脱氧胆酸等。一般结合型胆汁酸水溶性较游离型大,PK值降低,这种结合使胆汁酸盐更稳定,在酸或Ca2+存在时不易沉淀出来。
表11-2 正常人肝胆汁与胆囊胆汁的组成成分比较
|
肝胆汁 |
胆囊胆汁 |
|
%胆汁 |
%胆汁 |
| 水 |
97 |
86 |
| 总固体 |
3 |
14 |
| 胆汁酸盐 |
1.93 |
9.14 |
| 胆固醇 |
0.06 |
0.26 |
| 无机盐 |
0.84 |
0.65 |
| 粘蛋白和色素 |
0.53 |
2.98 |
从来源上分类可分为初级胆汁酸和次级胆汁酸。肝细胞内,以胆固醇为原料直接合成的胆汁酸称为初级胆汁酸,包括胆酸和鹅脱氧胆酸。初级胆汁酸在肠道中受细菌作用,进行7-α脱羟作用生成的胆汁酸,称为次级胆汁酸(secondary bile acid),包括脱氧胆酸和石胆酸。各种胆汁酸的结构如图11-3所示。
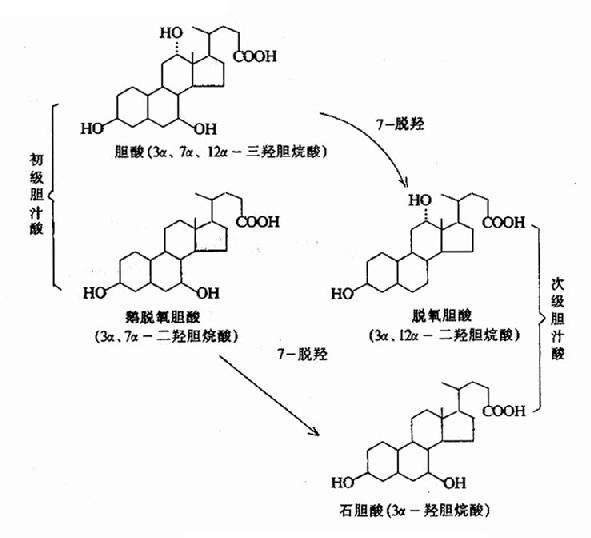
图11-3 各种游离胆汁酸的结构
胆酸和鹅脱氧胆酸都是含24个碳原子的胆烷酸衍生物。两者结构上的差别只是含羟基数不同,胆酸含有3个羟基(3α、7α、12α),而鹅脱氧胆酸含2个羟基(3α、7α)。次级胆汁酸脱氧胆酸和石胆酸结构特点是C-7位上无羟基。
二、初级胆汁酸的生成
胆汁酸由胆固醇转变而来,这也是胆固醇排泄的重要途径之一。肝细胞内由胆固醇转变为初级胆汁酸的过程很复杂,需经过多步酶促反应完成。归纳起来有以下几种变化:(图11-4,5,6)。
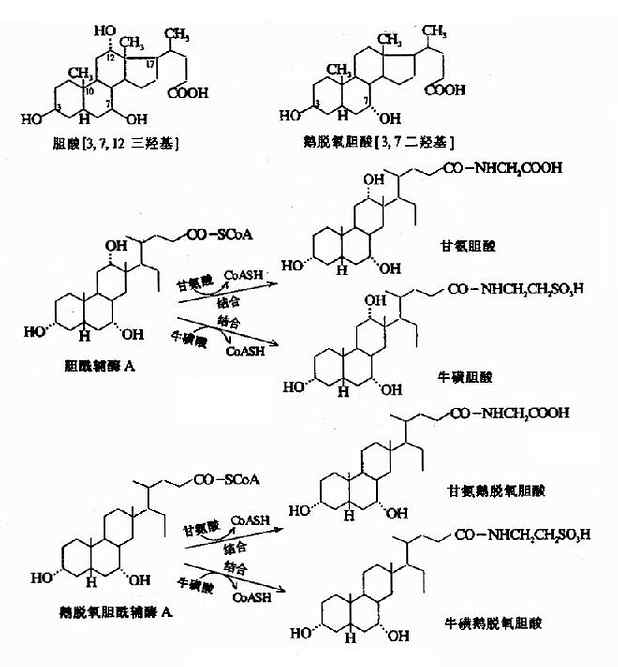
图11-4 结合型初级胆汁酸的生成
图11-5 两种结合胆汁酸的结构
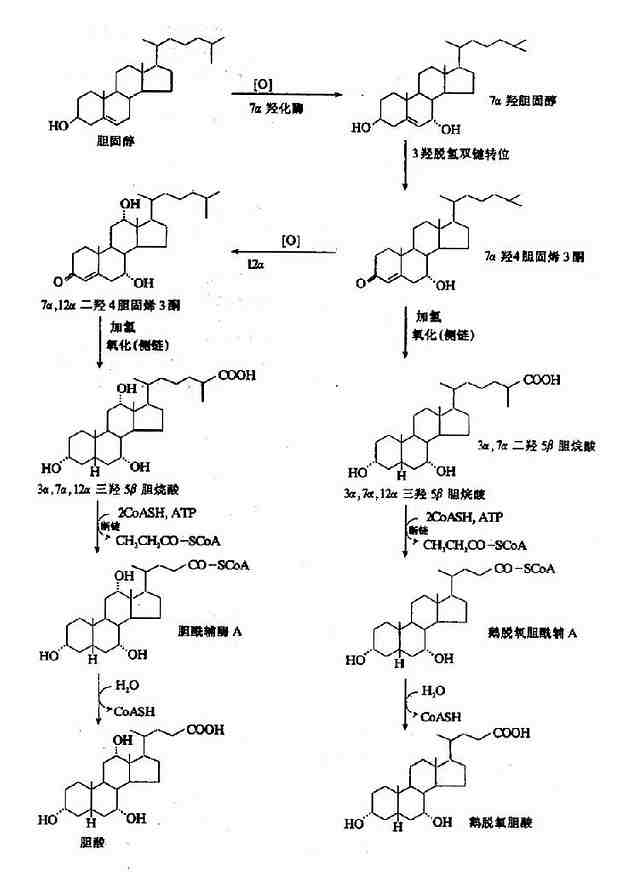
图11-6 游离型初级胆汁酸的生成
(1)羟化,是最主要的变化。首先在7α-羟化酶催化下,胆固醇转变为7α-羟胆固醇,然后再转变成鹅脱氧胆酸或胆酸,后者的生成还需要在12位上进行羟化。
(2)侧链氧化断裂生成含24个碳的胆烷酰CoA和一分子丙酰CoA(需ATP和辅酶A)。
(3)胆固醇的3-β-羟基差向异构化,转变为3-α-羟基。
(4)加水,水解下辅酶A分别形成胆酸与鹅脱氧胆酸。胆酰CoA和鹅脱氧胆酰CoA也可与甘氨酸或牛磺酸结合,生成结合型胆汁酸。
上述反应中,第一步(7α-羟化)是限速步骤,7α-羟化酶是限速酶。该酶属微粒体加单氧酶系,需细胞色素P450及NADPH、NADPH-细胞色素P450还原酶及一种磷脂参与反应。7α-羟化酶受终产物椀ㄖ?岬姆蠢∫种啤R虼巳舨捎媚承┐胧?如口服阴离子交换树脂消胆胺)减少肠道胆汁酸的重吸收,则可促进胆汁酸的生成,从而降低血清胆固醇。此外,维生素C对此羟化反应有促进作用。
甲状腺素能通过激活侧链氧化酶系,促进肝细胞初级胆汁酸的合成。所以甲状腺机能亢进病人的血清胆固醇浓度常偏低,而甲状腺机能低下病人血清胆固醇含量则偏高。
三、次级胆汁酸的生成及胆汁酸的肠肝循环
随胆汁流入肠腔的初级胆汁酸在协助脂类物质消化吸收的同时,在小肠下段及大肠受肠道细菌作用,一部分被水解、脱去7α?羟基,转变为次级胆汁酸。(图11-7)在合成次级胆汁酸的过程,可产生少量熊脱氧胆酸,它和鹅脱氧胆酸均具有溶解胆结石的作用。
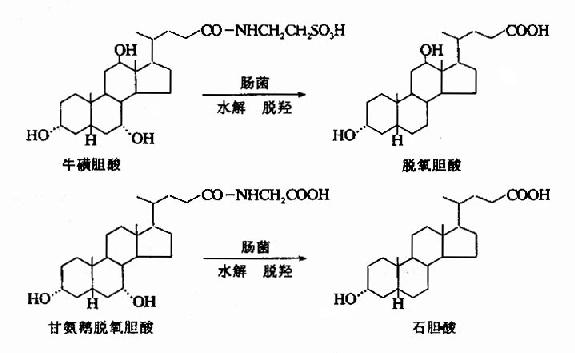
图11-7 次级胆汁酸的生成
肠道中的各种胆汁酸平均有95%被肠壁重吸收,其余的随粪便排出。胆汁酸的重吸收主要有两种方式:①结合型胆汁酸在回肠部位主动重吸收。②游离型胆汁酸在小肠各部及大肠被动重吸收。胆汁酸的重吸收主要依靠主动重吸收方式。石胆酸主要以游离型存在,故大部分不被吸收而排出。正常人每日从粪便排出的胆汁酸约0.4-0.6克。
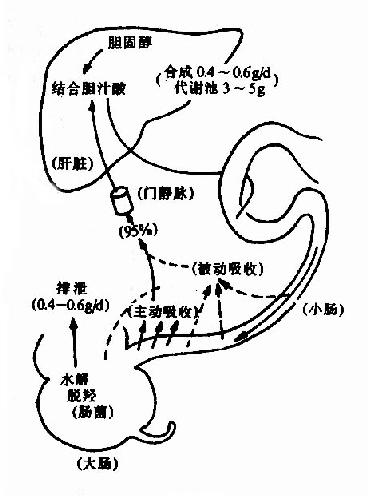
图11-8 胆汁酸的肠肝循环
由肠道重吸收的胆汁酸(包括初级和次级胆汁酸;结合型和游离型胆汁酸)均由门静脉进入肝脏,在肝脏中游离型胆汁酸再转变为结合型胆汁酸,再随胆汁排入肠腔。此过程称为“胆汁酸的肠肝循环”(enterohepatic circulation of bileacid),(图11-8)。
胆汁酸肠肝循环的生理意义在于使有限的胆汁酸重复利用,促进脂类的消化与吸收。正常人体肝脏内胆汁酸池不过3-5克,而维持脂类物质消化吸收,需要肝脏每天合成16-32克,依靠胆汁酸的肠肝循环可弥补胆汁酸的合成不足。每次饭后可以进行2-4次肠肝循环,使有限的胆汁酸池能够发挥最大限度的乳化作用,以维持脂类食物消化吸收的正常进行。若肠肝循环被破坏,如腹泻或回肠大部切除,则胆汁酸不能重复利用。此时,一方面影响脂类的消化吸收,另一方面胆汁中胆固醇含量相对增高,处于饱和状态,极易形成胆固醇结石。
四、胆汁酸的生理功能
胆汁酸分子内既含有亲水性的羟基及羧基或磺酸基,又含有疏水性烃核和甲基。亲水基团均为α型,而甲基为β型,两类不同性质的基团恰位于环戊烷多氢菲核的两侧,使胆汁酸构型上具有亲水和疏水的两个侧面(图11-9)。使胆汁酸具有较强的界面活性,能降低油水两相间的表面张力,促进脂类乳化。同时扩大脂肪和脂肪酶的接触面,加速脂类的消化。
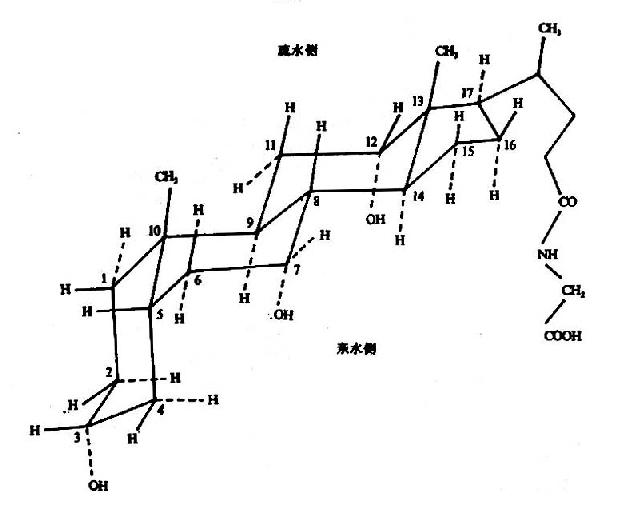
图11-9 甘氨胆酸的立体构型
胆汁酸还具有防止胆石生成的作用,胆固醇难溶于水,须掺入卵磷脂-胆汁酸盐微团中,使胆固醇通过胆固醇通过胆道运送到小肠而不致析出。胆汁中胆固醇的溶解度与胆汁酸盐,卵磷脂与胆固醇的相对比例有关。如胆汁酸及卵磷脂与胆固醇比值降低,则可使胆固醇过饱合而以结晶形式析出形成胆石。不同胆汁酸对结石形成的作用不同,鹅脱氧胆酸可使胆固醇结石溶解,而胆酸及脱氧胆酸则无此作用。临床常用鹅脱氧脱酸及熊脱氧胆酸治疗胆固醇结石。
第五节 胆色素代谢
胆色素(bilepigment)是含铁卟啉化合物在体内分解代谢的产物,包括胆红素(bilirubin)胆绿素(biliverdin)、胆素原(bilinogen)和胆素(bilin)等化合物。其中,除胆素原族化合物无色外,其余均有一定颜色,故统称胆色素。胆红素是胆汁中的主要色素,胆色素代谢以胆红素代谢为主心。肝脏在胆色素代谢中起着重要作用。
一、胆红素的生成及转运
(一)胆红素的来源
体内含卟啉的化合物有血红蛋白、肌红蛋白、过氧化物酶、过氧化氢酶及细胞色素等。成人每日约产生250?50mg胆红素,胆红素来源主要有:①80%左右胆红素来源于衰老红细胞中血红蛋白的分解。②小部分来自造血过程中红细胞的过早破坏。③非血红蛋白血红素的分解。
(二)胆红素的生成
体内红细胞不断更新,衰老的红细胞由于细胞膜的变化被网状内皮细胞识别并吞噬,在肝、脾及骨髓等网状内皮细胞中,血红蛋白被分解为珠蛋白和血红素。血红素在微粒体中血红素加氧酶(beme oxygenase)催化下,血红素原卟啉IX环上的α次甲基桥(=CH-)的碳原子两侧断裂,使原卟啉IX环打开,并释出CO和Fe3+和胆绿素IX(biliverdin)。Fe3+可被重新利用,CO可排出体外。线性四吡咯的胆绿素进一步在胞液中胆绿素还原酶(辅酶为NADPH)的催化下,迅速被还原为胆红素。(图11-10)。
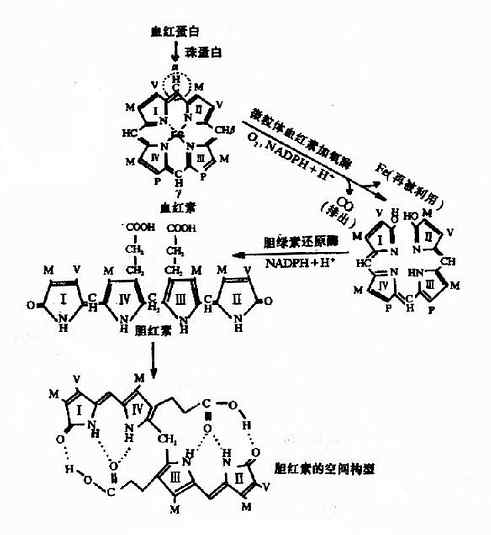
图11-10 胆红素的生成
血红素加氧酶是胆红素生成的限速酶,需要O2和NADPH参加,受底物血红素的诱导。而同时血红素又可作为酶的辅基起活化分子氧的作用。
用X线衍射分析胆红素的分子结构表明,胆红素分子内形成氢键而呈特定的卷曲结构分子中Ⅲ、Ⅳ两个吡咯环之间是单键连接。因此,Ⅲ环与Ⅳ环能自由旋转。在一定的空间位置,Ⅲ环上的丙酸基的羧基可与Ⅳ环,Ⅰ环上亚氨基的氢和Ⅰ环上的羰基形成氢键;Ⅳ环上的丙酸基的羧基也与Ⅱ环、Ⅲ环上亚氨基的氢和Ⅱ环上的羰基形成氢键。这6个氢键的形成使整个分子卷曲成稳定的构象。把极性基团封闭在分子内部,使胆红素显示亲脂、疏水的特性。
(三)胆红素在血液中的运输
在生理pH条件下胆红素是难溶于水的脂溶性物质,在网状内皮细胞中生成的胆红素能自由透过细胞膜进入血液,在血液中主要与血浆白蛋白或α1球蛋白(以白蛋白为主)结合成复合物进行运输。这种结合增加了胆红素在血浆中的溶解度,便于运输;同时又限制胆红素自由透过各种生物膜,使其不致对组织细胞产生毒性作用,每个白蛋白分子上有一个高亲和力结合部位和一个低亲和力结合部位。每分子白蛋白可结合两分子胆红素。在正常人每100ml血浆的血浆白蛋白能与20-25mg胆红素结合,而正常人血浆胆红素浓度仅为0.1-1.0mg/dl,所以正常情况下,血浆中的白蛋白足以结合全部胆红素。但某些有机阴离子如磺胺类、脂肪酸、胆汁酸、水杨酸等可与胆红素竞争与白蛋白结合,从而使胆红素游离出来,增加其透入细胞的可能性。过多的游离胆红素可与脑部基底核的脂类结合,并干扰脑的正常功能,称胆红素脑病或核黄疸。因此,在新生儿高胆红素血症时,对多种有机阴离子药物必需慎用。
二、胆红素在肝脏中的代谢
(一)肝细胞对胆红素的摄取
血中胆红素以“胆红素-白蛋白”的形式送输到肝脏,很快被肝细胞摄取。肝细胞摄细胞摄取血中胆红素的能力很强。实验证明,注射具有放射性的胆红素后,大约只需18分钟就可从血浆中清除50%。肝脏能迅速从血浆中摄取胆红素,是由于肝细胞内两种载体蛋白枣Y蛋白和Z蛋白所起的重要作用。这两种载体蛋白(以Y蛋白为主)能特异性结合包括胆红素在内的有机阴离子。当血液入肝,在狄氏(Disse)间隙中肝细胞上的特殊载体蛋白结合胆红素,使其从白蛋白分子上脱离,并被转运到肝细胞内。随即与细胞液中Y和Z蛋白结合,主是与Y蛋白结合,当Y蛋白结合饱合时,Z蛋白的结合才增多。这种结合使胆红素不能返流入血,从而使胆红素不断向肝细胞内透入。胆红素被载体蛋白结合后,即以“胆红素-Y蛋白”(胆红素-Z蛋白)形式送至内质网。这是一个耗能的过程,而且是可逆的。如果肝细胞处理胆红素的能力下降,或者生成胆红素过多,超过了肝细胞处理胆红素的能力,则已进入肝细胞的胆红素还可返流入血,使血中胆红素水平增高。?
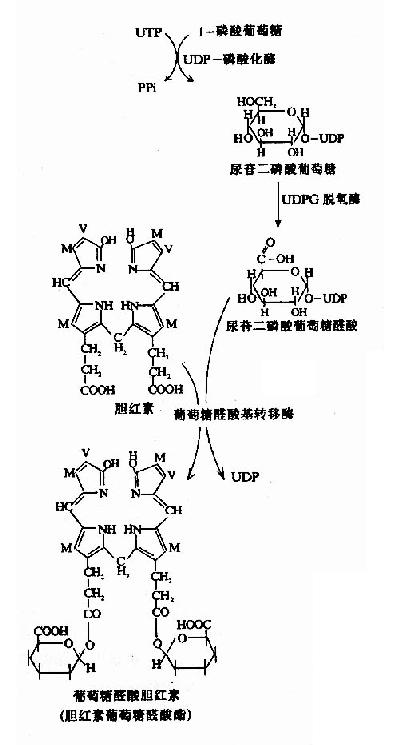
图11-11 葡萄糖醛酸胆红素的生成
Y蛋白是一种碱性蛋白,由分子量为22000和27.000的两个亚基组成,约占肝细胞胞液蛋白质总量的5%。它也是一种诱导蛋白,苯巴比妥可诱导Y蛋白的合成。甲状腺素、溴酚磺酸钠(BSP)和靛青绿(ICG)等可竞争结合Y蛋白,影响胆红素的转运。Y蛋白能与上述多种物质结合,故又称“配体结合蛋白”(ligadin)。由于新生儿在出生7周后Y蛋白才达到正常成人水平,故易产生生理性的新生儿非溶血性黄疸,临床上可用苯巴比妥治疗。
Z蛋白是一种酸性蛋白,分子量为12,000,与胆红素亲和力小于Y蛋白。当胆红素浓度较低时,胆红素优先与Y蛋白结合。在胆红素浓度高时,则Z蛋白与胆红素的结合量增加。
(二)肝细胞对胆红素的转化作用
肝细胞内质网中有胆红素-尿苷二磷酸葡萄糖醛酸转移酶(bilirutin-UDp glucuronyl transferase,BR-UDPGA-T),它可催化胆红素与葡萄糖醛酸以酯键结合,生成胆红素葡萄糖醛酸酯。由于胆红素分子中有两个丙酸基的羧基均可与葡萄糖醛酸C1上的羟基结合、故可形成两种结合物,即胆红素葡萄糖醛酸-酯和胆红素葡萄糖醛酸二酯(图11-11)。在人胆汁中的结合胆红素主要胆红素葡萄糖醛酸二酯(占70-80%),其次为为胆红素葡萄糖醛酸-(占20-30%),也有小部分与硫酸根、甲基、乙酰基、甘氨酸等结合。
胆红素经上述转化后称为结合胆红素,结合胆红素较未结合胆红素脂溶性弱而水溶性增强,与血浆白蛋白亲和力减小,故易从胆道排出,也易透过肾小球从尿排出。但不易通过细胞膜和血脑屏障,因此不易造成组织中毒,是胆红素解毒的重要方式。
(三)肝脏对胆红素的排泄作用
胆红素在内质网经结合转化后,在细胞浆内经过高尔基复合体、溶酶体等作用,运输并排入毛细胆管随胆汁排出。毛细胆管内结合胆红素的浓度远高于细胞内浓度,故胆红素由肝内排出是一个逆浓度梯度的耗能过程,也是肝脏处理胆红素的一个溥弱环节,容易受损。排泄过程如发生障碍,则结合胆红素可返流入血,使血中结合胆红素水平增高。
糖皮质激素不仅能诱导葡萄糖醛酸转移酶的生成,促进胆红素与萄萄糖醛酸结合,而且对结合胆红素的排出也有促进作用。因此,可用此类激素治疗高胆红素血症。
肝脏对胆红素的摄取、转化和排出可见图11-12。
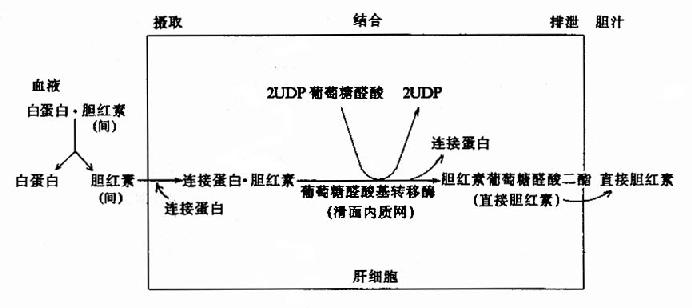
图11-12 肝细胞内胆红素代谢示意图
三、胆红素在肠道中的转变
结合胆红素随胆汁排入肠道后,自回肠下段至结肠,在肠道细菌作用下,由β-葡萄糖醛酸酶催化水解脱去葡萄糖醛酸,生成未结合胆红素,后者再逐步还原成为无色的胆素原族化合物,即中胆素原(meso-bilirutinogen)、粪胆素原(stercobilinogen)及尿胆素原(urobilinogen)。粪胆素原在肠道下段或随粪便排出后经空气氧化,可氧化为棕黄色的粪胆素,它是正常粪便中的主要色素(图11-13)。正常人每日从粪便排出的胆素原约40?80mg。当胆道完全梗阻时,因结合胆红素不能排入肠道,不能形成粪胆素原及粪胆素,粪便则呈灰白色。临床上称之为白陶土样便。
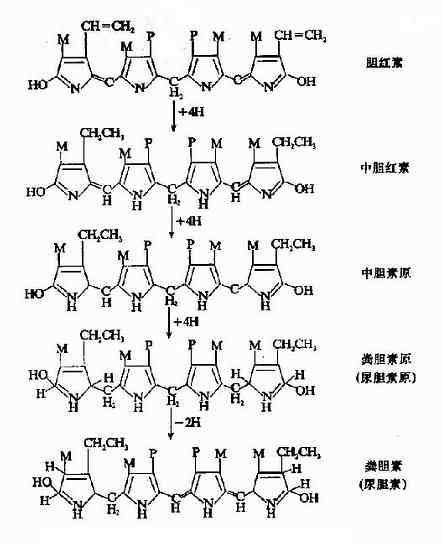
图11-13 胆红素在肠内的变化
生理情况下,肠道中约有10-0%的胆素原可被重吸收入血,经门静脉进入肝脏。其中大部分(约90%)由肝脏摄取并以原形经胆汁分泌排入肠腔。此过程称为胆色素的肠肝循环(entero?hepatic circulation of bile pigments)。在此过程中,少量(10%)胆素原可进入体循环,可通过肾小球滤出,由尿排出,即为尿胆素原。正常成人每天从尿排出的尿胆素原约0.5-4.0mg,尿胆素原在空气中被氧化成尿胆素,是尿液中的主要色素,尿胆素原、尿胆素及尿胆红素临床上称为尿三胆。
胆红素的生成及代谢可总结为图11-14。
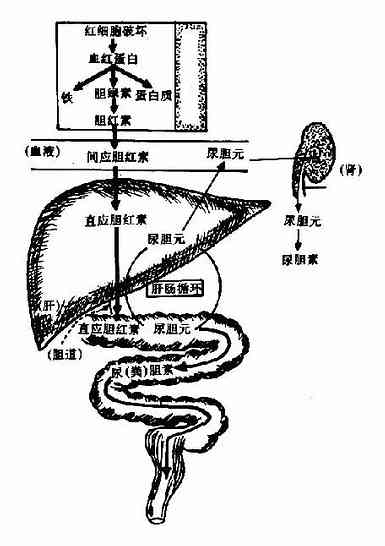
图11-14 正常胆红素的代谢
四、血清胆红素与黄疸
正常血清中存在的胆红素按其性质和结构不同可分为两大类型。凡未经肝细胞结合转化的胆红素,即其侧链上的丙酸基的羧基为自由羧基者,为未结合胆红素;凡经过肝细胞转化,与葡萄糖醛酸或其它物质结合者,均称为结合胆红素。
血清中的未结合胆红素与结合胆红素,由于其结构和性质不同,它们对重氮试剂的反应(范登堡试验Van den Bergh test)不同,未结合胆红素由于分子内氢键的形成,第10位碳桥被埋在分子的中心,这个部位是线性四吡咯结构的胆红素转变为二吡咯并与重氮试剂结合的关键部分。不破坏分子内氢键则胆红素不能与重氮试剂反应。必须先加入酒精或尿素破坏氢键后才能与重氮试剂反应生成紫红色偶氮化合物,称为范登堡试验的间接反应。所以未结合胆红素又称“间接反应胆红素”或“间应胆红素”。而结合胆红素不存在分子内氢键,能迅速直接与重氮试剂反应形成紫红色偶氮化合物,故又称“直接反应胆红素”或“直应胆红素”。
除上述两种胆红素外,现发现还存在着“第三种胆红素”,称为δ-胆红素。它的实质是与血清白蛋白紧密结合的结合胆红素。正常血清中它的含量占总胆红素的20-30%。它的出现可能与肝脏功能成熟有关。当肝病初期,它与血清中其它两种胆红素一起升高,但肝功能好转时它的下降较其它两种为缓慢,从而使其所占比例升高,有时可高达60%。
正常人血浆中胆红素的总量不超过1mg/dl,其中未结合型约占4/5,其余为结合胆红素。凡能引起胆红素的生成过多,或使肝细胞对胆红素处理能力下降的因素,均可使血中胆红素浓度增高,称高胆红素血症(hyperbilirubinemia)。胆红素是金黄色色素,当血清中浓度高时,则可扩散入组织,组织被染黄,称为黄疸(jaundice)。特别是巩膜或皮肤,因含有较多弹性蛋白,后者与胆红素有较强亲和力,故易被染黄。粘膜中含有能与胆红素结合的血浆白蛋白,因此也能被染黄。黄疸程度与血清胆红素的浓度密切相关。一般血清中胆红素浓度超过2mg/dl时,肉眼可见组织黄染;当血清胆红素达7~8mg/dl以上时,黄疸即较明显。有时血清胆红素浓度虽超过正常,但仍在2mg/dl以内,肉眼尚观察不到巩膜或皮肤黄染,称为隐性黄疸。应注意黄疸系一种常见体征,并非疾病名称。凡能引起胆红素代谢障碍的各种因素均可形成黄疸。根据其成因大致可分三类:①因红细胞大量破坏,网状内皮系统产生的胆红素过多,超过肝细胞的处理能力,因而引起血中未结合胆红素浓度异常增高者,称为溶血性黄疸或肝前性黄疸;②因肝细胞功能障碍,对胆红素的摄取结合及排泄能力下降所引起的高胆红素血症,称为肝细胞性或肝原性黄疸;③因胆红素排泄的通道受阻,使胆小管或毛细胆管压力增高而破裂,胆汁中胆红素返流入血而引起的黄疸,称梗阻性黄疸或肝后性黄疸。三种类型黄疸的血、尿、粪的改变情况总结如表11-3。
表11-3 黄疸时血、尿、粪的改变
|
指标 |
正常 |
阻塞性黄疸 |
溶血性黄疸 |
肝细胞性黄疸 |
| 血胆红素 |
总量 |
<1mg/dl |
>1mg/dl |
>1mg/dl |
>1mg/dl |
| 直接 |
0-0.8mg/dl |
↑↑ |
|
↑ |
| 间接 |
<1mg/dl |
|
↓↓ |
↑ |
|
尿色 |
正常 |
深 |
较深 |
深 |
| 尿三胆 |
尿胆红素 |
— |
++ |
— |
++ |
| 尿胆素原 |
少量 |
↓ |
↓ |
不一定 |
| 尿胆素 |
|
|
|
|
|
粪便颜色 |
正常 |
完全阻塞时陶土色 |
深 |
变浅或正常 |