第一节 药物的基本作用
第二节 药物剂量与效应关系
第三节 药物作用机制
第四节 药物与受体
一、药物作用与药理效应
药物作用(drug action)是指药物与机体细胞间的初始作用,是动因,是分子反应机制,有其特异性(specificity)。药理效应(pharmacological effect)是药物作用的结果,是机体反应的表现,对不同脏器有其选择性(selectivity)。因此,药理效应实际上是机体器官原有功能水平的改变,功能的提高称为兴奋(excitation)、亢进(augmentation),功能的降低称为抑制(inhibition)、麻痹(paralysis)。过度兴奋转入衰竭(failure),是另外一种性质的抑制。近年来生命科学的迅速发展,能引起细胞形态与功能发生质变的药物受到注意,例如某些物质可以引起细胞癌变,基因疗法能使机体引出遗传缺陷时或原来没有的特殊功能。药物作用特异性强的药物不一定引起选择性高的药理效应,二者不一定平行。例如阿托品特异性阻断M-胆碱受体,但药理效应选择性并不高,对心脏、血管、平滑肌、腺体及中枢神经功能都有影响,而且有的兴奋、有的抑制。作用特异性强及(或)效应选择性高的药物应用时针对性较好。反之,效应广泛的药物副反应较多。但广谱药物在多种病因或诊断未明时也有其方便之处,例如广谱抗生素、广谱抗心律失常药等。
药理效应与治疗效果,后者简称疗效(therapeutic effect)并非同义词,例如具有扩张冠脉效应的药物不一定都是抗冠心病药,抗冠心病药也不一定都会取得缓解心绞痛临床疗效,有时还会产生不良反应(adverse reaction),这就是药物效应的两重性:药物既能治病也能致病。
二、治疗效果
1.对因治疗(etiological treatment) 用药目的在于消除原发致病因子,彻底治愈疾病称为对因治疗,或称治本,例如抗生素消除体内致病菌。
2.对症治疗(symptomatic treatment) 用药目的在于改善症状称为对症治疗,或称治标。对症治疗未能根除病因,但在诊断未明或病因未明暂时无法根治的疾病却是必不可少的。在某些重危急症如休克、惊厥、心力衰竭、高热、剧痛时,对症治疗可能比对因治疗更为迫切。
三、不良反应
凡不符合用药目的并为病人带来不适或痛苦的反应统称为药物不良反应。多数不良反应是药物固有效应的延伸,在一般情况下是可以以预知的,但不一定是可以避免的。少数较严重的不良反应是较难恢复的,称为药原性疾病(drug induced disease),例如庆大霉素引起神经性耳聋,肼屈嗪引起红斑性狼疮等。
1.副反应(side reaction) 由于药理效应选择性低,涉及多个效应器官,当某一效应用作治疗目的时,其他效应就成为副反应(通常也称副作用)。例如阿托品用于解除胃肠痉挛时,将会引起口干、心悸、便秘等副反应。副反应是在常用剂量下发生的,一般不太严重,但是难以避免的。
2.毒性反应(toxic reaction) 毒性反应是指在剂量过大或蓄积过多时发生的危害性反应,一般比较严重,但是可以预知也是应该避免发生的不良反应。急性毒性多损害循环、呼吸及神经系统功能,慢性毒性多损害肝、肾、骨髓、内分泌等功能。致癌(carcinogenesis)、致畸胎(teratogenesis)、致突变(mutagenesis)三致反应也属于慢性毒性范畴。企图增加剂量或延长疗程以达到治疗目的是有限度的,过量用药是十分危险的。
3.后遗效应(residual effect) 后遗效应是指停药后血药浓度已降至阈浓度以下时残存的药理效应。例如长期应用肾上腺皮质激素停药后肾上腺皮质功能低下数月内难以恢复。
4.停药反应(withdrawal reaction) 突然停药后原有疾病的加剧,又称回跃反应(rebound reaction),例如长期服用可乐定降血压,停药次日血压将激烈回升。
5.变态反应(allergic reaction) 变态反应是一类免疫反应。非肽类药物作为半抗原与机体蛋白结合为抗原后,经过接触10天左右敏感化过程而发生的反应,也称过敏反应(hypersensitive reaction)。常见于过敏体质病人。临床表现各药不同,各人也不同。反应性质与药物原有效应无关,用药理拮抗药解救无效。反应严重度差异很大,与剂量也无关,从轻微的皮疹、发热至造系统抑制,肝肾功能损害、休克等。可能只有一种症状, 也可能多种症状同时出现。停药后反应逐渐消失,再用时可能再发。致敏物质可能是药物本身,可能是其代谢物,也可能是药剂中杂质。临床用药前常做皮肤过敏试验,但仍有少数假阳性或假阴性反应。可见这是一类非常复杂的药物反应。
6.特异质反应(idiosyncrasy) 少数特异体质病人对某些药物反应特别敏感,反应性质也可能与常人不同,但与药物固有药理作用基本一致,反应严重度与剂量成比例,药理拮抗药救治可能有效。这种反应是免疫反应,故不需预先敏化过程。现在知道这是一类药理遗传异常所致的反应,例如对骨骼肌松弛药司可林特异质反应是由于先天性血浆胆碱酯酶缺乏。
药理效应与剂量在一定范围内成比例,这就是剂量-效应关系(dose-effect rela-tion-ship)。由于药理效应与血药浓度的关系较为密切,故在药理学研究中更常用浓度-效应关系(concentration-effect relationship)。用效应强弱为纵座标、药物浓度为横座标作图得直方双曲线(rectangular hyperbola)。如将药物浓度改用对数值作图则呈典型的对称S型曲线,这就是通常所讲的量效曲线(图2-1)。药理效应强弱有的是连续增减的量变,称为量反应(graded response),例如血压的升降、平滑肌舒缩等,用具体数量或最大反应的百分率表示。有些药理效应只能用全或无,阳性或阴性表示称为质反应(all-or-none response或quantal response),如死亡与生存、抽搐与不抽搐等,必需用多个动物或多个实验标本以阳性率表示。用累加阳性率对数剂量(或浓度)作图也呈典型对称S型量效曲线(图2-2)。
从上述两种量效曲线可以看出下列几个特定位点:最小有效浓度(minimum effective concentration),即刚能引起效应的阈浓度(threshold concentration)。如果横座标用剂量表示,将“浓度”改为 “剂量”即可,下同。半数有效量(median effective dose)是能引起50%阳性反应(质反应)或50%最大效应(量反应)的浓度或剂量,分别用半数有效浓度(EC50)及半数有效剂量(ED50)表示。如果效应指标为中毒或死亡则可改用半数中毒浓度(TC50)、半数中毒剂量(TD50)或半数致死浓度(LC50)、半数致死剂量(LD50)表示。继续增加浓度或剂量而效应量不再继续上升时,这在量反应中称为最大效能(maximum efficacy),反映药物的内在活性。在质反应中阳性反应率达100%,再增加药量也不过如此。如果反应指标是死亡则此时的剂量称为最小致死量(minimum lethal dose)。药物效应强度(potency)是指能引起等效反应(一般采用50%效应量)的相对浓度或剂量,反映药物与受体的亲和力,其值越小则强度越大。药物的最大效能与效应强度含意完全不同,二者并不平行。例如利尿药以每日排钠量为效应指标进行比较氢氯噻嗪的效应强度大于呋塞米,而后者的最大效能大于前者(图2-3)。药物的最大效能值有较大实际意义,不区分最大效能与效应强度只讲某药较另药强若干倍是易被误解的。量效曲线中段斜率(slope)较陡的提示药效较激烈,较平坦的提示药效较温和。但在质反应曲线,斜率较陡的曲线还提示实验个体差异较小。曲线上的每个具体数据常用标准差(standard deviation)表示个体差异(individual variation)。
图2-1 药物作用的量效关系曲线
图2-2 质反应的频数分布曲线和累加量效曲线
频数分布曲线:100个人的有限剂量分布情况
(常态分布);累加量效曲线:频数分布曲线中每个长方形的累加曲线
图2-3 各种利尿药的作用强度及最大效能比较
TD50/ED50或TC50/EC50的比值称为治疗指数(therapeutic index),是药物的安全性指标。治疗指数为4的药物相对较治疗指数为2的药物安全。由于TD与ED两条量曲线的首尾可能重叠,即ED95可能大于TD5,就是说在没能获得充分疗效的剂量时可能已有少数病人中毒,因此不能认为治疗指数为4的药物是安全的。还由于该指标所指的药物效应及毒性反应性质不明确,这一安全指标并不可靠。在动物实验常用LD50/ED50作为治疗指数,性质相似。较好的药物安全性指标是ED95~TD5之间的距离,称为安全范围(margin of safety),其值越大越安全。药物的安全性与药物剂量(或浓度)有关,因此如果将ED与TD两条量效曲线同时画出并加以比较则比较具体(图2-4)。
图2-4 药物的安全性指标:治疗指数及安全范围
A药的治疗指数比B药大 A药与C药的治疗指数相等,但A药的安全范围较大 C药的治疗指数比B药大,而安全范围无区别
○有效量的量效关系 △中毒量的量效关系
●有效百分数减中毒百分数
关于药物剂量各国药典都制定了常用剂量范围,非药典药药厂在说明书上也有介绍。药典对于剧毒类药品还规定了极量(包括单剂量、一日量及疗程量),超限用药造成不良后果医生应负法律责任。
药物效应多种多样,是不同药物分子与机体不同靶细胞间相互作用的结果。药物作用的性质首先取决于药物的化学结构,包括基本骨架、活性基团、侧链长短及立体构形等因素。这些构效关系(structure-activity relationship)是药物化学研究的主要问题,但它有助于加强医生对药物作用的理解。药理效应是机体细胞原有功能水平的改变,从药理学角度来说,药物作用机制(mechanism of action)要从细胞功能方面去探索。
1.理化反应 抗酸药中和胃酸以治疗溃疡病,甘露醇在肾小管内提升渗透压而利尿等是分别通过简单的化学反应及物理作用而产生的药理效应。
2.参与或干扰细胞代谢 补充生命代谢物质以治疗相应缺乏症的药例很多,如铁盐补血、胰岛素治糖尿病等。有些药物化学结构与正常代谢物非常相似,掺入代谢过程却往往不能引起正常代谢的生理效果,实际上导致抑制或阻断代谢的后果,称为伪品掺入(counterfeit incorporation)也称抗代谢药(antimetabolite)。例如5-氟尿嘧啶结构与尿嘧啶相似,掺入癌细胞DNA及RNA中干扰蛋白合成而发挥抗癌作用。
3.影响生理物质转运 很多无机离子、代谢物、神经递质、激素在体内主动转运需要载体参与。干扰这一环节可以产生明显药理效应。例如利尿药抑制肾小管Na+-K+、Na+-H+交换而发挥排钠利尿作用。
4.对酶的影响 酶的品种很多,在体内分布极广,参与所有细胞生命活动,而且极易受各种因素的影响,是药物作用的一类主要对象。多数药物能抑制酶的活性,如新斯的明竞争性抑制胆碱酯酶,奥美拉唑不可逆性抑制胃粘膜H+-K+ATP酶(抑制胃酸分泌)。尿激酶激活血浆溶纤酶原,苯巴比妥诱导肝微粒体酶,解磷定能使遭受有机磷酸酯抑制的胆碱酯酶复活,而有些药本身就是酶,如胃蛋白酶。
5.作用于细胞膜的离子通道 细胞膜上无机离子通道控制Na+、Ca2+、K+、Cl-等离子跨膜转运,药物可以直接对其作用,而影响细胞功能。
6.影响核酸代谢 核酸(DNA及RNA)是控制蛋白质合成及细胞分裂的生命物质。许多抗癌药是通过干扰癌细胞DNA或RNA代谢过程而发挥疗效的。许多抗生素(包括喹诺酮类)也是作用于细菌核酸代谢而发挥抑菌或杀菌效应的,这将在有关章节详述。
7.影响免疫机制 除免疫血清及疫苗外,免疫增强药(如左旋咪唑)及免疫抑制药(如环孢霉素)通过影响免疫机制发挥疗效。某些免疫成份也可直接入药。第50章将有专题介绍。
8.非特异性作用 一些药物并无特异性作用机制,如消毒防腐药对蛋白质的变性作用,因此只能用于体外杀菌或防腐,不能内用。一些麻醉催眠药(包括乙醇)对于细胞膜脂质结构的扰乱,因此对各种细胞均有抑制作用,只是中枢神经系统较敏感罢了。还有一些药物作用在于改变细胞膜兴奋性,但不影响其静息电位。膜稳定药(membrane stabilizer)阻止动作电位的产生及传导,如局部麻醉药,某些抗心律失常药等,反之,称为膜易变药(membrane labilizer),如藜芦碱等,都是作用特异性低的药物。
9.受体(详见下节)。
受体(receptor)是细胞在进化过程中形成的细胞蛋白组分,能识别周围环境中某种微量化学物质,首先与之结合,并通过中介的信息转导与放大系统,触发随后的生理反应或药理效应。自从Langley 提出受体学说100年后,受体已被证实为客观存在的实体,类型繁多,作用机制多已被阐明,现在受体已不再是一个空泛笼统的概念。受体分子在细胞中含量极微,1mg 组织一般只含10fmol左右。能与受体特异性结合的物质称为配体(ligand)。受体仅是一个“感觉器”,对相应配体有极高的识别能力。受体-配体是生命活动中的一种偶合,受体都有其内源性配体,如神经递质、激素、自身活性物(autocoid)等。能激活受体的配体称为激动药(agonist),能阻断其活性的配体称为拮抗药(antagonist)。根据受体与配体结合的高度特异性,受体被分为若干亚型,如肾上腺素受体又分为α1、α2、β1和β2等亚型,其分布及功能都有区别。受体与配体有高度亲和力,多数配体在1pmol~1nmol/L的浓度时即可引起细胞的药理效应。反应之所以如此灵敏主要是靠后续的信息转导系统,如细胞内第二信使(second messenger)的放大、分化及整合功能。酶、载体、离子通道及核酸也可与药物直接作用,但这些物质本身具有效应力,故严格地说不应被认为是受体。某些细胞蛋白组分可与配体结合,但没有触发效应的能力,称为结合体 (acceptor)。
一、受体动力学
受体动力学一般用放射性同位素标记的配体(L)与受体(R)做结合试验研究。取一定量组织,磨成细胞匀浆,分组加入不同浓度的放射性同位素标记的配体(药物),温孵待反应达平衡后,迅速过滤或离心分出细胞,用缓冲液洗去尚未结合的放射性配体,测定标本的放射强度,这是药物与细胞结合的总量,此后用过量冷配体(未用同位素标记的配体)洗脱特异性与受体结合的放射性配体再测放射强度,这是药物非特性结合量。将总结合量减去非特性结合量就可以获得L-R结合(B)曲线。如果L只与单一R可逆性结合,以B为纵座标,[L]为横座标,L-R结合曲线为直方双曲线(图2-5)。如将横座标改用log[L]([]表示摩尔浓度)则呈典型的S形量效曲线。
按质量作用定律
 (E代表效应)
(E代表效应)
反应达到平衡时
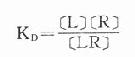 (KD是解离常数)
(KD是解离常数)
因为[RT]=[R]+[LR](RT为受体总量),代入上式并经推导得
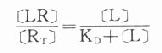
由于只有LR才发挥效应,故效应的相对强弱与LR相对结合量成比例,即
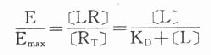
按此公式以E为纵座标,log[L]为横座标作图,结果与实验数据图形完全一致。
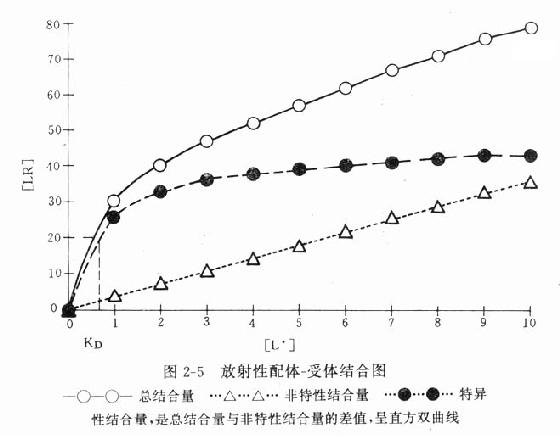
当[L]=0时,效应为0,
当[L]>>KD时,[LR]/[RT]=100%,达最大效能,即[LR]max=[RT]。
当[LR]/[RT]=50%时,即EC50时,KD=[L]。
KD表示L与R的亲和力(affinity),单位为摩尔。各药(L)与R亲和力不同,KD越大时亲和力越小,二者成反比。令pD2=-logKD则其值不必用摩尔单位、数值变小且与亲和力成正比,在半对数座标上也较易理解,故pD2较为常用。
药物与受体结合产生效应不仅要有亲和力,还要有内在活性(intrinsic activity),后者用α表示,0≤α≤100%。故上述公式应加入这一参数:E/Emax= α[LR]/[RT]。两药亲和力相等时其效应强度取决于内在活性强弱,当内在活性相等时则取决于亲和力大小(图2-6)。
将上述受体动力学基本公式([LR]/[RT]=[L]/KD+[L])加以推导改变可将S形量效曲线改变为直线关系,使计算方便很多也准确很多:
1.双倒数图 将上述基本公式两侧取倒数后加以推导得1/[LR]=KD/[L][RT]+1/[RT]。以1/[LR]为纵座标、1/[L]为横座标作图得直线(图2-7),斜率为KD[RT],即KD/Emax,与纵座标交点为1/[RT],即1/Emax ,与横座标交点为-1/KD。
2.Scatchard图 推导得公式[LR]/[L]=[RT]/KD-[LR]/KD以[LR]/[L],为纵座标,[LR]为横座标作图也呈直线(图2-8),斜率为-1/[KD] ,与纵座标交点为[RT]/KD,与横座标交点为[RT]。
这些直线关系图解在受体研究中有重要用途,也可加深对受体动力学的理解
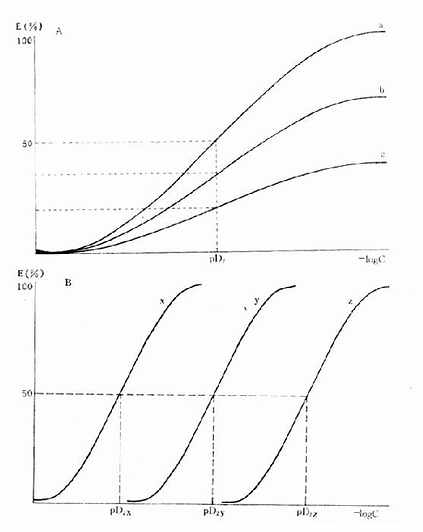
图2-6 药物与受体的亲和力及其内在活性对量效曲线的影响
A图 a,b,c三药与受体的亲和力(pD2)相等,但内在活性(Emax)不等
B图 a,b,c 三药与受体的亲和力(pD2)不等,但内在活性(Emax)相等
图2-7 受体结合量效关系的双倒数作图
图2-8 受体结合量效关系的Scatchard作图
一些活性高的药物与相应受体结合的量效曲线 (B-log[L]曲线)并不一定与结合后产生效应的量效曲线(E-log[L]曲线)相重合。因为这类药物只需与一部分受体结合就能发挥最大效应(Emax),剩余下未结合的受体为储备受体(spare receptor)。这对理解拮抗药作用机制有重要意义,因为这类拮抗药必须在完全占领储备受体后才能发挥其拮抗效应。
受体激动药(L)对相应受体有较强的亲和力,也有较强的内在活性,α达100%。受体拮抗药(I)虽然也有较强的亲和力,但缺乏内在活性,α=0,本身不能引起效应,却占据一定量受体,拮抗激动药的作用。竞争性拮抗药(competitive antagonist)能与激动药互相竞争与受体结合,这种结合是可逆性的。在实验中如果L与I同时存在则[RT]=[R]+[LR]+[IR],代入上述基本公式并加推导得
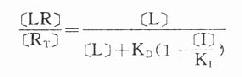
可见L和I同时存在时,如L这一因素固定不变,药理效应大小取决于[I]/K1(K1是I的解离常数)。[I]越高及(或)K1越小时效应越弱,即拮抗效果越强。当[L]>>[I]时,[LR]/[RT]→100%,这就是竞争性拮抗药使量效曲线平行右移(Emax不变)的理论解释(图2-9)。
在有一定量的竞争性拮抗药[I]存在时,增加[L]至[L’]仍可使药理效应维持在原来单用[L]时的水平。据此,
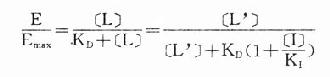
将之推导得
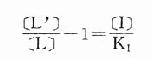
[L’]/[L]是剂量比 (dose ratio),即将[L]增加[L’]/[L]倍就能克服[I]的拮抗作用。该比值也取决于[I]/K1而与[L]绝对值或KD无关。将此公式两侧取log,并以log([L’]/[L]-1)为纵座标、以-log[I]为横座标作图,呈直线,斜率为1,与横座标交点为-logK1,即pA2此即Schild 图(图2-10)。按Schild定义,拮抗参数pAx是指剂量比为X时竞争性拮抗药浓度的负对数值。常用pA2,即 [L’]/[L]=2时的数值,则pA2=-log[I]=-logK1,些参数反映拮抗药的拮抗强度,其值越大表示拮抗作用越强。
图2-9 竞争性拮抗药(A图)、非竞争性拮抗药(B图)及部分
激动药(D图)对激动药(虚线)量效的影响及激动药(C图)
对部分激动药(虚线)量效曲线的影响
图2-10 竞争性拮抗作用的Schild作图
非竞争性拮抗药(noncompetitive antagonist)与R结合非常牢固,分解很慢或是不可逆转,使能与L结合的R数量减少。另一类非竞争性拮抗药可阻断受体后某一中介反应环节而使受体-效应功能容量减少。二者共同特点是使量效曲线高度(Emax)下降。但L与剩余的R结合动力学不变,即KD不变。在双倒数图中更易看出这一关系(图2-11)。
图2-11 竞争性拮抗作用与非竞争性拮抗作用比较
A图 量效曲线 B图 双倒数曲线
X 单用激动药 Y 竞争性拮抗药对激动药的拮抗作用
Z 非竞争性拮抗药对激动药的拮抗作用
还有一类药物称为部分激动药(partial agonist)和R结合的亲和力不小,但内在活性有限,α<100%,量效曲线高度(Emax)较低。与激动药同时存在时,当其浓度尚未达到Emax时,其效应与激动药协同,超过此限时则因与激动药竞争R而呈拮抗关系,此时激动药必需增大浓度方可达到其最大效能。可见部分激动药具有激动药与拮抗药两重特性。(图2-9C、D)
目前放射性配体-受体结合技术已普遍用于受体研究,但必需和药理效应实验结合进行才有意义。
为什么化学结构类似的药物作用于同一受体有的是激动药,有的是拮抗药,还有的是部分拮抗药?还可用二态模型(two-state model) 学说解释。按此学说,受体蛋白有两种可以互变的构型状态:静息状态(R)与活动状态(R*)(图2-12)。静息时平衡趋向R。活动药只与R*有较大亲和力,L-R*结合后充分发挥药理效应。部分激动药(P)与R及R*都能结合但对R*的亲和力大于对R的亲和力,故只有部分受体被激活而发挥较小的药理效应。拮抗药对R及R*亲和力相等,且能牢固结合,但保持静息状态时两种受体状态平衡,拮抗药不能激活受体但能阻断激动药作用。个别药物(如苯二氮类)对R亲和力大于R*,结合后引起与激动药相反的效应,称为超拮抗药(superantagonist)。这一学说容易理解,但有待进一步实验证实。
二、受体类型
根据受体蛋白结构、信息传导过程、效应性质、受体位置等特点,受体大致可分为下列4类:
1. 含离子通道的受体 又称直接配体门控通道型受体,它们存在于快速反应细胞的膜上,由单一肽链反复4次穿透细胞膜形成1个亚单位,并由4~5个亚单位组成穿透细胞膜的离子通道,受体激动时离子通道开放使细胞膜去极化或超极化,引起兴奋或抑制效应。最早发现的N型乙酰胆碱受体就是由α×2、β、γ、δ5个亚单位组成的钠离子通道,在α亚单位上各有一个乙酰胆碱结合点(图2-13A)与乙酰胆碱结合后,钠离子通道开放,胞外钠离子内流、细胞膜去极化、肌肉收缩。这一过程在若干毫秒内完成(钠离子通道开放时间仅1ms)。脑中γ氨基丁酸(GABA)受体情况类似,其他如甘氨酸、谷氨酸、天门冬氨酸受体都属于这一类型。
2.G-蛋白偶联受体 这一类受体最多,数十种神经递质及激素的受体需要G-蛋白介导其细胞作用,例如肾上腺素、多巴胺、5-羟色胺、M-乙酰胆碱、阿片类、嘌呤类、前列腺素及一些多肽激素等的受体,这些受体结构非常相似,都为单一肽链形成7个α-螺旋来回穿透细胞膜,N-端在细胞外,C-端在细胞内,这两段肽链氨基酸组成在各种受体差异很大,与其识别配体及转导信息各不相同有关。胞内部分有G-蛋白结合区(图2-13B)。G-蛋白(G-protein)是鸟苷酸结合调节蛋白的简称,存在于细胞膜内侧,由三个亚单位组成。主要有两类,其一为兴奋性G-蛋白(GS),霍乱弧菌毒素能使之活化,激活腺苷酸环化酶(AC);另一为抑制性G-蛋白(Gi),抑制AC,百日咳杆菌素抑制之。G-蛋白还介导心钠素及NO对鸟苷酸环化酶(GC)的激活作用。此外G-蛋白对磷脂酶C、磷脂酶A2、Ca2+、K+离子通道等有重要调节作用。一个受体可激活多个G-蛋白,一个G-蛋白可以转导多个信息给效应机制,调节许多细胞功能。
3.具有酪氨酸激酶活性的受体 这一类细胞膜上的受体由三个部分组成(图2-13C),细胞外有一段与配体结合区,中段穿透细胞膜,胞内区段有酪氨酸激酶活性,能促其本身酪氨酸残基的自我磷酸化而增强此酶活性,再对细胞内其他底物作用,促进其酪氨酸磷酸化,激活胞内蛋白激酶,增加DNA及RNA合成,加速蛋白合成,从而产生细胞生长分化等效应。胰岛素、胰岛素样生长因子、上皮生长因子、血小板生长因子及某些淋巴因子(lymphokines)的受体属于这一类型。
4.细胞内受体 甾体激素受体存在于细胞浆内,与相应甾体结合后分出一个磷酸化蛋白,暴露与DNA结合区段,进入细胞核能识别特异DNA碱基区段并与之结合促进其转录及以后的某种活性蛋白增生(图2-13D)。甲状腺素受体存在于细胞核内,功能大致相同。这两种受体触发的细胞效应很慢。需若干小时。
A.直接配体门控通道型

图2-13 受体类型示意图
三、第二信使
受体在识别相应配体并与之结合后需要细胞内第二信使(second messenger) 将获得信息增强、分化、整合并传递给效应机制才能发挥其特定的生理功能或药理效应。最早发现的第二信使是环磷腺苷(cAMP),现在知道还有许多其他物质参与细胞内信息转导。这是一个非常复杂的系统,简示如下(图2-14),很多问题尚有待进一步阐明。
1.G-蛋白 G蛋白是一类存在于细胞膜内侧的调节蛋白,都是由三个不同亚单位α、β、γ组成的三聚体。静息状态时与GDP结合。相应受体激活后GDP-α、β、γ复合物在Mg2+参与下,结合的GDP与胞浆中GTP交换,GTP-α与β、γ分离并与相应的效应机制结合,同时配体与受体分离。α亚单位内在的GTP酶活性促使GTP水解为GDP,激活效应机制,从而恢复原来静息状态(图2-15)。GS激活腺苷酸环化酶(AC),使cAMP增加。Gi抑制AC,使cAMP减少,G-蛋白还激活磷脂酶C(PLC),调节Ca2+、K+等离子通道。对鸟苷酸环化酶也有激活作用,作用非常广泛,介导多种效应。近来发现G-蛋白还介导激活磷脂酶A2(PLA2)而产生花生四烯酸(AA),后者是各种前列腺素及白三烯的前体。
图2-14 第二信使系统示意图
2. 环磷腺苷(cAMP) cAMP是ATP经AC作用的产物。β受体、D1受体、H2受体等激动药通过GS作用使AC活化,ATP水解而使细胞内cAMP增加。α受体、D2受体、MACh受体、阿片受体等激动药通过Gi作用抑制AC,细胞内cAMP减少。cAMP受磷酸二酯酶(phosphodiesterase,PDE)水解为5’AMP后灭活。茶碱抑制PDE而使胞内cAMP增多。cAMP能激活蛋白激酶A (PKA)而使胞内许多蛋白酶磷酸化(ATP提供磷酸基)而活化,例如磷酸化酶、脂酶、糖原合成酶等活化而产生能量。钙离子通道磷酸化后激活,钙离子内流而使神经、心肌、平滑肌等兴奋。
图2-15 G-蛋白作用示意图
3.环磷鸟苷(cGMP) cGMP是GTP经鸟苷酸环化酶(GC)作用的产物,也受PDE灭活。cGMP作用与cAMP相反,使心脏抑制、血管舒张、肠腺分泌等。CGMP可以独立作用而不受cGMP制约。cGMP可激活蛋白酶G而引起各种效应。
4.肌醇磷脂(phosphatidylinositol) 细胞膜肌醇磷脂的水解是另一类重要的受体信息转导系统。α、H1、5-HT2、M1、M3等受体激动药与其受体结合后通过G-蛋白介导激活磷脂酶C(PLC)PLC使4,5-二磷酸肌醇磷脂(PIP2)水解为二酰甘油(DAG)及1,4,5-三磷酸肌醇(IP3)。DAG在细胞膜上激活蛋白激酶C(PKC),使许多靶蛋白磷酸化而产生效应,如腺体分泌,血小板聚集,中性粒细胞活化及细胞生长、代谢、分化等效应。IP3能促进细胞内钙池释放Ca2+,也有重要的生理意义。
5.钙离子 细胞内Ca2+浓度在1μmol/l以下,不到血浆Ca2+的0.1%,对细胞功能有着重要的调节作用,如肌肉收缩、腺体分泌、白细胞及血小板活化等。细胞内Ca2+可从细胞外经细胞膜上的钙离子通道流入,也可从细胞内肌浆网等钙池释放,两种途径互相促进。前者受膜电位、受体、G-蛋白,蛋白激酶A(PKA)等调控,后者受IP3作用而释放。细胞内Ca2+激活蛋白激酶C(PKC),与DAG有协同作用,共同促进其他信息传递蛋白及效应蛋白活化。很多药物通过对细胞内Ca2+影响而发挥其药理效应,故对细胞内Ca2+调控及其作用机制近年来受到极大的重视。
四、受体的调节
受体虽是遗传获得的固有蛋白,但并不是固定不变的,而经常代谢转换处于动态平衡状态,其数量,亲和力及效应力经常受到各种生理及药理因素的影响。连续用药后药效递减是常见的现象,一般称为耐受性(tolerance)、不应性(refractoriness) 、快速耐受性(tachyphylaxis) 等。由于受体原因而产生的耐受性称为受体脱敏(receptor desensitization)。N2-ACh受体在受激动药连续作用后若干秒内发生脱敏现象,这是由于受体蛋白构象改变,钠离子通道不再开放所致。β-Adr受体脱敏时不能激活AC是因为受体与G-蛋白亲和力降低,或由于cAMP上升后引起PDE负反馈增加所致。具有酪氨酸激酶活性的受体可被细胞内吞(endocytosis)而数目减少,这一现象称为受体数目的向下调节(down regulation)。受体与不可逆拮抗药结合后其后果等于失去一部分受体,如银环蛇咬伤中毒时,N2-ACh受对激动药脱敏。与此相反,在连续应用拮抗药后受体会向上调节(up regulation),反应敏化。例如长期应用β-Adr受体拮抗药后,由于受体向上调节,突然停药时会出现反跳反应。