人体胚胎学总论或称人体早期发生,是指从受精至第八周末的发育时期,即胚前期和胚期。此时期的胚胎发育变化甚大,并易受内、外环境因素的影响。人体胚胎学总论的内容包括:生殖细胞和受精,卵裂和胚泡形成,植入和胚层形成,胚体形成和胚层分化,胎膜和胎盘。本章还简述各期胚胎的外形特征和胚胎龄的推算、多胎和联胎,以及胚胎发育的某些机理。
一、生殖细胞和受精
(一)生殖细胞
生殖细胞(germ cell)又称起配子(gamete),包括精子和卵子,均为单倍体细胞,即仅有23条染色钵,其中一条是性染色体。它们的发生概况见图20-1(详见第16、17章)。
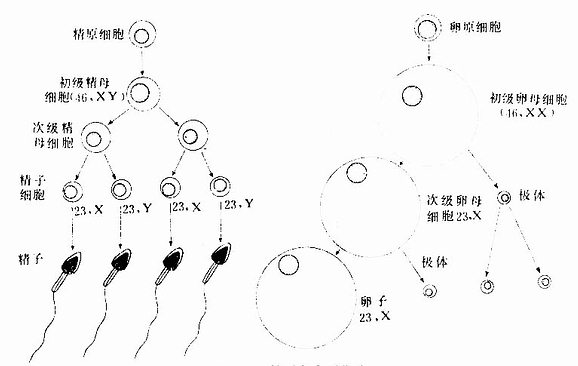
图20-1 精子与卵子发生
1.精子的获能 精子中的半数含Y染色体(23,Y),半数含X染色体(23,X)。射出的精子虽有运动能力,却无穿过卵子周围放射冠和透明带的能力。这是由于精子头的外表有一层能阻止顶体酶释放的糖蛋白。精子在子宫和输卵管中运行过程中,该糖蛋白被女性生殖管道分泌物中的酶降解,从而获得受精能力,此现象称获能(capacitation)。精子在女性生殖管道内的受精能力一般可维持1天。
2.卵子的成熟 从卵巢排出的卵子处于第二次成熟分裂的中期,并随输卵管伞的液流进入输卵管,在受精时才完成第二次成熟分裂。若未受精,于排卵后12~24小时退化。
(二)受精
受精(fertilization)是精子穿入卵子形成受精卵的过程,它始于精子细胞膜与卵子细胞膜的接触,终于两者细胞核的融合。受精一般发生在输卵管壶腹部。应用避孕套、输卵管粘堵或输精管结扎等措施,可以阻止精子与卵子相遇,从而阻止受精。
当获能的精子与卵子相遇时,它首先与卵子周围的放射冠接触。这时精子顶体的前膜即与表面的细胞膜融合,继而破裂形成许多小孔,顶体内含的酶(酸性水解酶)逐渐释放出来。精子顶体的这种变化为顶体反应(acrosome reaction)(图20-2)。释放的顶体酶先解离放射冠的卵泡细胞,继而分解透明带,形成一个精子穿过的通道,精子则与卵子直接接触,是受精的开始。
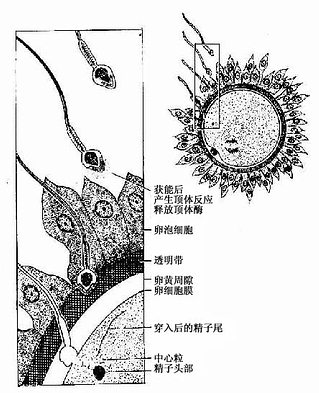
图20-2 精子顶体反应与受精
受精开始时,精子头侧面的细胞膜与卵细胞膜融合,随即精子的细胞核和细胞质进入卵内(图20-2)。精子进入卵子后,卵子浅层细胞质内的皮质颗粒立即释放溶酶体酶样物质,使透明带结构发生变化,称为透明带反应,从而阻止其它精子穿越透明带。在极少的情况下,两个精子同时进入卵子形成三倍体细胞的胚胎,此种胚胎均流产或出生后很快死亡。精子入卵后,卵子迅速完成第二次成熟分裂。此时精子和卵子的细胞核分别称为雄原核(male pronucleus)和雌原核(female pronucleus)。两个原核逐渐在细胞中部靠拢,核膜随即消失,染色体混合,形成二倍体的受精卵(fertilized ovum),又称合子(zygote)(图20-3)。
受精的意义在于:①受精使卵子的缓慢代射转入代谢旺盛,从而启动细胞不断地分裂;②精子与卵子的结合,恢复了二倍体,维持物种的稳定性;③受精决定性别,带有Y染色体的精子与卵子结合发育为男性,带有X染色体的精子与卵子结合则发育为女性;④受精卵的染色体来自父母双方,加之生殖细胞在成熟分裂时曾发生染色体联合和片断交换,使遗传物质重新组合,使新个体具有与亲代不完全相同的性状。
受精后,母体血浆内很快出现一种免疫抑制物,称早期妊娠因子(early pregnancy factor),它是目前检查早期妊娠的一种指征。
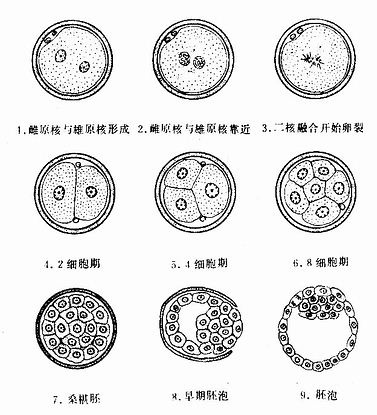
图20-3 卵裂和胚泡形成(第1周)
二、卵裂和胚泡形成
受精卵由输卵管向子宫运行中,不断进行细胞分裂,此过程称卵裂(cleavage)。卵裂产生的细胞称卵裂球(blastomere)。随着卵裂球数目的增加,细胞逐渐变小,到第3天时形成一个12~16个卵裂球组成的实心胚,称桑椹胚(morula)(图20-3,20-4)。
桑椹胚的细胞继续分裂,细胞间逐渐出现小的腔隙,它们最后汇合成一个大腔,桑椹胚转变为中空的胚泡。胚泡(blastocyst,又称囊胚)于受精的第4天形成并进入子宫腔。胚泡外表为一层扁平细胞。称滋养层(trophoblast),中心的腔称胚泡腔(blastocoele),腔内一侧的一群细胞,称内细胞群(inner cell mass)。胚泡逐渐长大,透明带变薄而消失,胚泡得以与子宫内膜接触,植入开始(图20-3,20-4)。
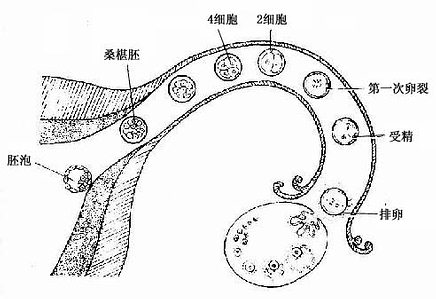
图20-4 排卵、受精与卵裂过程
三、植入和胚层形成
此阶段的主要变化是:胚泡植入子宫内膜,获得进一步发育的适宜环境和充足的营养供应;内细胞群分化为由内、中、外三个胚层构成的胚盘,它是人体各器官和组织的原基;胎膜与胎盘也渐形成和发育。
(一)植入
胚泡逐渐埋入子宫内膜的过程称植入(implantation),又称着床(imbed)。植入约于受精后第5~6天起始,第11~12天完成。植入时,内细胞群侧的滋养层先与子宫内膜接触,并分泌蛋白酶消化与其接触的内膜组织,胚泡则沿着被消化组织的缺口逐渐埋入内膜功能层。在植入过程中,与内膜接触的滋养层细胞迅速增殖,滋养层增厚,并分化为内、外两层。外层细胞间的细胞界线消失,称合体滋养层(syncytiotrophoblast);内层由单层立方细胞组成,称细胞滋养层(cytotrophoblast)。后者的细胞通过细胞分裂使细胞数目不断增多,并补充合体滋养层。胚泡全部植入子宫内膜后,缺口修复,植入完成。这时整个滋养层均分化为两层,合体滋养层内出现腔隙,期内含有母体血液(图20-5)。
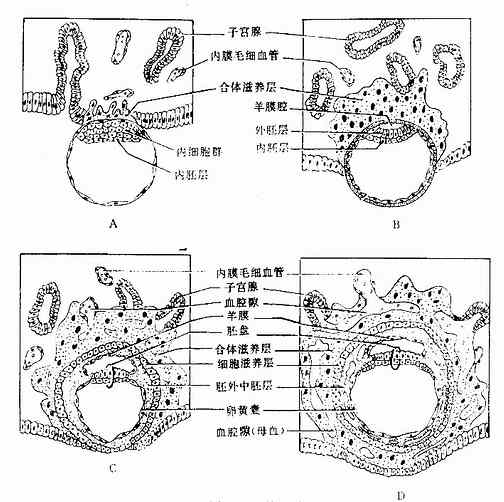
图20-5 植入过程
A.植入早期(第7天)B.第8天 C.植入后期(第9天) D.植入完成(第12天)
植入时的子宫内膜处于分泌期,植入后血液供应更丰富,腺体分泌更旺盛,基质细胞变肥大,富含糖原和脂滴,内膜进一步增厚。子宫内膜的这些变化称蜕膜反应,此时的子宫内膜称蜕膜(decidua)。根据蜕膜与胚的位置关系,将其分为三部分:①基蜕膜(decidua basalis),是位居胚深部的蜕膜;②包蜕膜(decidua capsularis),是覆盖在胚宫腔侧的蜕膜;③壁蜕膜(decidua parietalis),是子宫其余部份的蜕膜(图20-6)。
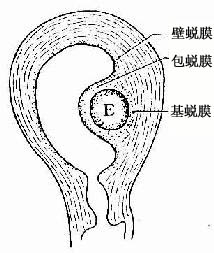
图20-6 胚胎与子宫蜕膜的关系 E 胚胎
胚泡的植入部位通常在子宫体和底部,最多见于后壁。若植入位于近子宫颈处,在此形成胎盘,称前置胎盘(placenta previa),分娩时胎盘可堵塞产道,导致胎儿娩出困难。若植入在子宫以外部位,称宫外孕(ectopic pregnancy),常发生在输卵管,偶见于子宫濶韧带、肠系膜,甚至卵巢表面等处(图20-7)。宫外孕胚胎多早期死亡。
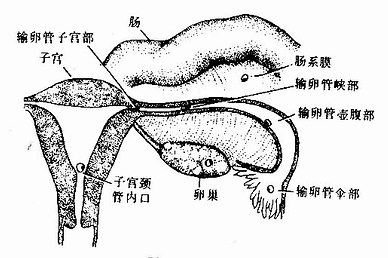
图20-7 异位植入
胚泡的植入是以母体性激素的正常分泌使子宫内膜保持在分泌期为基础的,透明带消失和胚泡适时进入宫腔是植入的条件。若母体内分泌紊乱或内分泌受药物干扰,子宫内膜周期性变化则与胚泡的发育不同步,子宫内膜有炎症或有避孕环等导物,均可阻碍胚泡的植入。
人卵体外受精(fertilization in vitro,VIF)技术建立于1969年。用IVF技术获得的受精卵在体外发育到桑椹胚或早期胚泡,再移植到子宫内的技术称胚胎移植(embryo transfer,ET)。应用IVF和ET技术于1978年诞生了第一例“试管婴儿”(test tube baby),我国大陆于1988年春天诞生了首例“试管婴儿”。IVF和ET技术的开展,可以解决因输卵管堵塞而不能怀孕妇女的生育问题。目前,体外受精获得的早期人胚,经冷冻保存后再移植入子宫的胚胎也获得成活。
(二)胚层形成
在第二周胚泡植入时,内细胞群的细胞也增殖分化,逐渐形成一个圆盘状的胚盘(embryonic disc),此时的胚盘由内、外两个胚层。外胚层(ectoderm)为邻近滋养层的一层柱状细胞,内胚层(endoderm)是位居胚泡腔侧的一层立方细胞,两层紧贴在一起(图20-5)。继之,在外胚层的近滋养层侧出现一个腔,为羊膜腔,腔壁为羊膜。羊膜与外胚层的周缘续连,故外胚层构成羊膜腔的底。内胚层的周缘向下延伸形成另一个囊,即卵黄囊,故内胚层构成卵黄囊的顶。羊膜腔的底(外胚层)和卵黄囊的顶(内胚层)紧相贴连构成的胚盘是人体的原基。滋养层、羊膜腔和卵黄囊则是提供营养和起保护作用的附属结构。此时期的胚泡腔内出现松散分布的胚外中胚层细胞。它们先充填于整个胚泡腔(图20-5)。继而细胞间出现腔隙,腔隙逐渐汇合增大,在胚外中胚层内形成一个大腔,称胚外体腔。胚外中胚层则分别附着于滋养层内面及卵黄囊和羊膜的外面,羊膜腔顶壁尾侧与滋养层之间的胚外中胚层将两者连接起来。称体蒂(body stalk)(图20-8)。
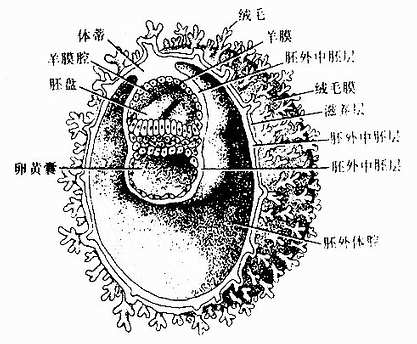
图20-8 第3周初胚的剖面
至第3周初,胚盘外层细胞增殖,在胚盘外胚层尾侧正中线上形成一条增厚区,称原条。原条(primitive streak)的头端略膨大,为原结(primitive node)(图20-9)。原条的出现,胚盘即可区分出头尾端和左右侧。继而在原条的中线出现浅沟,原结的中心出现浅凹,分别称原沟和原凹。原条深面的细胞则逐渐迁移到内外胚层之间,形成松散的间充质。原条两侧的间充质细胞继续向侧方扩展,形成胚内中胚层(intraembryonic mesoderm),它在胚盘边缘与胚外中胚层续连。从原结向头侧迁移的间充质细胞,形成一条单独的细胞索,称脊索(notochord),它在早期胚胎起一定支架作用(图20-9,20-10)。脊索向头端生长,原条则相对缩短,最终消失。若原条细胞残留,在人体骶尾部可分化形成由多种组织构成的畸胎瘤。
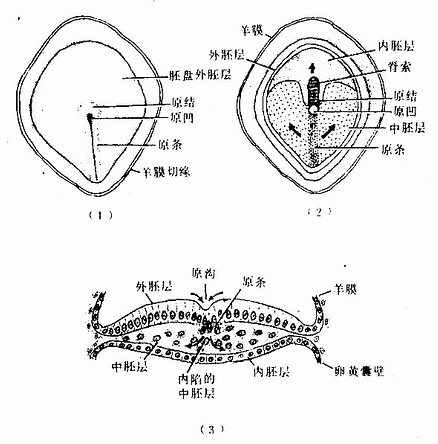
图20-9 第16天胚盘示原条、中胚层和脊索的形成
(1)胚盘背面观(2)切除外胚层,示中胚层和脊索(3)通过原条的胚盘横切,示中胚层形成
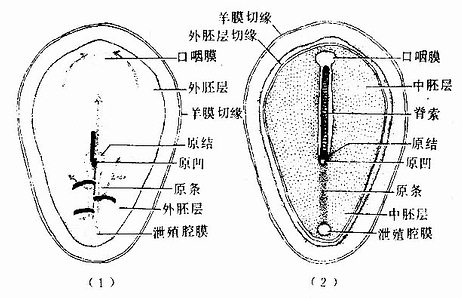
图20-10 第18天胚盘
(1)胚盘背面观,示中胚层的形成和细胞迁移方向 (2)切去外胚层,示中胚层及脊索
四、胚体形成的胚层分化
从第4周初至第8周末的发育过程,胚胎不仅初具人形,而且胚盘的三胚层分化发育,建成各器官系统的雏形;胎膜和胎盘也于此时期发育形成。此时期的胚胎发育对环境因素的作用十分敏感,某些有害因素(病毒、药物等)易通过母体影响胚胎发育,导致发生某些严重的先天性畸形。
(一)胚体形
随着胚层的分化,扁平形胚盘逐渐变为圆柱形的胚体。这是通过胚盘边缘向腹侧卷折形成头褶、尾褶和左右侧褶而实现的,也与羊膜腔和卵黄囊的演变有关。胚盘卷折主要是由于各部份生长速度的差异所引起。如胚盘中部的生长速度快于边缘部,外胚层的生长速度又快于内胚层,致使外胚层包于胚体外表,内胚层卷到胚体内,胚体凸到羊膜腔内,胚盘头尾方向的生速度快于左右方向的生长,头侧的生长速度又快于尾侧,因而胚盘卷折为头大尾小的圆柱形胚体,胚盘边缘则卷折到胚体腹侧。随着胚的进一步发育,胚体腹侧的边缘逐渐靠近,最终在胚体腹侧形成圆索状的原始脐带,与绒毛膜相连(图20-11)。
圆柱形胚体形成的结果:胚体凸入羊膜腔的羊水内;体蒂和卵黄囊连于胚体腹侧脐处,外包羊膜,形成原始脐带;口咽膜和泄殖腔膜分别转到胚体头和尾的腹侧;外胚层包于胚体外表;内胚层卷折到胚体内,形成头尾方向的原始消化管,管中份的腹侧借缩窄的卵黄蒂与卵黄囊通连,管头端由口咽膜封闭,尾端由泄殖腔膜封闭。至第8周末,胚体外表已可见眼、耳和鼻的原基及发育中的四肢,初具人形(图20-11)。
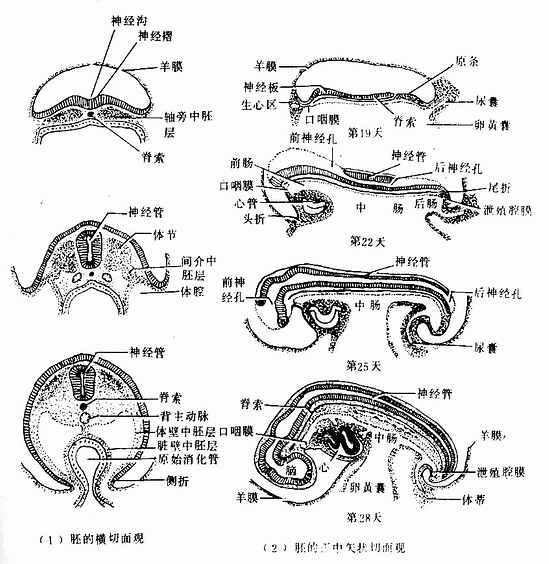
图20-11 胚体形成和胚层分化
(二)胚层分化
胚体形成的同时,三个胚层也逐渐分化形成各器官的原基。
1.外胚层的分化 脊索形成后,诱导其背侧中线的外胚层增厚呈板状,称神经板(neural plate)。神经板随脊索的生长而增长,且头侧宽于尾侧。继而神经板中央沿长轴下隐形成神经沟(neural groove),沟两侧边缘隆起称神经褶(neural fold),两侧神经褶在神经沟中段靠拢并愈合,愈合向两端延伸,使神经沟封闭为神经管(neural tube)。神经管两侧的表面外胚层在管的背侧靠拢并愈合,使神经管位居于表面外胚层的深面(图20-11)。神经管将分化为中枢神经系统以及松果体、神经垂体和视网膜等。在神经褶愈合过程中,它的一些细胞迁移到神经管背侧成一条纵行细胞索,继而分裂为两条分别位于神经管的背外侧,称神经嵴(neural crest),它将分化为周围神经系统及肾上腺髓质等结构。位于体表的表面外胚层,将分化为皮肤的表皮及其附属器,以及牙釉质、角膜上皮、晶状体、内耳膜迷路、腺垂体、口腔和鼻腔与肛门的上皮等。
2.中胚层的分化 中胚层在脊索两旁从内侧向外侧依次分化为轴旁中胚层、间介中胚层和侧中胚层(图20-11)。分散存在的中胚层细胞,称间充质,分化为结缔组织以及血管、肌组织等。脊索则大部份退化消失,仅在椎间内残留为髓核。
(1)轴旁中胚层(paraxial mesoderm):紧邻脊索两侧的中胚层细胞迅速增殖,形成一对纵行的细胞索,即轴旁中胚层。它随即裂为块状细胞团,称体节(somite)。体节左右成对,从颈部向尾依次形成,随胚龄的增长而增多,故可根据体节的数量推算早期胚龄。第5周时,体节全部形成,共约42~44对。体节将分化为皮肤的真皮、大部份中轴骨骼(如脊柱、肋骨)及骨骼肌。
(2)间介中胚层(intermediate mesoderm):位于轴旁中胚层与侧中胚层之间,分化为泌尿生殖系统的主要器官。
(3)侧中胚层(lateral mesoderm):是中胚层最外侧的部份,两侧的侧中胚层在口咽膜的头侧汇合为生心区。随着胚体的形成,生心区移到胚体原始消化管的腹侧,口咽膜的尾侧,分化形成心脏。侧中胚层迅速裂为两层。与外胚层邻近的一层,称体壁中胚层(parietall mesoderm),将分化为体壁(包括肢体)的骨骼、肌肉、血管和结缔组织;与内胚层邻近的一层,称脏壁中胚层(visceral mesoderm),覆盖于原始消化管外面,将分化为消化和呼吸系统的肌组织、血管和结缔组织等。两层之间的腔为原始体腔,最初呈马蹿铁形,继而从头端到尾端分化为心包腔、胸膜腔和腹膜腔。
3.内胚层的分化在胚体形成的同时,内胚层卷折形成原始消化管。原始消化管将分化为消化管、消化腺、呼吸道和肺的上皮组织,以及中耳、甲状腺、甲状旁腺、胸腺、膀胱和阴道等的上皮组织。
五、胎膜和胎盘
胎膜和胎盘是对胚胎起保护、营养、呼吸和排泄等作用的附属结构,有的还有一定的内分泌功能。胎儿娩出后,胎膜、胎盘与子宫蜕膜一并排出,总称衣胞。
(一)胎膜
胎膜(fetal membrane)包括绒毛膜、羊膜、卵黄囊、原囊和脐带(图20-12)。
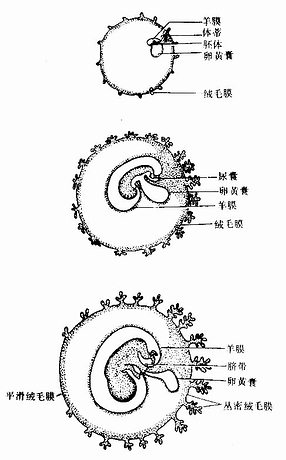
图20-12 胎膜与胚胎
1.绒毛膜 绒毛膜(chorion)由滋养层和衬于其内面的胚外中胚层组成。植入完成后,滋养层已分化为合体滋养层和细胞滋养层两层,继之细胞滋养层的细胞局部增殖,形成许多伸入合体滋养层内的隆起,这时,表面有许多突起的滋养层和内面的胚外中胚层合称为绒毛膜。绒毛膜包在胚胎及其它附属结构的最外面,直接与子宫培膜接触,膜的外表有大量绒毛(villi)。绒毛的发育使绒毛膜与子宫蜕膜接触面增大,利于胚胎与母体间的物质交换。第2周末的绒毛仅由外表的合体滋养层和内部的细胞滋养层构成,称初级绒毛干。第3周时,胚外中胚层逐渐伸入绒毛干内,改称次级绒毛干。此后,绒毛干内的间充质分化为结缔组织和血管,形成三级绒毛干。绒毛干进而发出分支,形成许多细小的绒毛。同时,绒毛干末端的细胞滋养层细胞增殖,穿出合体滋养层。伸抵蜕膜组织,将绒毛干固着于蜕膜上。这些穿出的细胞滋养层细胞还沿蜕膜扩展,彼此连接,形成一层细胞滋养层壳,使绒毛膜与子宫蜕膜牢固连接(图20-13)。绒毛干之间的间隙,称绒毛间隙(intervillous space)。绒毛间隙内充以从子宫螺旋动脉来的母体血。胚胎藉绒毛汲取母血中的营养物质并排出代谢产物。
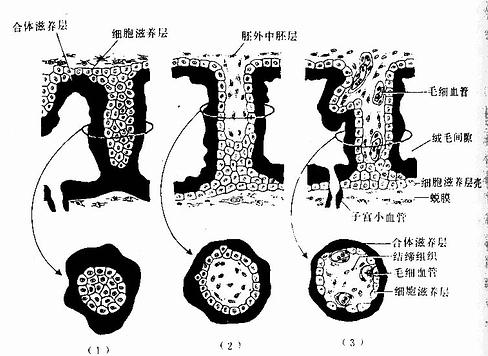
图20-13 绒毛干的分化发育
上图为绒毛干纵断面,下图为绒毛干横断面
(1)初级绒毛干 (2)次级绒毛干 (3)三级绒毛干
胚胎早期,整个绒毛膜表面的绒毛均匀分布。之后,由于包蜕膜侧的血供匮乏,绒毛逐渐退化、消失,形成表面无绒毛的平滑绒毛膜(smooth chorion)。基蜕膜侧血供充足,该处绒毛反复分支,生长茂密,称丛密绒毛膜(villous chorion)(图20-12),它与基蜕膜组成胎盘。丛密绒毛膜内的血管通过脐带与胚体内的血管连通。此后,随着胎的发育增长及羊膜腔的不断扩大,羊膜、平滑绒毛膜和包蜕膜进上步凸向子宫腔,最终与壁蜕膜愈合,子宫腔逐渐消失(图20-14)。
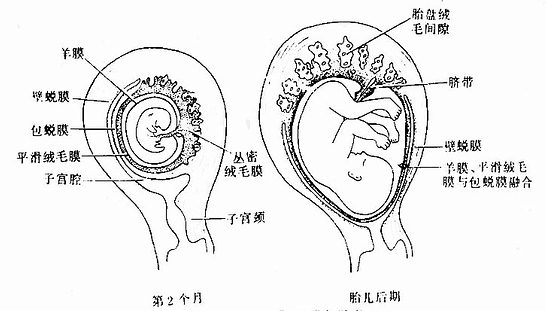
图20-14 胎膜、蜕膜与胎盘
绒毛膜为早期胚胎发育提供和氧气,从密绒毛膜参与组成胎盘。在绒毛膜发育过程中,若血管未通连,胚胎可因缺乏营养而发育迟缓或死亡。若绒毛膜发生病变,如滋养层细胞过度增生、绒毛内结缔组织变性水肿(水泡状胎块)、滋养层细胞癌变(绒毛膜上皮癌)等,不仅严重影响胚胎的发育,还危及母体健康。
2.羊膜 羊膜(amnion)为半透明薄膜,羊膜腔内充满羊水(amniotic fluid),胚胎在羊水中生长发育(图20-12,20-14)。羊膜最初附着于胚盘的边缘,随着胚体形成、羊膜腔扩大和胚体凸入羊膜腔内,羊膜遂在胚胎的腹侧包裹在体蒂表面,形成原始脐带。羊膜腔的扩大逐渐使羊膜与绒毛膜相贴,胚外体腔消失。羊水呈弱碱性,含有脱落的上皮细胞和一些胎儿的代谢产物。羊水主要由羊膜不断分泌产生,又不断地被羊膜吸收和被胎儿吞饮,故羊水是不断更新的。羊膜和羊水在胚胎发育中起重要的保护作用,如胚胎在羊水中可较自由的活动,有利于骨骼肌的正常发育,并防止胚胎局部粘连或受外力的压迫与震荡。临产时,羊水还具扩张宫颈冲洗产道的作用。随着胚胎的长大,羊水也相应增多,分娩时约有1000~15000ml。羊水过少(500ml以下),易发生羊膜与胎儿粘连。影响正常发育,羊水过多(2000ml以上),也可影响胎儿正常发育。羊水含量不正常,还与某些先天性畸形有关,如胎儿无肾或尿道闭锁可致羊水过少,胎儿消化道闭锁或神经管封闭不全可致羊水过多,穿刺抽取羊水,进行细胞染色体检查或测定羊水中某些物质的含量,可以早期诊断某些先天性异常。
3.卵黄囊 卵黄囊(yolk sac)位于原始消化管腹侧(图20-11,20-12)。鸟类胚胎的卵黄很发达,囊内贮有大量卵黄,为胚胎发育提供营养。人胚胎的卵黄囊内没有卵黄,卵黄囊不发达,它的出现也是种系发生和进化的反映。人胚胎卵黄囊被包入脐带后,与原始消化管相连的卵黄蒂于第6周闭锁,卵黄囊也逐渐退化,但人类的造血干细胞和原始生殖细胞却分别来自卵黄囊的胚外中胚层和内胚层。
4.尿囊 尿囊(allantois)是从卵黄囊尾侧向体蒂内伸出的一个盲管,随着胚体的形成而开口于原始消化管尾段的腹侧,即与后来的膀胱通连。尿囊闭锁后形成膀胱至脐的脐正中韧带。鸟类胚胎的尿囊发达,具气体交换和储存代谢废物的功能。人胚胎的气体交换和废物排泄由胎盘完成,尿囊仅为遗跡性器官,但其壁的胚外中胚层形成脐血管。
5.脐带 脐带(umbilical cord)是连于胚胎脐部与胎盘间的索状结构。脐带外被羊膜,内含体蒂分化的粘液性结缔组织。结缔组织内除有闭锁的卵黄蒂和尿囊外,还有脐动脉和脐静脉。脐血管的一端与胚胎血管相连。另一端与胎盘绒毛血管续连。脐动脉有两条,将胚胎血液运送至胎盘绒毛内,在此,绒毛毛细血管内的胚胎血与绒毛间隙内的母血进行物质交换。脐静脉仅有一条,将胎盘绒毛汇集的血液送回胚胎。胎儿出生时,脐带长40~60cm ,粗1.5~2cm,透过脐带表面的羊膜,可见内部盘曲缠绕的脐血管。脐带过短,胎儿娩出时易引起胎盘过早剥离,造成出血过多;脐带过长,易缠绕胎儿肢体或颈部,可致局部发育不良,甚致胎儿窒息死亡。
(二)胎盘
1.胎盘的结构 胎盘(placenta)是由胎儿的丛密绒毛膜与母体的基蜕膜共同组成的圆盘形结构(图20-14,20-15)。足月胎儿的胎盘重约500g,直径15~20cm,中央厚,周边薄,平均厚约2.5cm。胎盘的胎儿面光滑,表面覆有羊膜,脐带附于中央或稍偏,透过羊膜可见呈放射状走行的脐血管分支。胎盘的母体面粗糙,为剥离后的基蜕膜,可见15~30个由浅沟分隔的胎盘小叶(cytoledon)。
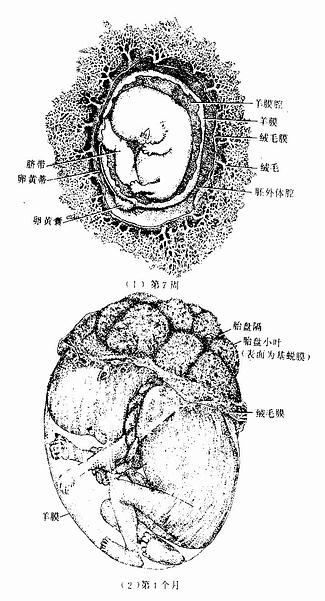
图20-15 胚胎与胎盘
在胎盘垂直切面上,可见羊膜下方为绒毛膜的结缔组织,脐血管的分支行于其中。绒毛膜发出约40~60根绒毛干。绒毛干又发出许多细小绒毛,干的末端以细胞滋养层壳固着于基蜕膜上。脐血管的分支沿绒毛干进入绒毛内,形成毛细血管。绒毛干之间为绒毛间隙,由基蜕膜构成的短隔伸入间隙内,称胎盘隔(placental septum)。胎盘隔将绒毛干分隔到胎盘小叶内,每个小叶含1~4根绒毛干。子宫螺旋动脉与子宫静脉开口于绒毛间隙,故绒毛间隙内充以母体血液,绒毛浸在母血中(图20-16,彩图)。
2、胎盘的血液循环和胎盘膜 胎盘内有母体和胎儿两套血液循环,两者的血液在各自的封闭管道内循环,互不相混,但可进行物质交换。母体动脉血从子宫螺旋动脉流入绒毛间隙,在此与绒毛内毛细血管的胎儿血进行物质交换后,由子宫静脉回流入母体。胎儿的静脉血经脐动脉及其分支流入绒毛毛细血管,与绒毛间隙内的母体血进行物质交换后,成为动脉血,又经脐静脉回流到胎儿(图20-16)。
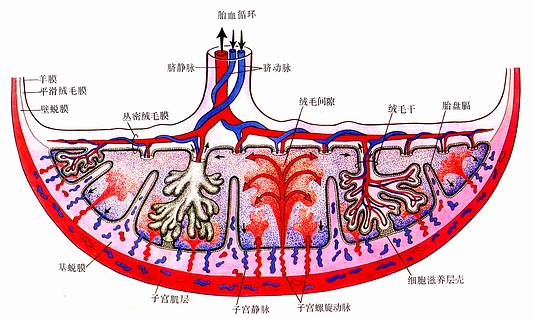
图20-16 胎盘的结构与血循环模式图
箭头示血流方向,红色示富含营养与O2的血,黑色示含代谢废物与CO2的血
胎儿血与母体血在胎盘内进行物质交换所通过的结构,称胎盘膜(placental membrane)或胎盘屏障(placental barrier)。早期胎盘膜由合体滋养层、细胞滋养层和基膜、薄层绒毛结缔组织及毛细血管内皮和基膜组成。发育后期,由于细胞滋养层在许多部位消失以及合体滋养层在一些部位仅为一薄层胞质,故胎盘膜变薄,胎血与母血间仅隔以绒毛毛细血管内皮和薄层合体滋养层及两者的基膜,更有利于胎血与母血间的物质交换。
3.胎盘的功能
(1)物质交换:进行物质交换是胎盘的主要功能,胎儿通过胎盘从母血中获得营养和O2,排出代谢产物和CO2。因此胎盘具有相当于出生后小肠、肺和肾的功能(见图20-17)。由于某些药物、病毒和激素可以透过胎盘膜影响胎儿,故孕妇用药需慎重。
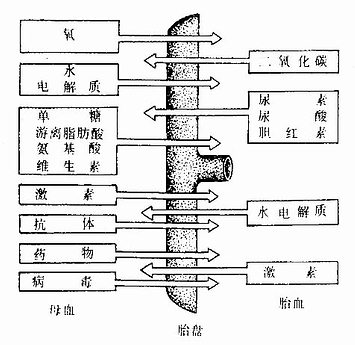
图20-17 母体与胎儿之间物质交换图解
(2)内分泌功能:胎盘的合体滋养层能分泌数种激素,对维持妊娠起重要作用。主要为:①绒毛膜促性腺激素(human chorionic gonadotropin,HCG),其作用与黄体生成素类似,能促进母体黄体的生长发育,以维持妊娠,HCG在妊娠第2周开始分泌,第8周达高峰,以后逐渐下降;②绒毛膜促乳腺生长激素(human chorionic somatomammotropin,HCS),能促使母体乳腺生长发育,HCS于妊娠第2月开始分泌,第8月达高峰,直到分娩;③孕激素和雌激素,于妊娠第4月开始分泌,以后逐渐增多。母体的黄体退化后,胎盘的这两种激素起着继续维持妊娠的作用。
六、胚胎各期外形特征和胚胎龄的推算
临床常以月经龄推算胚胎龄,即从孕妇末次月经的第一天算起,至胎儿娩出共约40周。胚胎学者则常用受精龄,即从受精之日为起点推算胚胎龄,受精一般发生在末次月经第一天之后的2周左右,故从受精到胎儿娩出约经38周。但由于妇女的月经周期常受环境变化的影响,故胚胎龄的推算难免有误差。
胚胎学研究工作者所获得的人胚胎标本,大多缺乏产妇月经时间的准确记录。胚胎学家根据大量胚胎标本的观察研究,总结归纳出各期胚胎的外形特征和长度,以作为推算胚胎龄的依据。如第1~3周,主要根据胚的发育状况和胚盘的结构;第4~5周,常利用体节数及鳃弓与眼耳鼻等始基的出现情况;第6~8周,则依据四肢与颜面的发育特征(表20-1)。胎龄的推算,主要根据颜面、皮肤、毛发、四肢、外生殖器等的发育状况,并参照身长,足长和体重等(表20-2)。
表20-1 胚的外形特征与长度
| 胚龄(周) |
外形特征 |
长度(mm) |
| 1 |
受精、卵裂、胚泡形成,开始植入 |
|
| 2 |
圆形两胚层胚盘,植入完成,绒毛膜形成 |
0.1~0.4(GL) |
| 3 |
梨形三胚层胚盘,神经板和神经褶出现,体节初现 |
0.5~1.5(GL) |
| 4 |
胚体渐形成,神经管形成,体节3-~29对,鳃弓1~2对,眼鼻耳始基初现,脐带与胎盘形成 |
1.5~5.0(CR) |
| 5 |
胚体屈向腹侧,鳃弓5对,肢芽出现,手板明显,体节30~40对 |
4~8(CR) |
| 6 |
肢芽分为两节,足板明显,视网膜出现色素,耳廓突出现 |
7~12(CR) |
| 7 |
手足板相继出现指趾初形,体节不见,颜面形成,乳腺嵴出现 |
10~21(CR) |
| 8 |
手指足趾明显,指趾出现分节,眼睑开放,尿生殖膜和肛膜先后破裂,外阴可见,性别不分,脐疝明显 |
19~35(CR) |
此表主要参照Jirasek(1983)
表20-2 胎儿外形主要特征及身长、足长与体重
| 胎龄(周) |
外形特征 |
身长(CRL,mm) |
足长(mm) |
体重(g) |
| 9 |
眼睑闭合,外阴性别不可辨 |
50 |
7 |
8 |
| 10 |
肠袢退回腹腔,指甲开始发生 |
61 |
9 |
14 |
| 12 |
外阴可辨性别,颈明显 |
87 |
14 |
45 |
| 14 |
头竖直,下肢发育好,趾甲开始发生 |
120 |
20(22.0) |
110 |
| 16 |
耳竖起 |
140 |
27(26.3) |
200 |
| 18 |
胎脂出现 |
160 |
33(32.9) |
320 |
| 20 |
头与躯干出现胎毛 |
190 |
39(37.9) |
460 |
| 22 |
皮肤红、皱 |
210 |
45(43.2) |
630 |
| 24 |
指甲全出现,胎体瘦 |
230 |
50(49.8) |
820 |
| 26 |
眼睑部分打开,睫毛出现 |
250 |
55(54.0) |
1000 |
| 28 |
眼重新打开,头发出现,皮肤略皱 |
270 |
59(61.9) |
1300 |
| 30 |
趾甲全出现 ,胎体平滑,睾丸开始下降 |
280 |
63(63.4) |
1700 |
| 32 |
指甲平齐指尖,皮肤浅红光滑 |
300 |
68(67.4) |
2100 |
| 36 |
胎体丰满,胎毛基本消失,趾甲平齐趾尖,肢体弯曲 |
340 |
79(73.4) |
2900 |
| 38 |
胸部发育好,乳腺略隆起,睾丸位阴囊或腹股沟管,指甲超过指尖 |
360 |
83(77.1) |
3400 |
注:足长括弧内数据是应用B超测国人妊娠胎儿足长所得均数,其它数据均参照Moore(1988)年接测量胎儿结果
胚胎长度的测量标准有三种:①最长值(greatest length,GL),多用于测量第1~3周的胚;②顶臀长(crown-rumplength,CRL),又称坐高,用于测量第4周及以后的胚胎;③顶跟长(crown-heal length,CHL),又称立高,常用于测量胎儿(图20-18)。用B超测定孕妇体内胚胎的顶臀长等与直接测量胚胎标本的数据很接近,故应用B超测量是一个值得开展的工作。
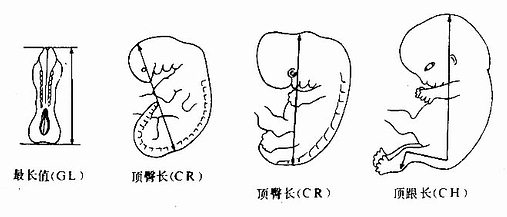
图20-18 胚胎长度测量
七、双胎、多胎和联胎
(一)双胎
双胎(twins)又称孪生,双胎的发生率约占新生儿的1%。双胎有两种。
1.双卵孪生一次排出两个卵子分别受精后发育为双卵孪生(dizygotic twins),占双胎的大多数。它们有各自的胎膜与胎盘,性别相同或不同,相貌和生理特性的差异如同一般兄弟姐妹,仅是同龄而已。
2.单卵孪生由一个受精卵发育为两个胚胎,故此种双胎儿的遗传基因完全一样。它们的性别一致,而且相貌和生理特征也极相似。单卵孪生(monozygotic twins)可以是:①一个胚泡内出现两个内细胞群,各发育为一个胚胎,这类孪生儿有各自的羊膜,但共有一个绒毛膜与胎盘;②胚盘上出现两个原条与脊索;诱导形成两个神经管,发育为两个胚胎,这类挛生儿同位于一个羊膜腔内,也共有一个绒毛膜与胎盘;③卵裂球分离为两团,它们各自发育为一个完整的胚,但人的卵裂球围以透明带,卵裂球分离的可能性较小(图20-19)。
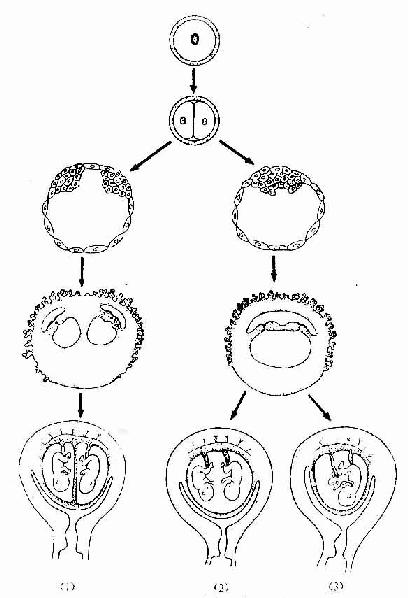
图20-19 单卵孪生和联胎
(1)一个胚泡内出现两个内细胞群;(2)一个胚盘形成两个原条;(3)单卵双胎联体畸胎
(二)多胎
一次娩出两个以上新生儿为多胎(multiple birth)。多胎的原因可以是单卵性、多卵性或混合性,常为混合性多胎。多胎发生率低,三胎约万分之一,四胎约百万分之一;四胎以上更为罕见,多不易存活。
(三)联体双胎
在单卵孪生中,当一个胚盘出现两个原条并分别发育为两个胚胎时,若两原条靠得较近,胚体形成时发生局部联接,称联体双胎(conjoined twins)。联体双胎有对称型和不对称型两类。对称型指两个胚胎一大一小,小者常发育不全,形成寄生胎或胎中胎(图20-20)
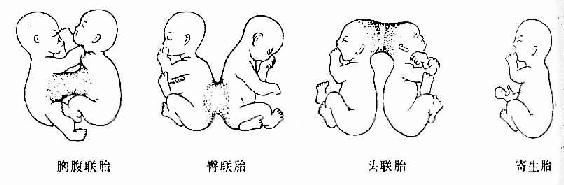
图20-20 联胎的类型
八、胚胎发育中的某些机理
从受精卵发育为一个新个体历经复杂的演变过程,包括细胞增殖、死亡、分化、识别、迁移和菜单达,以及组织和器官的形成等。这些变化具严密规律,具有精细的时间顺序和空间关系。来自同一受精卵的细胞,它们的基因结构是相同的,胚胎发育变化中,细胞基因的表达起决定作用,并受内外环境因素的影响。胚胎发育机理是现代发育生物学中重大的研究课题。
(一)细胞分化
细胞分化(cell differentiation)是指幼稚细胞发育为具有某些特殊结构和功能的过程。如桑椹胚分化为内细胞群和滋养层两类不同的细胞。内细胞群又分化为三个胚层,三个胚层再分化形成各种组织。又如,造血干细胞先分化为各种造血相祖细胞,后者再分化为不同的血细胞;骨原细胞分化为成骨细胞或软骨细胞;精原细胞分化为精子等。这是广义的分化概念,它包括形态结构和功能的成熟过程。狭义的或更严格的分化概念,是指原始的或尚未定向的细胞不可逆地转变为某种定向细胞的时刻,它称之为决定(determination)。细胞的决定发生在它的形态结构变化之前,它的主要标志是能合成某种特殊蛋白质(如酶、受体等),故可以用测定蛋白质、受体或酶等技术研究细胞的分化。
不同种属动物,其早期胚胎细胞出现决定的时间不同。如无脊椎动物的卵裂球已经决定,故一部分卵裂球不能发育为完整的个体;而哺乳类的卵裂球尚未决定,其一部分卵裂球也可发育为一个完整的胚胎。如人桑椹胚若被分隔成两团细胞,它们各自可发育为一个胎儿(单卵孪生)。
(二)形态发生
组织和器官的形态发生(morphogenesis)是通过细胞的形态变化和运动、细胞的识别和粘着、细胞增殖和死亡等过程而实现的。
1.细胞形态变化和运动胚胎的形态发生多与细胞层的铺展、卷折、陷入、隆起和细胞迁移有关,而这又与细胞内微丝、微管配布引起的细胞形态变化和细胞外基质大分子物质的浓度有关。如外胚层在形成神经板、神经沟和神经管的过程中,细胞内微管先沿其两极平行纵向排列,细胞则沿纵轴伸长形成神经板,继而微丝平行排列于细胞顶端,细胞该端变窄,神经板逐渐下陷形成神经沟与神经管(图20-21)。体外培养的细胞向一个方向运动时,细胞则伸长,胞质内的微管也沿伸长和运的方向纵行排列,细胞前缘的细胞膜呈波浪状前行运动,也是与膜下大量微丝的参与相关的。基质大分子物质如纤维粘连蛋白(fibronectin)、层粘连蛋白(laminin)、胶原、糖胺多糖等也参与细胞的运动,它们可能通过细胞膜的蛋白受体与胞质内微丝连接,从而调节微丝、微管的排列方向而引起运动。细胞通过这种方式识别这些物质的浓度梯度,从而调整运动的方向。
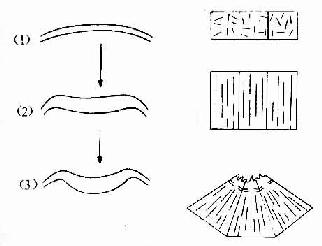
图20-21神经管形成过程细胞形状与微丝、微管配布变化的关系
(1)外胚层细胞呈立方形,微丝和微管任意分布
(2)细胞变长,微管平行于长轴排列,形成神经板
(3)细胞顶部缩窄,微丝与表面平行分布,形成神经管
2.细胞识别和粘着胚胎发育中,同类或相关细胞能彼此识别,经过迁移能按一定的模式类聚和粘着在一起,构成组织。近年认为,这是由于细胞膜上的糖蛋白受体与相关细胞细胞衣内的糖链结合的结果。
3.细胞增殖和死亡胚胎时期的细胞增殖十分旺盛,其调控机制,尚不完全清楚。已知与多种刺激相应细胞增殖的化学因子有关,如生长激素、性激素、神经生长因子、表皮生长因子、血细胞生长因子、成纤维细胞生长因子、血细胞发生的多种集落刺激因子等。许多组织的细胞还产生抑素,可抑制自身的增殖。细胞内cAMP浓度下降时,细胞分裂加快,反之减慢。
胚胎发生中广泛存在细胞定时死亡现象,称程序性细胞死亡(apoptosis)。它是器官正常发生的重要因素,唯其机制不明。如人胚的尾芽和鳃的定期消失;早期手和足都形似桨板,在预定指或趾之间的细胞死亡后,才能形成指或趾。又如循环系统发生过程中的某段动脉或静脉的定时退化、女性中肾管的定期退化、男性中肾旁管的定期消失等都属此例。
(三)胚胎组织的相互影响
在胚胎的细胞分化和形态发生中,组织或细胞之间常是互以对方为条件而相互影响的。当相互作用的一方导致另一方的发育发生变化时,称此现象为诱导(induction)。诱导的实例甚多,如脊索诱导其背侧的外胚层发生神经管;眼发生中的视泡诱导表面外胚层发生晶状体;肢芽中胚层诱导表面外胚层形成顶嵴,后者决定肢体的形态发育。还有多层次诱导现象,如视泡诱导形成晶状体,后者再诱导表面外胚层和邻近的间充质形成角膜。相互诱导作用的事例如在是肾的发生中,输尿管芽诱导生后肾组织形成肾小管,生后肾组织又诱导输尿管芽分支形成集合小管。诱导作用具有严格的组织特异性和发育时期的限制,若过程受到干扰,改变原有的时空关系,就可能发生先天性畸形。关于诱导作用的机理,虽有不少实验研究,但迄今仍无明确结论。