第一节 狂犬病病毒
狂犬病病毒(Rabies virus)为弹状病毒科(Rhabdoviridae)狂犬病毒属 (Lyssavirus) 中血清/基因1型病毒,而2~6型称“狂犬病相关病毒”,目前仅在非洲和欧洲发现。狂犬病病毒在野生动物(狼、狐狸、鼬鼠、蝙蝠等)及家养动物(狗、猫、牛等)与人之间构成狂犬病的传播环节。人主要被病兽或带毒动物咬伤后感染。一旦受染,如不及时采取有效防治措施,可导致严重的中枢神经系统急性传染病,病死率高,在亚非拉发展中国家中每年有数万人死于狂犬病。
一、生物学性状
(一)形态结构
病毒外形呈弹状(60~400nm×60~85nm),一端纯园,一端平凹,有囊膜,内含衣壳呈螺旋对称。核酸是单股不分节负链RNA。
基因组长约12kb,从3′到5′端依次为编码N、M1、M2、G、L蛋白的5个基因,各个基因间还含非编码的间隔序列。五种蛋白都具有抗原性。M1、M2蛋白分别构成衣壳和囊膜的基质。L蛋白为聚合酶。G蛋白在囊膜上构成病毒刺突,与病毒致病性有关,N蛋白为核蛋白有保护RNA功能。G蛋白和N蛋白是狂犬病病毒的主要抗原,刺激机体可诱生相应抗体和细胞免疫。过去一直认为G蛋白是唯一诱生中和抗体,并能提供狂犬病保护性免疫的抗原。而近年研究表明,除G蛋白外,该病毒的核糖核蛋白(RNP)在诱生保护性免疫应答上也起重要作用。
(二)培养
狂犬病病毒宿主范围广,可感染鼠,家兔、豚鼠、马、牛、羊、犬猫等,侵犯中枢神经细胞(主要是大脑海马回锥体细胞)中增殖,于细胞浆中可形成嗜酸性包涵体(内基氏小体Negri body)。在人二倍体细胞、地鼠肾细胞、鸡胚、鸭胚细胞中增养增殖,借此可用于制备组织培养疫苗。
(三)抗原型与变异
狂犬病病毒仅一种血清型,但其毒力可发生变异。从自然感染动物体内分离的病毒株称野毒株(Wild strain)或街上毒株 (Street strain),致病力强,自脑外接种易侵入脑组织及唾液腺。将野毒株在家兔脑内连续传50代后,家兔致病潜伏期逐渐缩短,2~4周缩短至4~6日,如再继续传代不再缩短,称固定毒株(Fixed Strain),固定毒株对人及动物致病力弱,脑外接种不侵入脑内增殖,不引起狂犬病,巴斯德首先创用固定制成减毒活疫苗,预防狂犬病。
(四)抵抗力
狂犬病病毒对热、紫外线、日光、干燥的抵抗力弱,加温50℃1小时、60℃5分钟即死,也易被强酸、强碱、甲醛、碘、乙酸、乙醚、肥皂水及离子型和非离子型去污剂灭活。于4℃可保存一周,如置50%苷油中于室温下可保持活性1周。
二、致病性与免疫性
(一)致病性
狂犬病是人兽共患性疾病,主要在野生动物及家畜中传播。人狂犬病主要被患病动物咬伤所致,或与汪畜密切接触有关。也可能通过不显性皮肤或粘膜而传播,如狗舔肛门,宰狗、切狗肉等引起感染。并有角膜移植引起感染的报告。在大量感染蝙蝠的密集区,其分泌液造成气雾,可引起呼吸道感染。
人被咬伤后,病毒进入伤口,先在该部周围神经背根神经节内,沿着传入感觉神经经纤维上行至脊髓后角,然后散布到脊髓和脑的各部位内增殖损害。在发病前数日,病毒从脑内和脊髓沿传出神经进入唾液腺内增殖,不断随唾液排出。潜伏期1~2个月,短者5~10天,长者1年至数年。潜伏期的长短取决于咬伤部位与头部距离远近、伤口的大小、深浅、有无衣服阻挡,以及侵入病毒的数量。有人认为病毒在犬群多次传播后毒力增强,可缩短潜伏期。
人发病时,先感不安,头痛,发热,侵入部位有刺痛或出现爬蚁走的异常感染。继而出现神经兴奋性增强,脉速、出汗、流涎、多泪、瞳孔放大,吞咽时咽喉肌肉发生痉挛,见水或其他轻微刺激可引起发作,故又名“恐水病”。最后转入麻痹、昏迷、呼吸及循环衰竭而死亡,病程大约5~7日。
(二)免疫性
机体感染病毒后产生的抗体除中和,补体介导溶解和抗体依赖细胞毒作用外,特异性lgg 抗体还能提高和调节T细胞对狂犬病病毒抗原反应,是接触狂犬病病毒后同时注射特异性抗体和疫苗的重要依据。细胞免疫也是抗狂犬病病毒主要免疫之一,如杀伤性T淋巴细胞针对靶抗原G,N蛋白可溶解病毒,单核细胞产生IFN和IL2对抑制病毒复制和抵抗病毒攻击起重要作用。
三、微生物学诊断
将咬人的狗捕获,观察10~14天,不发病,则可认为未患狂犬病。若观察期间发病,将它杀死,取脑作病理切片检查包涵体,或用荧光标记抗狂犬病毒血清染色,检查抗原,如为阴性,则用10%脑悬液注射小白鼠脑内,发病后取脑组织同上检测包涵体和抗原,可提高阳率,但需时较长约28天。如于发病前用同位素标记的合成寡核苷酸探针检测狂犬病毒RNA,于1-2天就出结果。
患者可采取唾液沉渣涂片,荧光抗体染色检查细胞内病毒抗原。或发病后2-3天作睑、颊皮肤活检,用荧光抗体染色,于毛囊周围神经纤维中可找见病毒抗原。亦可将狂犬病毒固定毒株感染细胞制成抗原片,加入不同稀释病人血清阻止荧光抗体染色以测定抗体,一般24小时可出结果。
四、防治原则
(一)公共卫生措施
捕杀野犬,加强家犬管理或口服兽用减毒活疫苗(与食物混合喂食)。预防家畜及野生动物的狂犬病是防止人狂犬病的重要根本措施,其任务涉及面广,需要全社会的配合支持与理解。
(二)咬伤处理
人被疑似狂犬咬伤时,立即用20%肥皂水冲洗和浸泡伤口,再涂碘酒或浓硝酸(只用于浓度咬伤),然后用碳酸氢钠冲洗。
(三)特异预防
用人狂犬病免疫球蛋白(20IU/kg)或抗狂犬病马血清(40IU/kg),以1/2时在伤口周围浸润注射,其余作肌肉注射。同时立即肌内注射人二倍体纤维母细胞狂犬病疫苗1次,于第一次注射后3,7,14,28天再行注射,共5次,可防止发病。我国应用自制的地鼠肾细胞狂犬病苗,已取得良好效果。目前研制成功狂犬病病毒糖蛋白重组痘苗病毒疫苗,狂犬病病毒G、N亚平位疫苗等,正在试用中。
第二节 人乳头瘤病毒
乳头瘤病毒属于乳多空病毒科(Papovaviridae)的乳头瘤病毒属,它包括多种动物的乳头瘤病毒和人乳头瘤病毒(Human papillomavirus ,HPV) 。HPV能引起人类皮肤和粘膜的多种良性乳头状瘤或疣,某些型别感染还具潜在的致癌性。
一、生物学性状
HPV是一种小的DNA病毒,直径45~55nm,衣壳呈二十面体立体对称,含72个壳微粒,没有囊膜,完整的病毒颗粒在氯化铯中浮密度为1.34g/ml,在密度梯度离心时易与无DNA的空壳(密度1.29g/ml)分开。
HPV基因组是一闭环双股DNA,分子量5×106道尔顿。按功能可分为早期区(E区)、晚期区(L区)和非编码区(NCR)三个区域。E区分为E1~E7开放阅读框架,主要编码与病毒复制、转录、调控和细胞转化有关的蛋白。L区分L1和L2,分别编码主要衣壳蛋白和次要衣壳蛋白。NCR是E区与L区间-6.4~1.0bp的DNA片段,可负责转录和复制的调控。
通过对HPV克隆基因的DNA杂交试验及酶谱分析,以核苷酸同源性少于50%定为新型别,至今已鉴定出70多型HPV。每一型别都与体内特定感染部位和病变有关。HPV各型之间有共同抗原,即属特异性抗原,存在于L1蛋白,它与牛乳头病毒(BPV)有交叉反应。L2蛋白为型特异性抗原,各型间不发生交叉反应。
HPV在体外细胞培养尚未完成。它具有宿主和组织特异性,只能感染人的皮肤和粘膜,不能感染动物。HPV感染后在细胞核内增殖,细胞核着色深,核周围有一不着色的空晕,此种病变细胞称为空泡细胞(Koilocytotic cell)。
二、致病性与免疫性
HPV主要通过直接或间接接触污染物品或性传播感染人类。病毒侵入人体后,停留于感染部位的皮肤和粘膜中,不产生病毒血症。临床常见的有:寻常疣(主要为1,2,4型)称刺瘊,可发生于任何部位,以手部最常见。跖疣(主要为2,4型)生长在胼胝下面,行走易引起疼痛。扁平疣(主要为3,10型)好发于面部,手、臂、膝、为多发性。尖性湿疣(主要为6,11型),好发于温暖潮湿部位,以生殖器湿疣发病率最高,传染性强,在性传播疾病中有重要地位,且有恶性变的报道。近年研究资料证明HPV与宫颈癌、喉癌、舌癌等发生有关。如HPV16,18,33等型与宫颈癌的发生关系密切,用核酸杂交方法检出癌组织中HPv DNA阳性率60%以上。
有关HPV免疫反应研究较少。在感染病灶出现1~2月内,血清内出现抗体,阳性率为50-90%,病灶消退后,抗体尚维持续数月到数年,但无保护作用。用白细胞移动抑制和淋巴细胞转化等试验检测细胞免疫(CMI)的结果不一致,有人观察到病灶消退时CMI增强。
三、微生物学诊断
疣的诊断主要依靠临床特点,对不能确诊的病例,可选下列各种方法辅助诊断。
(一)染色镜检:将疣状物作组织切片或生殖道局部粘液涂片,用帕尼科拉染剂染色后,光镜下观察到特征性空泡细胞或角化不良细胞和角化过度细胞,可初步HPV诊断。
(二)检测HPV DNA:根据不同标本采用点杂交或原位杂交检测HPV-DNA。亦可选择适当的特异序列,合成引物做PCR后进行杂交,PCR具有敏感,特异及可选择不同型别的引物扩增后分型等优点。
(三)血清学试验:应用重组技术表达抗原检测患者血清中lgG抗体。或抗原免疫动物制备免疫血清或单克隆抗体检测组织或局部粘液中HPV抗原。
四、防治原则
目前尚无特异预防方法,可根据HPV传染方式,切断传播途径,是有效的预防措施。
小的皮肤疣有自行消退的可能,一般无需处理。尖性湿疣病损范围大,可施行手术,但常规外科切除有较高复发率。一些物理疗法如电烙术、激光治疗、液氮冷冻疗法,有较好的治疗效果。用干扰素治生殖器HPV感染,结合上述一些辅助疗法,认为有广阔前景。
第三节 人类免疫缺陷病毒
本病毒为爱滋病人(Aids)的病原体,系引起细胞病变的灵长类逆转录病毒之一,属逆转录病科(Retroviridae)慢病毒亚科(Lentivirinae)。它于1983年 Montaginer 等首先从1例淋巴腺病综合征患者分离到,命名为淋巴腺病综合征相关病毒(LymphadenopathyAssociated Virus,LAS) 。随后1984年美国Gallo等从爱滋病人分离到逆转录病毒,命名为嗜人类T淋巴细胞病毒Ⅲ型(Human T Cell Lymphotropic Virus Type Ⅲ ,HTLV-Ⅲ),后来证明这二种病毒是一样的。至1986年国际病毒命名委员统一称为人类免疫缺陷病毒(Human Immunodificidncy Virus ,HIV) 。HIV主要型别为HIV-1和HIV-2,爱滋病大多由HIV-1引起。
一、生物学诊断
(一)形态结构
病毒呈球形,直径100~120nm,电镜下可见一致密的圆锥状核心,内含病毒RNA分子和酶(逆转录酶、整合酶、蛋白酶),病毒外层囊膜系双层脂质蛋白膜,其中嵌有gp120和gp41,分别组成刺突和跨膜蛋白。囊膜内面为P17蛋白构成的衣壳,其内有核心蛋白(P24)包裹RNA(图30-1)。
(二)基因结构及编码蛋白的功能
HIV基因组长约9.2~9.7kb,含gag、Pol、env、3个结构基因,及至少6个调控基因(Tat Rev、Nef、Vif、VPU、Vpr)并在基因组的5′端和3′端各含长末端序列(图30-2)。HIVLTR含顺式调控序列,它们控制前病毒基因的表达。已证明在LTR有启动子和增强子并含负调控区。
1.gag基因能编码约500个氨基酸组成的聚合前体蛋白(P55),经蛋白酶水解形成P17,P24核蛋白,使RNA不受外界核酸酶破坏。
2.Pol基因编码聚合酶前体蛋白(P34),经切割形成蛋白酶、整合酶、逆转录酶、核糖核酸酶H,均为病毒增殖所必需。
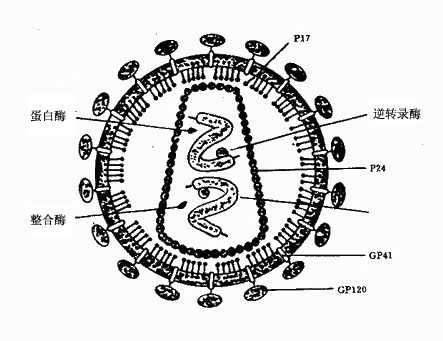
图30-1 HIV结构示意图
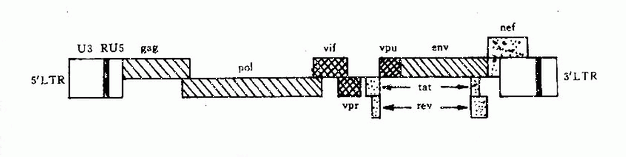
图30-2 HIV基因组结构
3.env基因编码约863个氨基酸的前体蛋白并糖基化成gp160,gp120和gp41。gp120含有中和抗原决定簇,已证明HIV中和抗原表位,在gp120 V3环上,V3环区是囊膜蛋白的重要功能区,在病毒与细胞融合中起重要作用。gp120与跨膜蛋白gp41以非共价键相连。gp41与靶细胞融合,促使病毒进入细胞内。实验表明gp41亦有较强抗原性,能诱导产生抗体反应。
4.TaT 基因编码蛋白(P14)可与LTR结合,以增加病毒所有基因转录率,也能在转录后促进病毒mRNA的翻译。
5.Rev基因产物是一种顺式激活因子,能对env和gag中顺式作用抑制序(Cis-Actingrepression sequance,Crs) 去抑制作用,增强gag和env基因的表达,以合成相应的病毒结构蛋白。
6.Nef基因编码蛋白P27对HIV基因的表达有负调控作用,以推迟病毒复制。该蛋白作用于HIv cDNA的LTR,抑制整合的病毒转录。可能是HIV在体内维持持续感集体所必需。
7.Vif基因对HIV并非必不可少,但可能影响游离HIV感染性、病毒体的产生和体内传播。
8.VPU基因为HIV-1所特有,对HIV的有效复制及病毒体的装配与成熟不可少。
9.Vpr基因编码蛋白是一种弱的转录激活物,在体内繁殖周期中起一定作用。
HIV-2基因结构与HIV-1有差别:它不含VPU基因,但有一功能不明VPX基因。核酸杂交法检查HIV-1与HIV-2的核苷酸序列,仅40%相同。env基因表达产物激发机体产生的抗体无交叉反应。
(三)培养特性
将病人自身外周或骨髓中淋巴细胞经PHA刺激48~72小时作体外培养(培养液中加IL2)1~2周后,病毒增殖可释放至细胞外,并使细胞融合成多核巨细胞,最后细胞破溃死亡。亦可用传代淋巴细胞系如HT-H9、Molt-4细胞作分离及传代。
HIV动物感染范围窄,仅黑猩猩和长劈猿,一般多用黑猩猩做实验。用感染HIV细胞或无细胞的HIV滤液感染黑猩猩,或将感染HIV黑猩猩血液输给正常黑猩猩都感染成功,边续8个月在血液和淋巴液中可持续分离到HIV,在3~5周后查出HIV特异性抗体,并继续维持一定水平。但无论黑猩猩或长臂猿感染后都不发生疾病。
(四)抵抗力
HIV对热敏感。56℃30min灭活,但在室温保存7天,仍保持活性。不加稳定剂病毒-70℃冰冻失去活性,而35%山梨醇或50%胎牛血清中-70℃冰冻3个月仍保持活性。对消毒剂和去污剂亦敏感,0.2%次氯酸钠0.1%漂白粉,70%乙醇,35%异丙醇、50%乙醚、0.3%H2O20.5%来苏尔处理5′能灭活病毒,1%NP-40和0.5%triton-X-100能灭活病毒而保留抗原性。外紫外线、γ射线有较强抵抗力。
二、病毒性与免疫性
(一)传染源和传播途径
HIV感染者是传染源,曾从血液、精液、阴道分泌液、眼泪、乳汁等分离得HIV。传播途径有:
1.性传播:通过男性同性恋之间及异性间的性接触感染。
2.血液传播:通过输血、血液制品或没有消毒好的注射器传播,静脉嗜毒者共享不经消毒的注射器和针头造成严重感染,据我国云南边镜静脉嗜毒者感染率达60%。
3.母婴传播:包括经胎盘、产道和哺乳方式传播。
(二)致病机制
HIV选择性地侵犯带有CD4分子的,主要有T4淋巴细胞、单核巨噬细胞、树突状细胞等。细胞表面CD4分子是HIV受体,通过HIV囊膜蛋白gp120与细胞膜上CD4结合后由gp41介导使毒穿入易感细胞内,造成细胞破坏。其机制尚未完全清楚,可能通过以下方式起作用:
1.由于HIV包膜蛋白插入细胞或病毒出芽释放导致细胞膜通透性增加,产生渗透性溶解。
2.受染细胞内CD-gp120复合物与细胞器(如高尔基氏体等)的膜融合,使之溶解,导致感染细胞迅速死亡。
3.HIV感染时未整合的DNA积累,或对细胞蛋白的抑制,导致HIV杀伤细胞作用。
4.HIV感染细胞表达的gp120能与未感染细胞膜上的CD4结合,在gp41作用下融合形成多核巨细胞而溶解死亡。
5.HIV感染细胞膜病毒抗原与特异性抗体结合,通过激活补体或介导ADCC效应将细胞裂解。
6.HIV诱导自身免疫,如gp41与T4细胞膜上MHCⅡ类分子有一同源区,由抗gp41抗体可与这类淋巴细胞起交叉反应,导致细胞破坏。
7.细胞程序化死亡(programmedcell death ):在爱滋病发病时可激活细胞凋亡 (Apoptosis) 。如HIV的gp120与CD4受体结合;直接激活受感染的细胞凋亡。甚至感染HIV的T细胞表达的囊膜抗原也可启动正常T细胞,通过细胞表面CD4分子交联间接地引起凋亡CD+4细胞的大量破坏,结果造成以T4细胞缺损为中心的严重免疫缺陷,患者主要表现:外周淋巴细胞减少,T4/T8比例配置,对植物血凝素和某些抗原的反应消失,迟发型变态反应下降,NK细胞、巨噬细胞活性减弱,IL2、γ干扰素等细胞因子合成减少。病程早期由于B细胞处于多克隆活化状态,患者血清中lg水平往往增高,随着疾病的进展,B细胞对各种抗原产生抗体的功能也直接和间接地受到影响。
爱滋病人由于免疫功能严重缺损,常合并严重的机会感染,常见的有细胞(鸟分枝杆菌)、原虫(卡氏肺囊虫、弓形体)、真菌(白色念珠菌、新型隐球菌)、病毒(巨细胞病毒、单纯疱疹病毒,乙型肝炎病毒),最后导致无法控制而死亡,另一些病例可发生Kaposis肉瘤或恶性淋巴瘤。此外,感染单核巨噬细胞中HIV呈低度增殖,不引起病变,但损害其免疫功能,可将病毒传播全身,引起间质肺炎和亚急性脑炎。
HIV感染人体后,往往经历很长潜伏期(3~5年或更长至8年)才发病,表明HIV在感染机体中,以潜伏或低水平的慢性感染方式持续存在。当HIV潜伏细胞受到某些因素刺激,使潜伏的HIV激活大量增殖而致病,多数患者于1-3年内为死亡。
(三)免疫性
HIV感染后可刺激机体生产囊膜蛋白(Gp120,Gp41)抗体和核心蛋白(P24)抗体。在HIV携带者、爱滋病病人血清中测出低水平的抗病毒中和抗体,其中爱滋病病人水平最低,健康同性恋者最高,说明该抗体在体内有保护作用。但抗体不能与单核巨噬细胞内存留的病毒接触,且HIV囊膜蛋白易发生抗原性变异,原有抗体失去作用,使中和抗体不能发的应有的作用。在潜伏感染阶段,HIV前病毒整合入宿主细胞基因组中,不被免疫系统识别,逃避免疫清除。这些都与HIV引起持续感染有关。
三、微生物学诊断
检测HIV感染者体液中病毒抗原和抗体的方法,操作方便,易于普及应用,其中抗体检测尤普通。但HIv P24抗原和病毒基因的测定,在HIV感染检测中的地位和重要性也日益受到重视。
(一)抗体检测
主要有酶联免疫吸附试验(ELISA)和免疫荧光试验(IFA)。ELISA用去污剂裂解HIV或感染细胞液提取物作抗原,IFA用感染细胞涂片作抗原进行抗体检测,如果发现阳性标本应重复一次。为防止假阳性,可做Westernblot (WB,蛋白印迹法)进一步确证。
WB法是用聚丙烯酰胺凝胶电泳将HIV蛋白进行分离,再经传移电泳将不同蛋白条带转移于硝酸纤维膜上,加入病人血清孵育后,用抗人球蛋白酶标抗体染色,就能测出针对不同结构蛋白抗体,如抗gp120、gp41、P24抗体,特异性较高。
(二)抗原检测
用ELISA检测P24抗原,在HIV感染早期尚未出现抗体时,血中就有该抗原存在.由于P24量太少,阳性率通常较低。现有用解离免疫复合物法或浓缩P24抗原,来提高敏感性。
(三)核酸检测
用PCR法检测HIV基因,具有快速、高效、敏感和特异等优点,目前该法已被应用于HIV感染早期诊断及艾滋病的研究中。
(四)病毒分离
常用方法为共培养法,即用正常人外周血液分离单个核细胞,加PHA刺激并培养后,加入病人单个核细胞诊断及艾滋病的研究中。
四、防治原则
自1981年发现爱滋病,随后在世界各地迅速蔓延,据WHO报告,至1995年1月1日全球累积的HIV感染得为2590万例,爱滋病人850万例,死亡病人700万例,其中非洲流行最严重,居首位,其次是东南亚地区。我国于1984年使用美国Ameur公司Ⅷ因子,首次传入,逐年增加,从1985年至1995年底累HIV感染者3341例,其中117例为爱滋病人,地理分布去最高,占80%左右,以嗜毒者为主。
由于爱滋病惊人的蔓延速度和高度的致死率,已引起WHO和许多国家的重视,普遍采用了一系列综合措施,主要包括:
(一)广泛地开展宣传教育,普及防治知识,认识本病传染源、传播方式及悲惨结局。
(二)建立HIV感染和爱滋病的监测系统,掌握流行动态。对高危人群实行监测,严格管理爱滋病人及HIV感染者。
(三)对供血者进行HIV抗体检测,确保输血和血液制品安全。
(四)加强国境检疫,防止本病传入。
特异预防,迄今尚缺理想疫苗。减毒活疫苗和灭活全病毒疫苗,由于难以保证疫苗安全,不宜人体应用。目前选择基因工程方法研制疫苗,如克隆囊膜蛋白基因、核心蛋白基因,在细胞和动物细胞中表达多肽作亚单位疫苗,或囊膜基因插入病毒或腺病毒中制备重组疫苗。最大问题是囊膜蛋白高度易变性,不同毒株HIVgp120有明显差别,使疫苗的使用受到了限制。现已证明包膜蛋白gp120的肽键中有一些区段的氨基酸序列比较保守恒定,用该保守恒定片段制备,将能解决问题。
目前用于治疗爱滋病的药物有叠氮脱氧胸苷(AZT)、苏拦明(Suramin)、双脱氧胞苷(ddc)、双脱氧面苷(ddl )等。AZT能干扰病毒DNA合成,从而抑制HIV在体内增殖,缓解症状,延长病人生存期。苏拉明对HIV的逆转录酶活性有抑制作用。ddc是最有效的HIV抑制剂,能明显减少HIV的复制和改善病人免疫功能。ddl抗病毒的范围比AZT和ddc 窄一些,但毒性较低,半衰期较长。
此外,发现许多抑制蛋白酶、阻止HIV与靶细胞结合或融合的药物,能分别作用于细胞感染的不同阶段,以达到抗HIV的效果,均尚处于研究阶段。
中草药中发现括蒌蛋白、贝母苷、甘草甜素、及地丁、空心苋、紫草等抽提物有抑HIV的作用。中药方制治疗爱滋病人也能缓解症状,都在研究和总结中。