软骨与骨是构成身体支架的器官,它们分别以软骨组织和骨组织为主要结构成分。在人的一生中,这两种组织尤其是骨组织能不断更新和改建,从而适应成年前机体的生长发育和成年后机体支持功能的变化需求。人体99%以上的钙和85%的磷以羟基磷灰石的形式贮于骨组织中,因而骨又是人体的钙、磷贮存库。
一、软骨
软骨(cartilage)由软骨组织及其周围的软骨膜构成。软骨是固态的结缔组织,略有弹性,能承受压力和耐磨擦,有一定的支持和保护作用。胎儿早期的躯干和四肢支架主要为软骨,至成体,软骨仅分布于关节面、椎间盘、某些骨连接部位、呼吸道及耳廓等处。软骨组织由软骨细胞、基质及纤维构成。根据软骨组织所含纤维的不同,可将软骨分为透明软骨、纤维软骨和弹性软骨三种。
(一)透明软骨
透明软骨(hyaline cartilage)分布较广,成体的关节软骨、肋软骨及呼吸道的一些软骨均属这种软骨。新鲜时呈半透明状,较脆,易折断。透明软骨间质中的纤维为胶原原纤维,含量较少,基质较丰富。
1.透明软骨的结构
(1)软骨细胞(chondrocyte):位于软骨基质内的小腔――软骨陷窝(cartilage lacuna)中。陷窝周围有一层含硫酸软骨素较多的基质,称软骨囊(cartilage capsule),染色时呈强嗜碱性。软骨细胞在软骨内的分布有一定规律,靠近软骨膜的软骨细胞较幼稚,体积小,呈扁圆形,单个分布;位于软骨中部的软骨细胞接近圆形,成群分布,每群有2~8个细胞,它们是由一个细胞分裂增生而成,故称同源细胞群(isogenous group)。同源细胞群中的细胞分别围以软骨囊。软骨细胞核呈椭圆形,细胞质弱嗜碱性。新鲜软骨的软骨细胞充满于软骨陷窝内。但在HE染色切片中,细胞收缩成不规则形,故软骨囊和细胞之间出现较大的空隙(图4-1)。软骨细胞的超微结构特点是胞质内有丰富的粗面内质网和发达的高尔基复合体,还有一些糖原和脂滴,线粒体较少(图4-2)。软骨细胞主要以糖酵解方式获得能量。
(2)基质:透明软骨基质的化学成分主要为嗜碱性软骨粘蛋白,它以长链的透明质酸分子为主干,干链上以许多较短的蛋白质链连接硫酸软骨素A、C和硫酸角质素(见图3-15)。这种羽状分支的大分子结合着大量的水,大分子又引互结合构成分子筛,并和胶原原纤维结合在一起形成固态结构。软骨内无血管,但由于软骨基质内富含水分(约占软骨基质的75%),通透性强,故软骨深层的软骨细胞仍能获得必需的营养。
(3)纤维:透明软骨中无胶原纤维,但有一些由Ⅱ型胶原组成的胶原原纤维,它们呈交织状分布(图4-2)。胶原原纤维直径为10~20nm,无明显横纹,其折光率与基质相近,故在光镜下不易分辨。软骨囊含硫酸软骨素较多,含胶原原纤维少或无,故嗜碱性较强。软骨囊之间则含胶原原纤维较多,故呈弱嗜酸性。
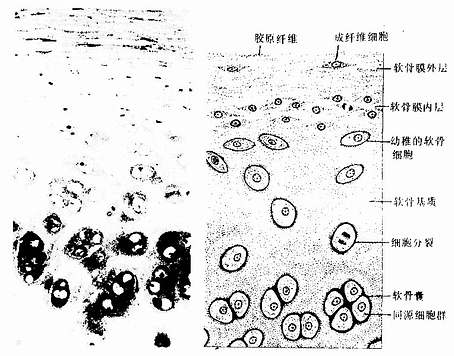
图4-1 透明软骨
左图为人气管透明软骨 HE×100
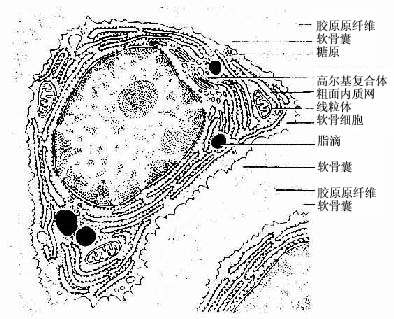
图4-2 透明软骨超微结构模式图
2.软骨膜 除关节面的关节软骨外,软骨的表面均覆有较致密的结缔组织,即软骨膜(perichondrium)。软骨膜分内、外二层,外层纤维多,细胞少,主要起保护作用,内层纤维少,细胞较多,其中有些梭形小细胞,称骨原细胞,可增殖分化为软骨细胞(图4-1)。软骨的营养来自软骨周围的血管,并可通过软骨膜渗透至软骨内部,供应软骨细胞。
3.软骨的生长方式 软骨有两种并存的生长方式
(1)间质生长(interstitial growth):或称软骨内生长,是通过软骨内软骨细胞的长大和分裂,进而不断地产生基质和纤维,使软骨从内部生长增大。
(2)外加生长(appositional growth):或称软骨膜下生长,是通过软骨膜内层的骨原细胞向软骨表面不断添加新的软骨细胞,产生基质和纤维,使软骨从表面向外扩大。
(二)纤维软骨
纤维软骨(fibrous cartilage)分布于椎间盘、关节盘及耻骨联合等处。结构特点是有大量呈平行或交错排列的胶原纤维束,软骨细胞较小而少,常成行分布于纤维束之间(图4-3)。HE染色切片中,胶原纤维染成红色,纤维束间的基质很少,呈弱嗜碱性,软骨囊则呈强嗜碱性。
(三)弹性软骨
弹性软骨(elastic cartilage)分布于耳廓及会厌等处。结构特点是间质中有大量交织分布的弹性纤维,软骨中部的纤维更为密集(图4-4)。弹性软骨具有较强的弹性。
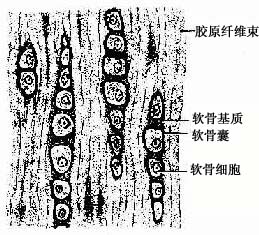
图4-3 纤维软骨
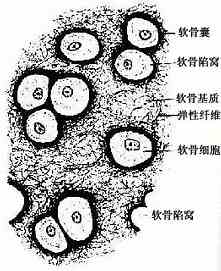
图4-4 弹性软骨
二、骨
骨由骨组织、骨膜及骨髓等构成。骨组织是坚硬而有一定韧性的结缔组织。
(一)骨组织的结构
骨组织(osseous tissue)由大量钙化的细胞间质及数种细胞组成。钙化的细胞间质称为骨基质(bone matrix)。细胞有骨原细胞、成骨细胞、骨细胞及破骨细胞四种。骨细胞最多,位于骨基质内,其余三种细胞均位于骨组织的边缘(图4-5)。
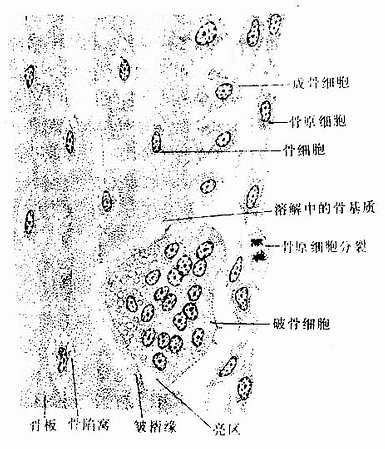
图4-5 骨组织和各种细胞
1.骨基质 即骨的细胞间质,由有机成分和无机成分构成,含水极少。有机成分由成骨细胞分泌形成,包括大量胶原纤维(占有机成分的95%)及少量无定形基质。无定形基质为凝胶,内含中性或弱碱性糖胺多糖,有粘着胶原原纤维的作用。基质中还含有两种钙结合蛋白:骨钙蛋白(osteocalcin)和骨磷蛋白(phosphophoryms)。前者有两个与钙亲合力强的部位,后者则有许多钙结合部位,但只有一部分骨磷蛋白是可溶性的,其余均与胶原纤维相结合。钙结合蛋白与钙化及钙的运输有关。无机成分又称骨盐(bone mineral),主要为羟磷灰石结晶(hydroxyapatite crystal,(Ca10(PO4)6( OH )2),属不溶性中性盐,呈细针状,长10~20nm,沿胶原原纤维长轴规则排列并与之结合。有机成分与无机成分的紧密结合使骨十分坚硬。
骨基质结构呈板层状,称为骨板(bone lamella),成层排列的骨板犹如多层木质胶合板。同一骨板内的纤维相互平行,相邻骨板的纤维则相互垂直,这种结构形式有效地增强了骨的支持力。
2.骨组织的细胞
(1)骨细胞(osteocyte):单个分散于骨板内或骨板间。骨细胞是有许多细长突起的细胞,胞体较小,呈扁椭圆形,其所在空隙称骨陷窝(bone lacuna),突起所在的空隙称骨小管(bone canaliculi)(图4-6)。相邻骨细胞的突起以缝隙连接相连,骨小管则彼此连通。骨陷窝和骨小管内含组织液,可营养骨细胞和输送代谢产物(图4-7)。骨陷窝周围的薄层骨基质钙化程度较低,并可不断更新,在机体需要时,骨细胞的溶骨作用可溶解此层骨基质,使Ca2+释放入骨陷窝的组织液中,继而进入血液,对维持血钙的恒态水平有一定作用。
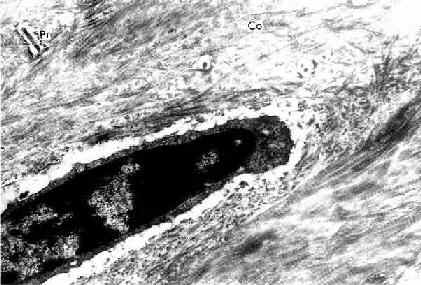
图4-6 小鼠骨细胞和骨基质(脱钙后)电镜像×25000
Pr骨细胞突起和骨小管,Co胶原原纤维
(上海医科大学电镜室供图)
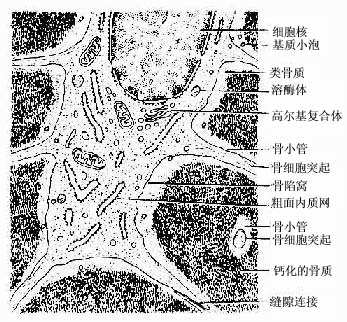
图4-7 骨细胞超微结构模式图
(2)骨原细胞(osteogenic cell):是骨组织中的干细胞,位于骨外膜及骨内膜贴近骨处。细胞较小,呈梭形,核椭圆形,细胞质少,弱嗜碱性。当骨组织生长或改建时,骨原细胞能分裂分化为成骨细胞(图4-5)。
(3)成骨细胞(osteoblast):分布在骨组织表面,成年前较多,常排成一层,成年后较少。成骨细胞是具有细小突起的细胞,胞体呈矮柱状或椭圆形,其突起常伸入骨质表层的骨小管内,与表层骨细胞的突起形成连接。核圆形,多位于细胞的游离端(图4-5)。胞质嗜碱性,电镜下可见大量粗面内质网和发达的高尔基复合体。成骨时,成骨细胞分泌骨基质的有机成分,称为类骨质(osteoid),同时以类似顶浆分泌的方式向类骨质中释放一些小泡,称基质小泡(matrix vesicle)。基质小泡直径约0.1μm,有膜包被,膜上有碱性磷酸酶、焦磷酸酶和ATP酶,泡内含钙和小的羟磷灰石结晶。一般认为,基质小泡是使类骨质钙化的重要结构。近年发现,骨基质中的钙结合蛋白均由成骨细胞分泌产生。当成骨细胞被类骨质包埋后,便成为骨细胞。
(4)破骨细胞(osteoclast):主要在骨组织表面,数目较少。破骨细胞是一种多核的大细胞,直径约100μm,含有2-50个核。目前认为它由多个单核细胞融合而成,无分裂能力。光镜下,破骨细胞贴近骨基质的一侧有纹状缘(图4-5),胞质呈泡沫状,在HE染色的切片中胞质易为伊红染色。电镜下可其贴近骨基质一侧有许多不规则的微绒毛,称为皱褶缘(ruffled border)(图4-8),即光镜下的纹状缘。在皱褶缘的周缘有一环形胞质区,内有多量微丝,而无其它细胞器,称为亮区(clear zone)。亮区的细胞膜平整并紧贴于骨基质表面,形成一道环形胞质围墙,使所包围的区域成为封闭的微环境区。破骨细胞功能活跃时,向此区释放多种蛋白酶、碳酸酐酶、乳酸及柠檬酸等,在酶及酸的作用下使骨基质溶解。皱褶缘可增大吸收面积,电镜下可见皱褶缘基部有吞饮泡和吞噬泡,泡内含小骨盐晶体及解体的有机成分,表明破骨细胞有溶解和吸收骨基质的作用。
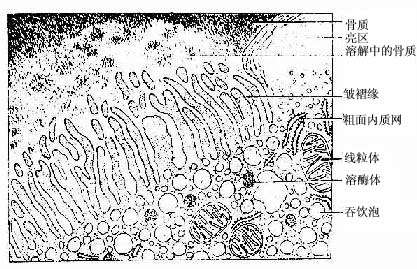
图4-8 破骨细胞超微结构模式图
(二)长骨的结构
长骨由骨松质、骨密质、骨膜、关节软骨及血管、神经等构成。
1.骨松质(spongy bone) 分布于长骨的骨骺和骨干的内侧份,是大量针状或片状骨小梁相互连接而成的多孔隙网架结构,网孔即骨髓腔,其中充满骨髓。骨小梁厚度一般为0.1-0.4mm,由数层平行排列的骨板和骨细胞构成(图4-9)。骨小管穿行表层骨板开口于骨髓腔,骨细胞从中获得营养并排出代谢产物。
2.骨密质(compact bone) 分布于长骨骨干和骨骺的外侧份。骨密质内的骨板排列很有规律,按骨板排列方工可分为环骨板、骨单位和间骨板。
(1)环骨板(circumferential lamella):分布于长骨干的外侧面及近骨髓腔的内侧面,分别称为外环骨板及内环骨板。外环骨板较厚,约有10~40层,较整齐地环绕骨干排列(图4-9)。内环骨板较薄,仅由数层骨板组成,排列不甚规则。外环骨板及内环骨板均有横向穿越的小管,统称穿通管(perforating canal,又称Volkmann管)。穿通管与纵行排列的骨单位中央管相通连(图4-9),它们都是小血管、神经及骨膜成分的通道,并含有组织液。
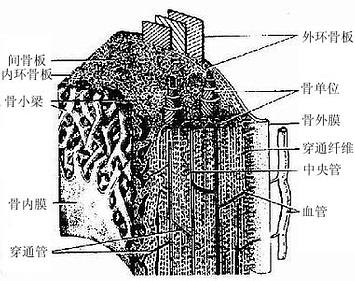
图4-9 长骨骨干结构模式图
(2)骨单位(osteon):又称哈弗系统(Haversian system),是长骨干起支持作用的主要结构单位。骨单位位于内、外环骨板之间在,数量较多,呈筒状,直径30~70μm,长0.6~2.5mm,由10~20层同心圆排列的骨板(哈弗骨板)围成。各层骨板之间有骨细胞。各层骨细胞的突起经骨小管穿越骨板相互连接。骨单位的中轴有一中央管(central canal),或称哈弗管(Haversian canal)(图4-9,4-10),内含骨膜组织、毛细血管(有的是微动静脉)和神经。
各个骨单位表面都有一层厚约2μm的粘合质,是一层含骨盐多而胶原纤维少或缺如的骨基质,在骨的横磨片上呈折光较强的轮廓线,称粘合线(cement line)(图4-10)。骨单位周边部的骨小管都在粘合线以内返折,不与相邻单位表面的骨小管通连。骨单位最内层的骨小管均开口于中央管,使每一骨单位内的骨细胞均能通过相互通连的骨小管获得营养。骨的内、外环骨板与骨单位交界处也有粘合线,但不如骨单位之间的明显。
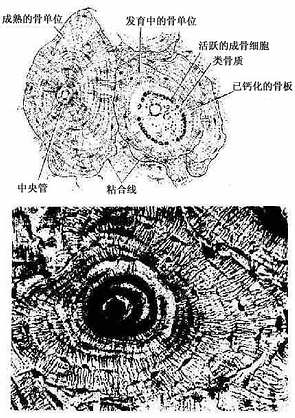
图4-10 骨单位
下图为人骨脱钙后冷冻切片硫堇染色×400
(上海医科大学组织胚胎学教研室供图)
(3)间骨板(interstitial lamella): 是填充在骨单位之间的一些不规则的平行骨板,它们是原有的骨单位或内外环骨板未被吸收的残留部分,其中除骨陷窝及骨小管外,无其它管道(图4-9)。
3.骨膜 除关节面以外,骨的内、外表面分别覆以骨内膜和骨外膜。骨外膜(periosteum)分为两层:外层较厚,为致密结缔组织,纤维粗大而密集,有的纤维横向穿入外环骨板,称穿通纤维(perforating fiber)或Sharpey纤维,起固定骨膜和韧带的作用;内层较薄,结缔组织疏松,含骨原细胞和成骨细胞及小血管和神经。在骨髓腔面、骨小梁的表面、中央管及穿通管的内表面均衬有薄层结缔组织,即骨内膜(endosteum)。骨内膜的纤维细而少,细胞常排列成一层,颇似单层扁平上皮,细胞之间有缝隙连接,它们与骨细胞突起之间也有缝隙连接。这些细胞能分裂分化为成骨细胞。还有人认为这种细胞具有离子屏障功能,其作用是分隔骨细胞周液和骨髓腔内的组织液,使骨细胞周液维持一定的钙、磷浓度,有利于骨盐结晶的形成。
三、骨的发生
骨由间充质发生。从胚胎早期间充质向骨原基分化起始,到骨发育完善为止,历时约20年以上。骨的发育经历为断生长与改建的复杂演变,具体表现为两个方面,即骨组织形成与骨组织分解吸收,两者相辅相成。骨发育完善后,仍保持形成与分解吸收交替进行的内部改建,终身不止,但改建速度随年龄增长而逐渐缓慢。
骨的发生有两种方式:膜内成骨(intramembranous ossification)与软骨内成骨(endochondral ossification)
(一)膜内成骨
这种方式是先由间充质分化成为胚性结缔组织膜,然后在此膜内成骨。人体的顶骨、额骨和锁骨等即以此种方式发生。膜内成骨的具体的过程是:在将要形成骨的部位,血管增生,营养及氧供丰富;间充质细胞渐密集并分裂分化为骨原细胞,其中部分骨原细胞增大,成为成骨细胞;成骨细胞分泌类骨质,并被包埋其中,成为骨细胞;继而类骨质钙化成骨基质,形成最早出现的骨组织。最早形成骨组织的部位称为骨化中心(ossification center)。新形成的骨组织表面始终有成骨细胞或骨原细胞附着,它们向周围成骨,逐渐形成初级骨小梁(图4-11),构成初级骨松质。随后,初级骨松质周围的间充质分化为骨膜,此后即进入生长与改建阶段。以顶骨为例,随着脑的发育,原始顶骨也不断生长与改建,其外表面以成骨为主,使骨不断生长,内表面以分解吸收为主,为断改变骨的曲度,从而使顶骨的生长与脑的发育相适应。通过生长与内部改建,顶骨出现了以初级骨密质组成的外板与内板,以及其间由骨松质组成的板障,但至成年才发育完善。成年后其内部改建仍缓慢地进行。
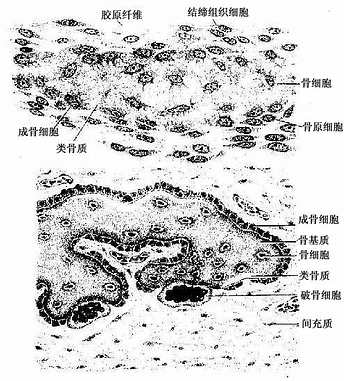
图4-11 膜内成骨过程
上图 骨化中心,类骨质形成 下图 形成初级骨小梁
(二)软骨内成骨
胎儿的大多数骨,如四肢骨、躯干骨及颅底骨等,均主要以软骨内成骨的方式发生。这种骨发生既包括与膜内成骨相似的发生过程,又包括软骨的持续生长与退化,以及软骨组织不断被骨组织取代的特有发生过程,而且其发生、生长与改建穿插交错的情况远较膜内成骨复杂。现以长骨的发生为例(图4-12)叙述如下。
1.软骨雏形形成在长骨将要发生的部位,间充质细胞密集并分化出骨原细胞,后者继而分化为软骨细胞。软骨细胞分泌软骨基质,细胞也被包埋其中,成为软骨组织。周围的间充质分化为软骨膜,于是形成一块透明软骨。其外形与将要形成的长骨相似,被称为软骨雏形(cartilage model)。
2.软骨周骨化 是指软骨雏形中段周围产的骨形成。其过程先是软骨膜内出现血管,由于营养及氧供应充分,软骨膜深层的骨原细胞分裂并分化为成骨细胞。成骨细胞在软骨表面产生类骨质,自身也被包埋其中而成为骨细胞。类骨质随后钙化为骨基质,于是形成一圈包绕软骨中段的薄层初级骨松质。因此层骨松质犹如领圈,故名骨领(bone collar)。骨领表面的软骨膜从此改称骨外膜。骨外膜深层的骨原细胞不断分化为成骨细胞,向骨领表面及其两端添加新的骨小梁,使骨领的初级骨松质逐渐增厚,并从软骨中段向两端延伸。随着胚胎的发育,骨领初级骨松质中的成骨细胞不断向骨小梁壁上添加骨组织,使骨小梁的网孔逐渐变小。此过程的持续使初级骨松质逐渐成为初级骨密质。
3.软骨内骨化
(1)软骨退化与初级骨化中心形成:在骨领形成的同时,软骨雏形中段内的软骨细胞肥大并分泌碱性磷酸酶,使其周围的软骨基质钙化及肥大的软骨细胞自身退化死亡,留下较大的软骨陷窝。此变化示初级骨化中心即将在该区形成。初级骨化中心(primary ossification center)形成之初,血管连同破骨细胞及间充质等经骨外膜穿越骨领,进入退化软骨区,通过破骨细胞分解吸收钙化的软骨基质,形成许多与原始骨干长轴平行的隧道。隧道的壁为残存的钙化软骨基质,隧道的腔即初级骨髓腔。腔内充以来自间充质的骨原细胞和成骨细胞,以及破骨细胞和正在形成中的造血组织等,统称初级骨髓(primary bone marrow)。随后成骨细胞贴附于原始骨髓腔壁上(即残留的钙化软骨基质表面)生成骨组织,形成以钙化软骨基质为中轴表面附以骨组织的过渡型骨小梁。最开始出现过渡型骨小梁的部位即初级骨化中心。
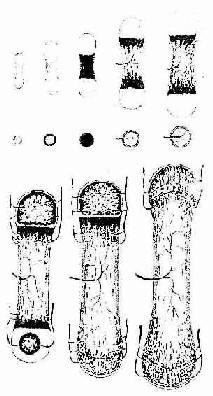
图4-12 软骨内成骨过程
中排为上排中段的横切面,小点示透明软骨,黑色
示钙化软骨基质,斜线示骨组织
(2)骨髓腔形成与骨的增长:初级骨化中心的过渡型骨小梁不久便被破骨细胞分解吸收,使许多初级骨髓腔合成一个较大的次级骨髓腔。骨领的内表面也逐渐被破骨细胞分解吸收。骨领的这种边形成边分解吸收的成骨过程,使骨干在增粗的同时保持骨组织的适当厚度,并使骨髓腔得以横向扩大。由于初级骨化中心两端的软骨组织不断生长,紧邻骨髓腔的软骨又不断退化,使初级骨化中心的骨化过程得以从骨干中段持续向两端进行,骨髓腔也随之纵向扩展。胎儿长骨的纵切面上,在骨的两端可观察到软骨内骨化的连续过程,表现为从软骨至骨干中段的骨髓腔之间,可依次分为下列代表成骨活动的四区(彩图4-13)。
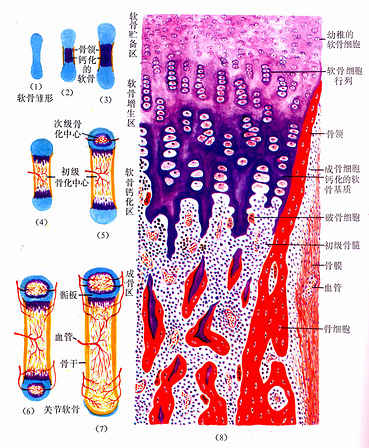
图4-13 长骨发生与生长 (1)~(7)示软骨内成骨及长骨生长
(8)示软骨被骨取代过程
软骨储备区(zone of reserve cartilage):软骨细胞较小,分散存在。软骨基质呈弱嗜碱性。
软骨增生区(zone of proliferating cartilage):软骨细胞较大,通过分裂形成的同源细胞群纵列成行,形成软骨细胞柱。
软骨钙化区(zone of calcifying cartilage):软骨细胞肥大,呈空泡状,核固缩,可见退化死亡软骨细胞留下的大陷窝。钙化的软骨基质呈强嗜碱性。
成骨区(zone of ossification):可见中轴为钙化软骨基质和表面为骨组织的过渡型骨小梁,小梁之间为隧道式初级骨髓腔。腔内有造血组织及血管,腔壁(即骨小梁表面)可见成骨细胞附着,破骨细胞也附骨小梁表面,附着处有凹陷,表明此处的骨基质已被分解吸收。
(3)次级骨化中心出现及骨骺形成:次级骨化中心(secondary ossification center)出现的时间因骨而异,早自出生前,晚至出生后数月或数年不等。出现的部位在骨干两端的软骨中央。次级骨化中心的发生过程与初级骨化中心相似。但骨化是从中央呈辐射状向四周进行的。最后以初级骨松质取代绝大部分软骨组织,使骨干两端转变成为早期骨骺。骺端表面始终保留薄层软骨,即关节软骨。早期骨骺与骨干之间亦保留一定厚度的软骨层,即骺软骨,称骺板(epiphyseal plate)(图4-12,4-13)。骺板软骨细胞继续分裂增殖及退化,破骨细胞及成骨细胞则不断从骨髓腔侧分解吸收钙化的软骨基质,并形成过渡型骨小梁,使骨化不断向两端推进,长骨因而不断增长(图4-14)至17-20岁时,骺板停止生长而被骨小梁取代,在长骨的干、骺之间留下线性痕迹,称为骺线(epiphyseal line)。早期骨骺通过生长及改建,最终形成内部为骨松质、表面为薄层骨密质的骨骺。
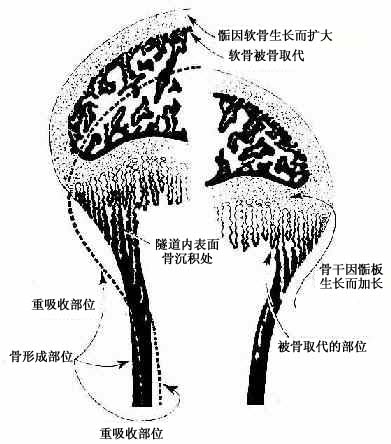
图4-14骨干骨密质形成和外形变化及骨骺发育示意图
(4)骨干骨密质形成及改建:构成原始骨干的初级骨松质,通过骨小梁增厚而使小梁之间的网孔变小,逐渐成为初级骨密质。初级骨密质中既无骨单位及间骨板,也不存在外、内环骨板。至1岁左右,由于破骨细胞在原始骨密质外表面顺长轴进行分解吸收,渐形成凹向深面的纵沟。骨外膜的血管及骨原细胞等随之进入沟内,由骨原细胞分化为成骨细胞造骨,先将纵沟封闭成管,再贴附于管壁表面,形成自外向内呈同心圆式排列的哈弗骨板。其中轴始终保留一条血管通道,即中央管。管内尚存的骨原细胞贴附于最内层哈弗骨板内表面,成为骨内膜。此即第一代骨单位(哈弗系统)的形成过程(图4-15)。第一代骨单位的形成是在初级骨密质被分解吸收的基础上进行的,故此代骨单位之间有残存的初级骨密质。以后第一代骨单位逐渐被第二代骨单位取代,残留的第一代骨单位片段便成为第二代骨单位之间的间骨板(图4-16)。后代骨单位取换前代的过程,称为骨单位改建。骨单位的出现与改建使初级骨密质成为次级骨密质。骨干伴随骨单位的相继形成而增粗,骨髓腔也因而明显扩大,成年后骨干不再增长,其内、外表面已出现环骨板。外环骨板的增厚约止于30岁左右,发育完善的骨干从此不再增粗,但其内部的骨单位改建仍持续进行。
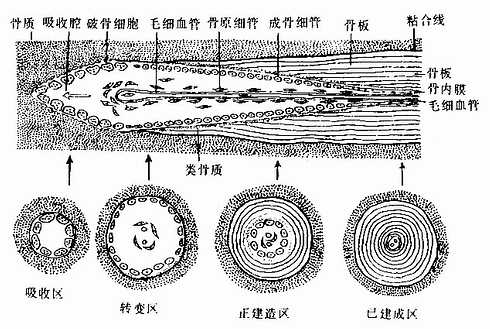
图4-15 骨单位形成过程模式图
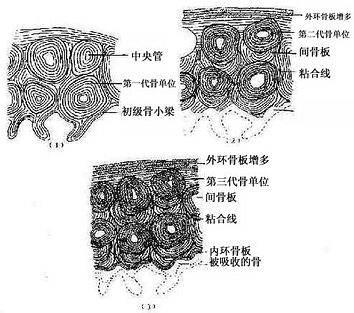
图4-16 骨密质改建示意图
(三)影响骨生长的因素
影响骨生长的因素很多,内因如遗传基因的表达和激素的作用等,外因如营养及维生素供应等。生长激素和甲状腺素可明显促进骺板软骨生长,若成年前这两种激素分泌过少,可致骺板软骨生长缓慢,肢体短小而成侏儒;若生长激素分泌过多,则骺板生长加速,可导致巨人症。甲状旁腺素通过反馈机制调节血钙水平,其调节方式是激活骨细胞和破骨细胞,通过溶骨作用分解骨盐,释放Ca2+入血,从而提高血钙水平。甲状旁腺素过多,有可能因骨盐大量分解而导致纤维性骨炎。降钙素能抑制骨盐溶解,并刺激骨原细胞分化为成骨细胞,增强成骨活动,使血钙入骨形成骨盐。雌激素可与成骨细胞膜上的雌激素受体结合,使其成骨活跃,产生足量的钙结合蛋白,促进类骨质的钙化。雌激素不足往往出现骨盐分解吸收过多,骨基质形成减少,绝经期妇女的骨质疏松症即起因于雌激素的不足。性腺发育不全可导致生长障碍而影响身高,肾上腺分泌的糖皮质激素对骨的形成有抑制作用。
维生素A可影响骨的生长速度,严重缺乏时骺板生长缓慢,以致骨生长迟缓甚至停止,维生素A过多则使破骨细胞过度活跃而易发生骨折,维生素C与成骨细胞合成胶原纤维有关,严重缺乏时,因骨的胶原纤维过少而易发生骨折,且骨折愈合极为缓慢。维生素D能影响骨钙的沉积,与类骨质能否及时钙化有关。儿童期缺乏维生素D可导致佝偻病,成人缺乏可导致骨软化症。近年发现成骨细胞表面有1,25-羟维生素D3(简称D3)受体,D3既可刺激成骨细胞分泌较多的钙结合蛋白,又能提高性碱性磷酸酶的活性而促进骨的钙化,临床疗效较好。
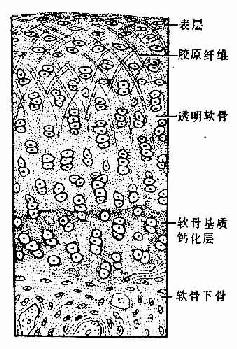
图4-17 关节软骨
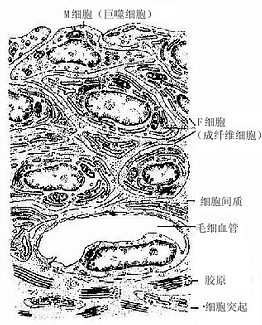
图4-18 滑腊超微结构模图
新近还发现骨内存在一些生物活性物质,通过分离和纯化骨的各种细胞和骨体外培养等研究,已肯定有些活性物质是由成骨细胞产生的。这些活性物质分别对成骨细胞及破骨细胞起激活或抑制作用,有的表现出旁分泌或自分泌作用。由于这些物质的改建密切有关,因此有人认为骨内存在着使骨生成与骨分解吸收相偶联的偶联因子。例如转化生长因子-β(TGF-β)、前列腺素、白细胞介素1和6、巨噬细胞释放的肽刺激因子等。
其它如细胞外钙、氧自由基特别是超氧阴离子、二萜烯等均能影响骨的生长发育。
四、关节
关节分可动与不可动两大类型。可动关节的结构比较复杂,由关节软骨、关节囊及滑液等构成。
1.关节软骨 关节软骨(articular cartilage)为关节表面的薄层透明软骨,表面光滑,附有滑液,可减小关节运动时的磨擦力。关节软骨与一般的透明软骨有一定差异,表层的细胞较小,单个分布,深层的细胞较大,成行分布,近骨部的软骨基质钙化,钙化的软骨组织与骨骺的骨组织相连接,整个关节软骨基质内的胶原原纤维呈拱形排列,有加固软骨组织的作用(图4-17)。关节软骨的营养由滑液供应。
2.关节囊 关节囊(articular capsule)可分内外两层。外层纤维排列紧密,与腱和韧带相连处明显增厚;内层较疏松,称为滑膜(synovial membrane)。滑膜内层常被覆2~4层扁平或立方形的上皮样结缔组织细胞,称为滑膜细胞(synovial cell),其基部无基膜,细胞间避孕药少量间质或纤维。电镜下可区分出两种滑膜细胞,一种似巨噬细胞,称M细胞,含溶酶体较多,有吞噬力;另一种似成纤维细胞,称F细胞,含粗而内质网较多,能分泌透明质酸和一些粘蛋白,组成滑液(图4-18)。
3.滑液 滑液(synovial fluid)是关节囊内的少量透明粘性液体,其中除含大量水、透明质酸和粘液蛋白外,还含有少量细胞,主要为淋巴细胞和巨噬细胞。若所含细胞数量增多(>300个/μ1),特别是中性粒细胞增多,可作为病变的指征。