第一节 概 述
脂类是机体内的一类有机大分子物质,它包括范围很广,其化学结构有很大差异,生理功能各不相同,其共同理化性质是不溶于水而溶于有机溶剂。
一、脂类的分类及其功能
脂类分为两大类,即脂肪(fat)和类脂(lipids)
(一)脂肪:即甘油三脂或称之为脂酰甘油(triacylglycerol),它是由1分子甘油与3个分子脂肪酸通过酯键相结合而成。人体内脂肪酸种类很多,生成甘油三脂时可有不同的排列组合,因此,甘油三脂具有多种形式。贮存能量和供给能量是脂肪最重要的生理功能。1克脂肪在体内完全氧化时可释放出38kJ(9.3kcal),比1克糖原或蛋白质所放出的能量多两倍以上。脂肪组织是体内专门用于贮存脂肪的组织,当机体需要时,脂肪组织中贮存在脂肪可动员出来分解供给机体能量。此外,脂肪组织还可起到保持体温,保护内脏器官的作用。
(二)类脂:包括磷脂(phospholipids),糖脂(glycolipid)和胆固醇及其酯(cholesterol and cholesterol ester)三大类。磷脂是含有磷酸的脂类,包括由甘油构成的甘油磷脂(phosphoglycerides)和由鞘氨醇构成的鞘磷脂(sphingomyelin)。糖脂是含有糖基的脂类。这三大类类脂是生物膜的主要组成成分,构成疏水性的“屏障”(barrier),分隔细胞水溶性成分和细胞器,维持细胞正常结构与功能。此外,胆固醇还是脂肪酸盐和维生素D3以及类固醇激素合成的原料,对于调节机体脂类物质的吸收,尤其是脂溶性维生素(A,D,E,K)的吸收以及钙磷代谢等均起着重要作用。
二、脂类的消化和吸收
正常人一般每日每人从食物中消化60?50克的脂类,其中甘油三脂占到90%以上,除此以外还有少量的磷脂、胆固醇及其酯和一些游离脂肪酸(free fattyacids)。食物中的脂类在成人口腔和胃中不能被消化,这是由于口腔中没有消化脂类的酶,胃中虽有少量脂肪酶,但此酶只有在中性PH值时才有活性,因此在正常胃液中此酶几乎没有活性(但是婴儿时期,胃酸浓度低,胃中PH值接近中性,脂肪尤其是乳脂可被部分消化)。脂类的消化及吸收主要在小肠中进行,首先在小肠上段,通过小肠蠕动,由胆汁中的胆汁酸盐使食物脂类乳化,使不溶于水的脂类分散成水包油的小胶体颗粒,提高溶解度增加了酶与脂类的接触面积,有利于脂类的消化及吸收。在形成的水油界面上,分泌入小肠的胰液中包含的酶类,开始对食物中的脂类进行消化,这些酶包括胰脂肪酶(pancreatic lipase),辅脂酶(colipase),胆固醇酯酶(pancreatic cholesteryl ester hydrolase or cholesterol esterase)和磷脂酶A2(phospholipase A2)。
食物中的脂肪乳化后,被胰脂肪酶催化,水解甘油三酯的1和3位上的脂肪酸,生成2-甘油一酯和脂肪酸。此反应需要辅脂酶协助,将脂肪酶吸附在水界面上,有利于胰脂酶发挥作用。
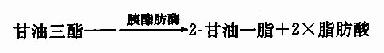
食物中的磷脂被磷脂酶A2催化,在第2位上水解生成溶血磷脂和脂肪酸,胰腺分泌的是磷脂酶A2原,是一种无活性的酶原形成,在肠道被胰蛋白酶水解释放一个6肽后成为有活性的磷脂酶A2催化上述反应。
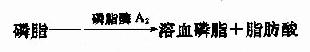
食物中的胆固醇酯被胆固醇酯酶水解,生成胆固醇及脂肪酸。

食物中的脂类经上述胰液中酶类消化后,生成甘油一酯、脂肪酸、胆固醇及溶血磷脂等,这些产物极性明显增强,与胆汁乳化成混合微团(mixed micelles)。这种微团体积很小(直径20nm),极性较强,可被肠粘膜细胞吸收。
脂类的吸收主要在十二指肠下段和盲肠。甘油及中短链脂肪酸(<=10C)无需混合微团协助,直接吸收入小肠粘膜细胞后,进而通过门静脉进入血液。长链脂肪酸及其它脂类消化产///物随微团吸收入小肠粘膜细胞。长链脂肪酸在脂酰CoA合成酶(fattyacyl CoA synthetase)催化下,生成脂酰CoA,此反应消耗ATP。
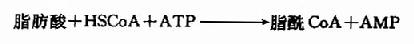
脂酰CoA可在转酰基酶(acyltransferase)作用下,将甘油一酯、溶血磷脂和胆固醇酯化生成相应的甘油三酯、磷脂和胆固醇酯。体内具有多种转酰基酶,它们识别不同长度的脂肪酸催化特定酯化反应。
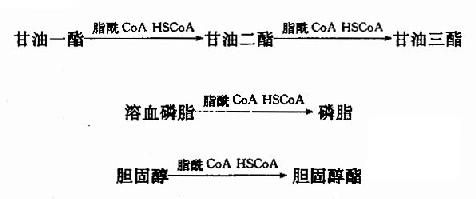
这些反应可看成脂类的改造过程,即将食物中动、植物的脂类转变为人体的脂类。
在小肠粘膜细胞中,生成的甘油三酯、磷脂、胆固醇酯及少量胆固醇,与细胞内合成的载脂蛋白(apolipprotein)构成乳糜微粒(chylomicrons),通过淋巴最终进入血液,被其它细胞所利用。可见,食物中的脂类的吸收与糖的吸收不同,大部分脂类通过淋巴直接进入体循环,而不通过肝脏。因此食物中脂类主要被肝外组织利用,肝脏利用外源的脂类是很少的(见图5-5)。
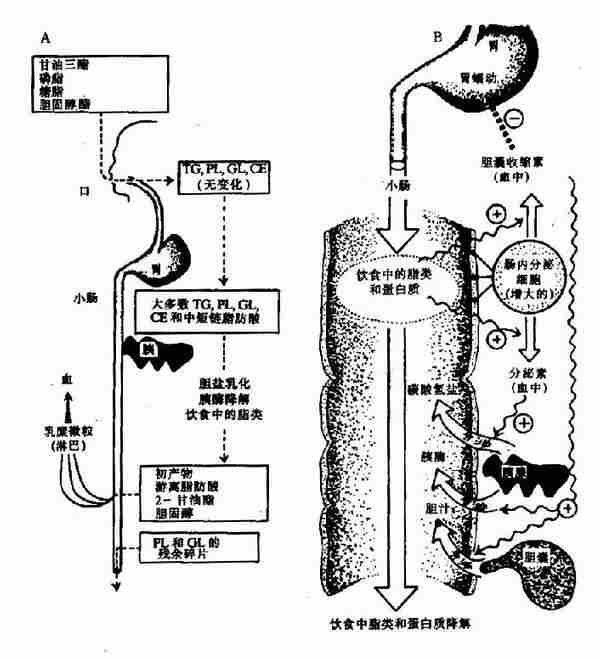
图5-1 脂类消化 A.概貌 B.小肠中脂类代谢的激素控制
第二节 血脂及其代谢
血浆中含有的脂类统称为血酯,包括甘油三酯、磷脂、胆固醇及其酯和非酯化脂肪(non?esterified fatty acid),亦称游离脂肪酸(free fatty acid,简写FFA)。血脂在脂类的运输和代谢上起着重要作用。血脂只占体重的0.04%,其含量受到饮食、营养、疾病等因素的影响,因而是临床上了解患者脂类代谢情况的一个重要窗口。正常人血脂含量见表5?。它们是以脂蛋白的形式存在并运输的,脂蛋白由脂类与载脂蛋白结合而形成。脂蛋白具有微团结构,非极性的甘油三酯、胆固醇酯等位于核心,外周为亲水性的载脂蛋白和胆固醇磷脂等的极性基因,这样使脂蛋白具有较强水溶性,可在血液中运输(图5-2)。
表5-1 正常成人空腹血脂的主要成分和含量
| 脂类物质 |
含量(毫克/100毫升血浆) |
脂类物质 |
含量(毫克/100毫升血浆) |
| 脂类总重 |
400-700(500) |
胆固醇 |
105-260(200) |
| 甘油三酯 |
10-160(100) |
酯型 |
90-260(145) |
| 磷脂 |
150-250(200) |
自由型 |
40-70(55) |
| 磷脂酰胆碱 |
80-225(110) |
脂肪酸总量 |
110-485(300) |
| 磷脂酰乙醇胺 |
0-30(10) |
非酯化型化脂肪酸 |
5-20 |
| 神经磷脂 |
10-50(30) |
|
|
注:括弧内为平均值
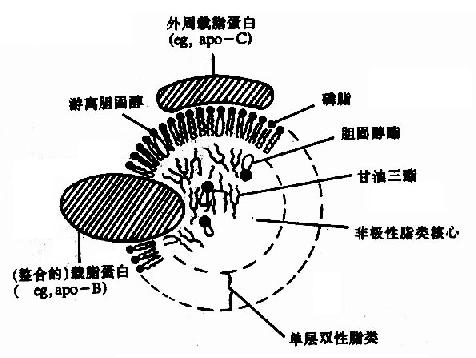
图5-2 血浆脂蛋白的一般结构
一、血浆脂蛋白的分类
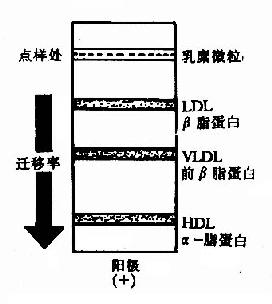
图5-3 血浆脂蛋白的电泳行为
血液中的脂蛋白不是单一的分子形式,其脂类和蛋白质的组成有很大的差异,因此血液中的脂蛋白存在多种形式。根据它们各自的特性采用不同的分类方法,可将它们进行多种分类,一般采用电泳法和超速离心法进行血浆脂蛋白的分类。
(一)电泳分类法
本法根据不同脂蛋白所带表面电荷不同,在一定外加电场作用下,电泳迁移率不同,可将血浆脂蛋白分为四类。如以硝酸纤维素薄膜为支持物,电泳结果是:α-脂蛋白泳动最快,相当于α1-球蛋白的位置;前β脂蛋白次之,相当于α2-球蛋白位置;β-脂蛋白泳动在前-β之后,相当于β-球蛋白的位置;乳糜微粒停留在点样的位置上(见图5-3)。
(二)超速离心法
本法依据不同脂蛋白中蛋白质脂类成分所占比例不同,因而分子密度不同(甘油三酯含量多者密度低,蛋白质含量多的分子密度高),在一定离心力作用下,分子沉降速度或漂浮率不同,将脂蛋白分为四类,即乳糜微粒(chylomicrons)、极低密度脂蛋白(very low densitylipoprotein,VLDL)、低密度脂蛋白(lowdensity lipoprotein,LDL)和高密度脂蛋白(highdensitylipoprotein,HDL);分别相当于电泳分离中的乳糜微粒、前β脂蛋白、β脂蛋白和α脂蛋白。除上述几类脂蛋白以外,还有一种中间密度脂蛋白(intermediate density lipoprotein,IDL)其密度位于VLDL与LDL之间,这是VLDL代谢的中间产物。HDL在代谢过程中分子中蛋白与脂类成分有变化,可将HDL再分为HDL1、HDL2与HDL3。HDL1是在高胆固醇膳食时才出现,HDL2为成熟的HDL,HDL3为新生的HDL,其分子中蛋白成分多。
血浆中的游离中短链脂肪酸可与血浆白蛋白结合而被运输,称之为脂酸白蛋白。由于脂类染色时脂肪酸不着色,所以不易观察,实际上它的位置与白蛋白相当。
二、血浆脂蛋白的组成
(一)脂蛋白中脂类的组成特点:
除脂酸白蛋白外,各类脂蛋白均含有甘油三酯、磷脂、胆固醇及其酯。但组成比例有很大差异,其中甘油三酯在乳糜微粒中含量为最高,达其化学组成的90%左右。磷脂含量以HDL为最高,达40%以上。胆固醇及其酯以LDL中最多,几乎占其含量50%。VLDL中以甘油三酯含量为最多,达60%(见表5-2)。
表5-2 血浆脂蛋白的组成
| 组成 |
| 分类 |
密度 |
颗粒直径 |
S1 |
电泳 |
蛋白质 |
总脂 |
占总脂的% |
合成 |
功能 |
|
|
(mm) |
|
位置 |
|
|
甘油 |
|
胆固 |
|
游离 |
部位 |
|
|
|
|
|
|
% |
% |
|
磷脂 |
|
胆固醇 |
|
|
|
|
|
|
|
|
|
|
三酯 |
|
醇 酯 |
|
脂肪酸 |
|
|
| CM |
<0.95 |
90- |
>400 |
原点 |
1-2 |
98-99 |
88 |
8 |
3 |
1 |
|
小肠粘 |
转运外源性情 |
|
|
1000 |
|
|
|
|
|
|
|
|
|
膜细胞 |
甘油三酯 |
| VLDL |
0.95- |
30- |
20- |
α2球 |
7-10 |
90-93 |
56 |
20 |
15 |
8 |
1 |
肝细胞 |
转运内源性 |
| 前β脂蛋白 |
1.006 |
90 |
400 |
蛋白 |
|
|
|
|
|
|
|
|
甘油三酯 |
| LDL |
1.006- |
20-25 |
2-20 |
β球 |
21 |
79 |
13 |
28 |
48 |
10 |
1 |
血浆 |
转运内源性 |
| β脂蛋白 |
1.063 |
|
|
蛋白 |
|
|
|
|
|
|
|
|
胆固醇 |
| HDL |
1.063- |
12-20 |
沉降 |
α1球 |
33 |
67 |
16 |
43 |
61 |
10 |
4 |
肝肠 |
转运外源 |
| α脂蛋白 |
1.125 |
|
|
蛋白 |
|
|
|
|
|
|
|
血浆 |
性胆固醇 |
| HDL2 |
1.125 |
7.5-10 |
沉降 |
α1球 |
57 |
43 |
13 |
46 |
29 |
6 |
6 |
肝肠 |
转运内源性 |
| HDL3 |
1.120 |
|
|
蛋白 |
|
|
|
|
|
|
|
血浆 |
胆固醇 |
(二)载脂蛋白(apoprotein,apo)
脂蛋白中与脂类结合的蛋白质称为载脂蛋白,载脂蛋白在肝脏和小肠粘膜细胞中合成。目前已发现了十几种载脂蛋白,结构与功能研究比较清楚的有apoA、apoB、apoC、apoD与apoE五类。每一类脂蛋白又可分为不同的亚类,如apoB分为B100和B48;apoC分为CⅠ、CⅡ、CⅢ等。载脂蛋白在分子结构上具有一定特点,往往含有较多的双性α-螺旋结构,表现出两面性,分子的一侧极性较高可与水溶剂及磷脂或胆固醇极性区结合,构成脂蛋白的亲水面,分子的另一侧极性较低可与非极性的脂类结合,构成脂蛋白的疏水核心区。
载脂蛋白的主要功能是稳定血浆脂蛋白结构,作为脂类的运输载体。除此以外有些脂蛋白还可作为酶的激活剂:如apoAI激活卵磷脂胆固醇脂酰转移酶(lecithin?cholesteroltransferase.LCAT),apoCⅡ可激活脂蛋白脂肪酶(lipoproteinlipase,LPL)。有些脂蛋白也可作为细胞膜受体的配体:如apo B-48,apoE参与肝细胞对CM的识别,apoB-100可被各种组织细胞表面LDL受体所识别等(见表5-3)。
表5-3 血浆脂蛋白的载脂蛋白
| 载脂蛋白 |
脂蛋折 |
氨基酸数 |
分子量 |
来源 |
功能 |
含量 |
| AⅠ |
HDL,CM |
243 |
28.300 |
肝、肠 |
激活LCAT;HDL受体配基 |
121.8±13.7* |
| AⅡ |
HDL,CM |
77 |
17.500 |
肝、肠 |
稳定HDL结构?抑制LCAT? |
33.0±5.0* |
| AⅣ |
CM,HDL |
371 |
46.000 |
肠 |
功能不清(促进CM合成?) |
17±2△ |
| B-100 |
LDL,VLDL,IDL |
4536 |
512,723 |
肝 |
LDL受体配基(识别LDL受体) |
87.3±143* |
| B-48 |
CM,CM残粒 |
|
265 000 |
肠 |
促进CM合成 |
5△ |
| CⅠ |
VLDL,HDL,CM |
57 |
6,500 |
肝 |
激活LCAT? |
7.8±2.4* |
| CⅡ |
VLDL,HDL,CM |
79 |
8,800 |
肝 |
激活肝外LPL |
5.0±1.8* |
| CⅢ |
VLDL,HDL,CM |
79 |
8,900 |
肝 |
抑制LPL,抑制肝apoE受体 |
11.8±3.6* |
| D |
HDL |
|
22,100 |
肝? |
功能不清(转达运胆固醇酯? |
10±4△ |
|
VLDL,HDL,CM |
|
|
|
LDL受体配基,肝CM残受体) |
|
| E |
CM残粒 |
299 |
34,000 |
肝 |
(apoE受体)配基 |
3.5±1.2* |
*华西医科大学生化教研室对625例成都地区正常成人测定的结果。△国外报导参考值。
LCAT:卵磷脂胆固醇脂酰转移酶 LPL:脂蛋白脂肪酶
(三)脂蛋白的代谢
1.乳糜微粒(CM)
乳糜微粒是在小肠粘膜细胞中生成的,食物中的脂类在细胞滑面内质网上经再酯化后与粗面内质网上合成的载脂蛋白构成新生的(nascent)乳糜微粒(包括甘油三酯、胆固醇酯和磷脂以及poB48),经高尔基复合体分泌到细胞外,进入淋巴循环最终进入血液。
新生乳糜微粒入血后,接受来自HDL的apoC和apoE,同时失去部分apoA,被修饰成为成熟的乳糜微粒。成熟分子上的apoCⅡ可激活脂蛋白脂肪酶(LPL)催化乳糜微粒中甘油三酯水解为甘油和脂肪。此酶存在于脂肪组织、心和肌肉组织的毛细血管内皮细胞外表面上。脂肪酸可被上述组织摄取而利用,甘油可进入肝脏用于糖异生。通过LPL的作用,乳糜微粒中的甘油三酯大部分被水解利用,同时apoA、apoC、胆固醇和磷脂转移到HDL上,CM逐渐变小,成为以含胆固醇酯为主的乳糜微粒残余颗粒(remnant)。肝细胞膜上的apoE受体可识别CM残余颗粒,将其吞噬入肝细胞,与细胞溶酶体融合,载脂蛋白被水解为氨基酸,胆固醇酯分解为胆固醇和脂肪酸,进而可被肝脏利用或分解,完成最终代谢(图5-4)。
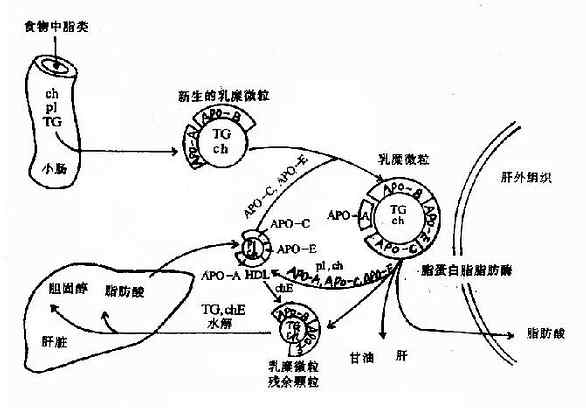
图5-4 乳糜微粒(CM)的代谢过程
TG:甘油三酯;pL:磷脂;Ch:胆固醇;ChE:胆固醇酯;ApO:载脂蛋白;HDL:高密度脂蛋白。
由此可见,CM代谢的主要功能就是将外源性甘油三酯转运至脂肪、心和肌肉等肝外组织而利用,同时将食物中外源性胆固醇转运至肝脏。
2.极低密度脂蛋白(VLDL)
VLDL主要在肝脏内生成,VLDL主要成分是肝细胞利用糖和脂肪酸(来自脂动员或乳糜微粒残余颗粒)自身合成的甘油三酯,与肝细胞合成的载脂蛋白apoB100、apoAI和apoE等加上少量磷脂和胆固醇及其酯。小肠粘膜细胞也能生成少量VLDL。
VLDL分泌入血后,也接受来自HDL的apoC和apoE:apoCⅡ激活LPL,催化甘油三酯水解,产物被肝外组织利用。同时VLDL与HDL之间进行物质交换,一方面是将apoC和apoE等在两者之间转移,另一方面是在胆固醇酯转移蛋白(cholesteryl ester transfer protein)协助下,将VLDL的磷脂、胆固醇等转移至HDL,将HDL的胆固醇酯转至VLDL,这样VLDL转变为中间密度脂蛋白(IDL)。IDL有两条去路:一是可通过肝细胞膜上的apoE受体而被吞噬利用,另外还可进一步入被水解生成LDL(图5-5)。
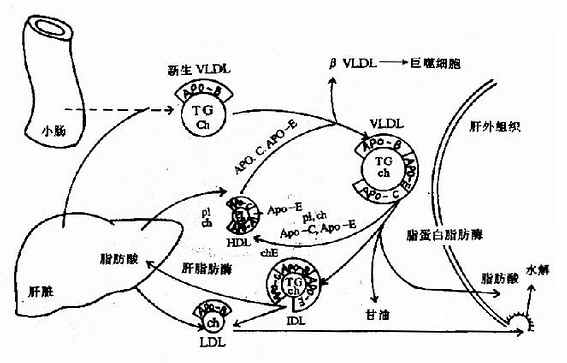
图5-5 极低密度脂蛋白(VLDL)的代谢过程
IDL:中间密度脂蛋白;LDL:低密度脂蛋白;
由此可见,VLDL是体内转运内源性甘油三酯的主要方式。
3.低密度脂蛋白(LDL)
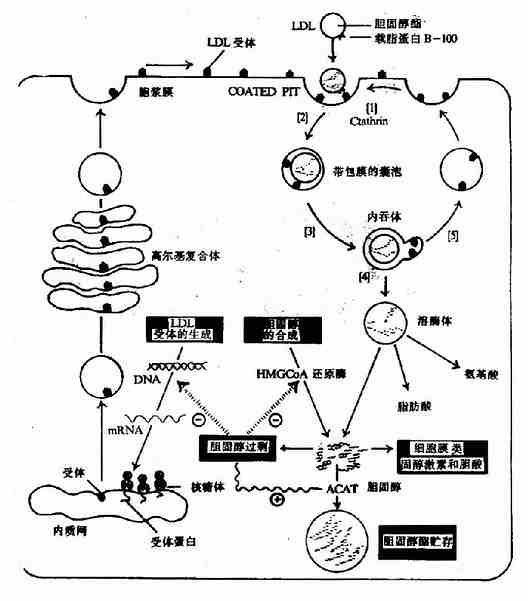
图5-6 细胞对LDL的摄取和降解
LDL由VLDL转变而来,LDL中主要脂类是胆固醇及其酯,载脂蛋白为apoB100。
LDL在血中可被肝及肝外组织细胞表面存在的apoB100受体识别,通过此受体介导,吞入细胞内,与溶酶体融合,胆固醇酯水解为胆固醇及脂肪酸。这种胆固醇除可参与细胞生物膜的生成之外,还对细胞内胆固醇的代谢具有重要的调节作用:①通过抑制HMG?CoA还原酶(HMG?Coa reductase)活性,减少细胞内胆固醇的合成;②激活脂酰CoA胆固醇酯酰转移酶(acyl CoA:cholesterol acyltransferase,ACAT)使胆固醇生成胆固醇酯而贮存;③抑制LDL受体蛋白基因的转录,减少LDL受体蛋白的合成,降低细胞对LDL的摄取(图5-6)。
除上述有受体介导的LDL代谢途径外,体内内皮网状系统的吞噬细胞也可摄取LDL(多为经过化学修饰的LDL),此途径生成的胆固醇不具有上述调节作用。因此过量的摄取LDL可导致吞噬细胞空泡化。
从以上可以看出,LDL代谢的功能是将肝脏合成的内源性胆固醇运到肝外组织,保证组织细胞对胆固醇的需求。
4.高密度脂蛋白(HDL)
HDL在肝脏和小肠中生成。HDL中的载脂蛋白含量很多,包括apoA、apoC、apoD和apoE等,脂类以磷脂为主。
HDL分泌入血后,新生的HDL为HDL3,一方面可作为载脂蛋白供体将apoC和apoE等转移到新生的CM和VLDL上,同时在CM和VLDL代谢过程中再将载脂蛋白运回到HDL上,不断与CM和VLDL进行载脂蛋白的变换。另一方面HDL可摄取血中肝外细胞释放的游离胆固醇,经卵磷脂胆固醇酯酰转移酶(LCAT)催化,生成胆固醇酯。此酶在肝脏中合成,分泌入血后发挥活性,可被HDL中apoAI激活,生成的胆固醇酯一部分可转移到VLDL。通过上述过程,HDL密度降低转变为HDL2。HDL2最终被肝脏摄取而降解(图5-7)。
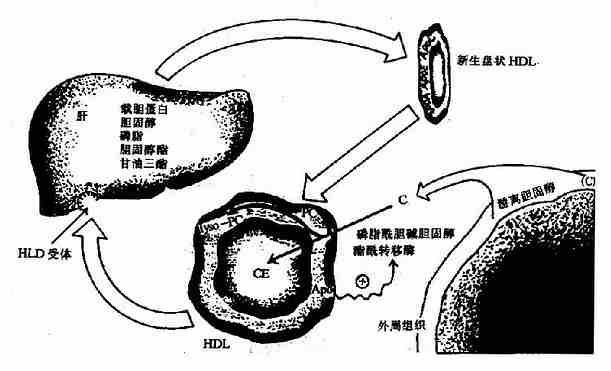
图5-7 HDL代谢 PC表示磷脂酰胆碱,Lyso?PC表示溶解性磷脂酰胆碱
由此可见,HDL的主要功能是将肝外细胞释放的胆固醇转运到肝脏,这样可以防止胆固醇在血中聚积,防止动脉粥样硬化,血中HDL2的浓度与冠状动脉粥样硬化呈负相关。
(四)高脂蛋白血症
血浆脂蛋白代谢紊乱可以表现为高脂蛋白血症和低脂蛋白血症,后者较为少见,现只介绍高脂蛋白血症。
高脂蛋白血症(hyperlipoproteinemia)亦称高脂血症(hyperlipidemia),因实际上两者均系血中脂蛋白合成与清除紊乱所致。这类病症可以是遗传性的,也可能是其他原因引起的,表现为血浆脂蛋白异常、血脂增高等,现将其六种主要类型列于表5-4。
表5-4 高脂蛋白血症的类型
| 类型 |
脂蛋白变化 |
血脂的变化 |
|
|
|
主要升高的脂类 |
次要升高的脂类 |
病因 |
| Ⅰ |
CM增高 |
甘油三酯 |
胆固酯 |
LPL或apoCⅡ遗传缺陷 |
| Ⅱa |
LDL增高 |
胆固醇 |
|
LDL受体的合成或功能的遗传缺陷 |
| Ⅱb |
LDL VLDL增高 |
甘油三酯 |
胆固醇 |
遗传因素影不大,主要受膳食影响 |
| Ⅲ |
LDL增高 |
甘油三酯胆固醇 |
|
apoE异常于扰了CM及VLDL残粒的吸收 |
| Ⅳ |
VLDL增高 |
甘油三酯 |
胆固醇 |
分子缺陷不清,多由于肥胖,饮酒过量或糖尿病所致 |
| Ⅴ |
CM VLDL增高 |
甘油三酯 |
胆固醇 |
实际为型Ⅰ和Ⅳ型的混合症 |
第三节 甘油三酯代谢
甘油三酯是人体内含量最多的脂类,大部分组织均可以利用甘油三酯分解产物供给能量,同时肝脏、脂肪等组织还可以进行甘油三酯的合成,在脂肪组织中贮存。
一、甘油三酯的分解代谢
脂肪组织中的甘油三酯在一系列脂肪酶的作用下,分解生成甘油和脂肪酸,并释放入血供其它组织利用的过程,称为脂动员。
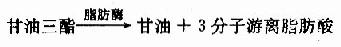
在这一系列的水解过程中,催化由甘油三酯水解生成甘油二酯的甘油三酯脂肪酶是脂动员的限速酶,其活性受许多激素的调节称为激素敏感脂肪酶(hormone sensitive lipase,HSL)。胰高血糖素、肾上腺素和去甲肾上腺素与脂肪细胞膜受体作用,激活腺苷酸环化酶,使细胞内cAMP水平升高,进而激活cAMP依赖蛋白激酶,将HSL磷酸化而活化之,促进甘油三酯水解,这些可以促进脂动员的激素称为脂解激素(lipolytichormones)。胰岛素和前列腺素等与上述激素作用相反,可抑制脂动员,称为抗脂解激素(antilipolytichormones)(见图5-8)。
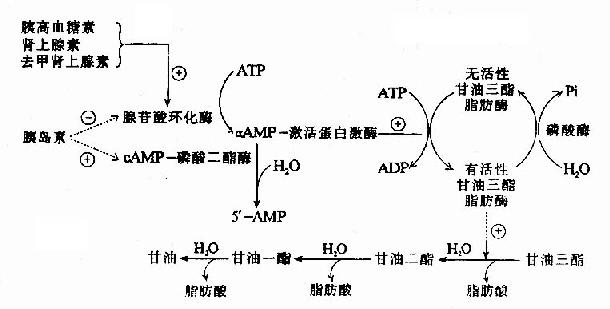
图5-8 激素影响甘油三酯脂肪酶活性的作用机理
脂动员生成的脂肪酸可释放入血,与白蛋白结合形成脂酸白蛋白运输至其它组织被利用。但是,脑及神经组织和红细胞等不能利用脂肪酸,甘油被运输到肝脏,被甘油激酶催化生成3磷酸甘油,进入糖酵解途径分解或用于糖异生。脂肪和肌肉组织中缺乏甘油激酶而不能利用甘油。
二、甘油三酯合成代谢
人体可利用甘油、糖、脂肪酸和甘油一酯为原料,经过磷脂酸途径和甘油一酯途径合成甘油三酯。
(一)甘油一酯途径
以甘油一酯为起始物,与脂酰CoA共同在脂酰转移酶作用下酯化生成甘油三酯。

(二)磷脂酸途径
磷脂酸即3磷酸?1,2甘油二酯,是合成含甘油脂类的共同前体。糖酵解的中间产物类磷酸二羟丙酮在甘油磷酸脱氢酶作用下,还原生成α磷酸甘油(或称3磷酸甘油);游离的甘油也可经甘油激酶催化,生成α磷酸甘油(因脂肪及肌肉组织缺乏甘油激酶,故不能利用激离的甘油)。α磷酸甘油在脂酰转移酶(acyl transferase)作用下,与两分子脂酰CoA反应生成3磷酸?1,2甘油二酯即磷脂酸(phosphatidic acid)。此外,磷酸二羟丙酮也可不转为α磷酸甘油,而是先酯化,后还原生成溶血磷脂酸,然后再经酯化合成磷脂酸(图5-9)。
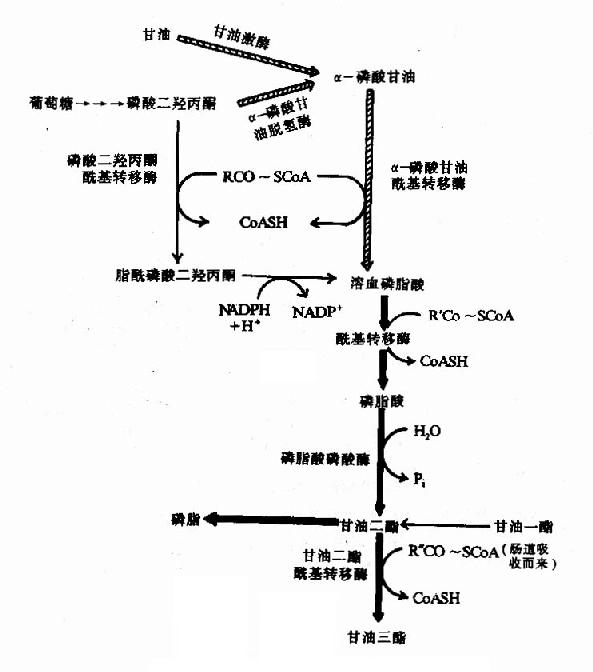
图5-9 甘油三酯的合成
注:图中粗线表示生成磷脂酸的主要途径
磷脂酸在磷脂酸磷酸酶作用下,水解释放出无机磷酸,而转变为甘油二酯,它是甘油三酯的前身物,只需酯化即可生成甘油三酯。
甘油三酯所含的三个脂肪酸可以是相同的或不同的,可为饱和脂肪酸或不饱和脂肪酸。
甘油三酯的合成速度可以受激素的影响而改变,如胰岛素可促进糖转变为甘油三酯。由于胰岛素分泌不足或作用失效所致的糖尿病患者,不仅不能很好利用葡萄糖,而且葡萄糖或某些氨基酸也不能用于合成脂肪酸,而表现为脂肪的氧化速度增加,酮体生成过多,其结果是患者体重下降。此外,胰高血糖素、肾上腺皮质激素等也影响甘油三酯的合成。
(三)不同组织甘油三酯合成特点
不同的组织细胞中甘油三酯的合成各有特点,下面主要讨论肝脏、脂肪组织和小肠粘膜上皮细胞合成甘油三酯的特点。
1.肝脏 肝脏可利用糖、甘油和脂肪酸作原料,通过磷脂酸途径合成甘油三酯。脂肪酸的来源有脂动员来的脂肪酸,由糖和氨基酸转变生成的脂肪酸和食物中来的外源性脂肪酸(食物中脂肪消化吸收后经血入肝的中短链脂肪酸,乳糜微粒残余颗粒中脂肪分解生成的脂肪酸)。
肝细胞含脂类物质约4-7%,其中甘油三酯约占1/2,甘油三酯含量过高会引起脂肪肝,正常情况下,肝脏合成的甘油三酯和磷脂、胆固醇、载脂蛋白一起形成极低密度脂蛋白,分泌入血。若磷脂合成障碍或载脂蛋白合成障碍就会影响甘油三酯转运出肝,引起脂肪肝。另外,若进入肝脏的脂肪酸过多,合成甘油三酯的量超过了合成载脂蛋白的能力,也可引起脂肪肝。
2.脂肪组织 脂肪组织甘油三酯的合成与肝脏基本相同,二者的区别是脂肪组织不能利用甘油,只能利用糖分解提供的α-磷酸甘油;脂肪组织能大量储存甘油三酯。
3.小肠粘膜上皮细胞 小肠粘膜上皮细胞合成甘油三酯有两条途径。在进餐后,食物中的甘油三酯水解生成游离脂肪酸和甘油一酯。吸收后经甘油?酯途径合成甘油三酯。这些甘油三酯参与乳糜微粒的组成。这一途径是小肠粘膜甘油三酯合成的主要特点。而在饥饿情况下,小肠粘膜也能利用糖、甘油和脂肪酸作原料,经磷脂酸途径合成甘油三酯,这一部分甘油三酯参与极低密度脂蛋白组成。此时的合成原料和过程又类似于肝脏。
这三种组织中甘油三酯合成的特点可总结如下表。
表5-5 不同组织中甘油三酯合成的特点
| 小肠粘膜上皮细胞 |
| 主要合成途径 |
|
进餐后 |
空腹 |
肝脏 |
脂肪组织 |
|
|
甘油-酯途径 |
磷脂酸途径 |
磷脂酸途径 |
磷脂酸途径 |
| a-磷酸甘油的来源 |
糖 |
否 |
可 |
可 |
可 |
|
甘油 |
否 |
可 |
可 |
否 |
| 主要中间产物 |
|
甘油二酯 |
磷脂酸 |
磷脂酸 |
磷脂酸 |
| 甘油三酯可否贮存 |
|
否 |
否 |
否 |
可 |
| 动员或分泌形式 |
|
乳摩微粒 |
极低密度脂度蛋白 |
极低密度脂蛋白 |
FFA+甘油 |
| 生理功能 |
|
合成外源性TC |
合成内源性TC |
合成内源性TC |
贮存甘油三酯 |
有关甘油三酯合成代谢的调节目前了解甚少。
第四节 脂肪酸代谢
一、脂肪酸的氧化分解
脂肪酸在有充足氧供给的情况下,可氧化分解为CO2和H2O,释放大量能量,因此脂肪酸是机体主要能量来源之一。肝和肌肉是进行脂肪酸氧化最活跃的组织,其最主要的氧化形式是β-氧化。
(一)脂肪酸的β-氧化过程
此过程可分为活化,转移,β-氧化共三个阶段。
1.脂肪酸的活化
和葡萄糖一样,脂肪酸参加代谢前也先要活化。其活化形式是硫酯:脂肪酰CoA,催化脂肪酸活化的酶是脂酰CoA合成酶(acyl CoA synthetase)。
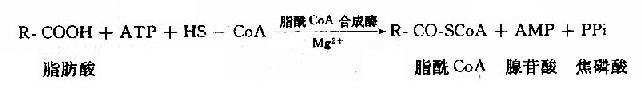
活化后生成的脂酰CoA极性增强,易溶于水;分子中有高能键、性质活泼;是酶的特异底物,与酶的亲和力大,因此更容易参加反应。
脂酰CoA合成酶又称硫激酶,分布在胞浆中、线粒体膜和内质网膜上。胞浆中的硫激酶催化
中短链脂肪酸活化;内质网膜上的酶活化长链脂肪酸,生成脂酰CoA,然后进入内质网用于甘油三酯合成;而线粒体膜上的酶活化的长链脂酰CoA,进入线粒体进入β-氧化。
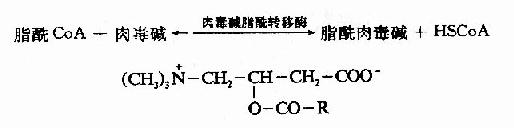
2.脂酰CoA进入线粒体:催化脂肪酸β-氧化的酶系在线粒体基质中,但长链脂酰CoA不能自由通过线粒体内膜,要进入线粒体基质就需要载体转运,这一载体就是肉毒碱(carnitine),即3-羟-4-三甲氨基丁酸。
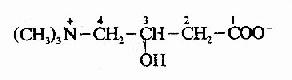
长链脂肪酰CoA和肉毒碱反应,生成辅酶A和脂酰肉毒碱,脂肪酰基与肉毒碱的3?羟基通过酯键相连接。
催化此反应的酶为肉毒碱脂酰转移酶(carnitineacyl transferase)。线粒体内膜的内外两侧均有此酶,系同工酶,分别称为肉毒碱脂酰转移酶I和肉毒碱脂酰转移酶Ⅱ。酶Ⅰ使胞浆的脂酰CoA转化为辅酶A和脂肪酰肉毒碱,后者进入线粒体内膜。位于线粒体内膜内侧的酶Ⅱ又使脂肪酰肉毒碱转化成肉毒碱和脂酰CoA,肉毒碱重新发挥其载体功能,脂酰CoA则进入线粒体基质,成为脂肪酸β-氧化酶系的底物(图5-10)。
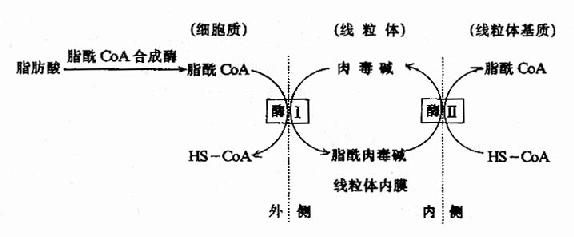
图5-10 肉毒碱参与脂酰辅酶A转入线粒体示意图
酶Ⅰ:位于线粒体内膜外侧的肉毒碱脂酰转移酶
酶Ⅱ:位于线粒体内膜内侧的肉毒碱脂酰转移酶
长链脂酰CoA进入线粒体的速度受到肉毒碱脂酰转移酶Ⅰ和酶Ⅱ的调节,酶Ⅰ受丙二酰CoA抑制,酶Ⅱ受胰岛素抑制。丙二酰CoA是合成脂肪酸的原料,胰岛素通过诱导乙酰CoA羧化酶的合成使丙二酰CoA浓度增加,进而抑制酶Ⅰ。可以看出胰岛素对肉毒碱脂酰转移酶Ⅰ和酶Ⅱ有间接或直接抑制作用。饥饿或禁食时胰岛素分泌减少,肉毒碱脂酰转移酶Ⅰ和酶Ⅱ活性增高,转移的长链脂肪酸进入线粒体氧化供能。
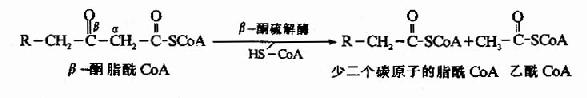
3.β-氧化的反应过程:脂酰CoA在线粒体基质中进入β氧化要经过四步反应,即脱氢、加水、再脱氢和硫解,生成一分子乙酰CoA和一个少两个碳的新的脂酰CoA。
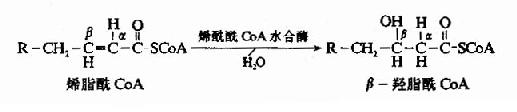
第一步脱氢(dehydrogenation)反应由脂酰CoA脱氢酶活化,辅基为FAD,脂酰CoA在α和β碳原子上各脱去一个氢原子生成具有反式双键的α、β-烯脂肪酰辅酶A。

第二步加水(hydration)反应由烯酰CoA水合酶催化,生成具有L-构型的β-羟脂酰CoA。
第三步脱氢反应是在β-羟脂肪酰CoA脱饴酶(辅酶为NAD+)催化下,β-羟脂肪酰CoA脱氢生成β酮脂酰CoA。
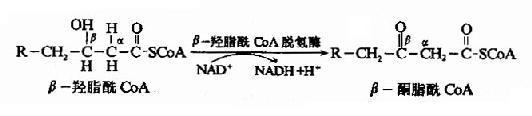
第四步硫解(thiolysis)反应由β-酮硫解酶催化,β-酮酯酰CoA在α和β碳原子之间断链,加上一分子辅酶A生成乙酰CoA和一个少两个碳原子的脂酰CoA。
上述四步反应与TCA循环中由琥珀酸经延胡索酸、苹果酸生成草酰乙酸的过程相似,只是β-氧化的第四步反应是硫解,而草酰乙酸的下一步反应是与乙酰CoA缩合生成柠檬酸。
长链脂酰CoA经上面一次循环,碳链减少两个碳原子,生成一分子乙酰CoA,多次重复上面的循环,就会逐步生成乙酰CoA。
从上述可以看出脂肪酸的β-氧化过程具有以下特点。首先要将脂肪酸活化生成脂酰CoA,这是一个耗能过程。中、短链脂肪酸不需载体可直拉进入线粒体,而长链脂酰CoA需要肉毒碱转运。β-氧化反应在线粒体内进行,因此没有线粒体的红细胞不能氧化脂肪酸供能。β-氧化过程中有FADH2和NADH+H+生成,这些氢要经呼吸链传递给氧生成水,需要氧参加,乙酰CoA的氧化也需要氧。因此,β-氧化是绝对需氧的过程。
脂肪酸β-氧化的整个过程可用下图(图5-11)表示:
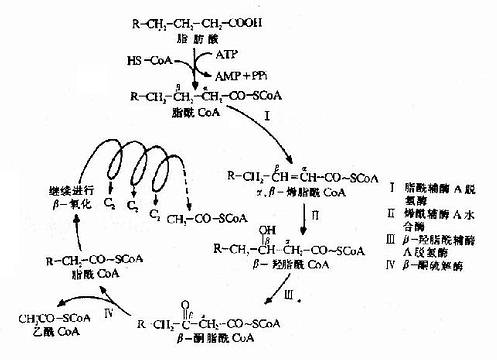
图5-11 脂肪酸β氧化反应过程
(二)脂肪酸β-氧化的生理意义
脂肪酸β-氧化是体内脂肪酸分解的主要途径,脂肪酸氧化可以供应机体所需要的大量能量,以十八个碳原子的饱和脂肪酸硬脂酸为例,其β-氧化的总反应为:
CH3(CH2)15COSCoA+8NAD++*CoASH+8H2O——→9CH3COSCoA+8FADH2+8NADH+8H+
8分子FADH2提供8×2=16分子ATP,8分子NADH+H+提供8×3=24分子ATP,9分子乙酰CoA完全氧化提供9×12=108个分子ATP,因此一克分子硬脂酸完全氧化生成CO2和H2O,共提供148克分子ATP。硬脂酸的活化过程消耗2克分子ATP,所以一克分子硬脂酸完全氧化可净生成146克分子ATP。一克分子葡萄糖完全氧化可生成38分子ATP。三克分子葡萄糖所含碳原子数与一克分子硬脂酸相同,前者可提供114克分子ATP,后者可提供146克分子ATP。可见在碳原子数相同的情况下脂肪酸能提供更多的能量。脂肪酸氧化时释放出来的能量约有40%为机体利用合成高能化合物,其余60%以热的形式释出,热效率为40%,说明人体能很有效地利用脂肪酸氧化所提供的能量。
脂肪酸β-氧化也是脂肪酸的改造过程,人体所需要的脂肪酸链的长短不同,通过β-氧化可将长链脂肪酸改造成长度适宜的脂肪酸,供机体代谢所需。
脂肪酸β-氧化过程中生成的乙酰CoA是一种十分重要的中间化合物,乙酰CoA除能进入三羧酸循环氧化供能外,还是许多重要化合物合成的原料,如酮体、胆固醇和类固醇化合物。
(三)脂肪酸的特殊氧化形式
1.丙酸的氧化:人体内和膳食中含极少量的奇数碳原子脂肪酸,经过β-氧化除生成乙酰CoA外还生成一分子丙酰CoA,某些氨基酸如异亮氨酸、蛋氨酸和苏氨酸的分解代谢过程中有丙酰CoA生成,胆汁酸生成过程中亦产生丙酰CoA。丙酰CoA经过羧化反应和分子内重排,可转变生成琥珀酰CoA,可进一步氧化分解,也可经草酰乙酸异生成糖,反应过程见下图。
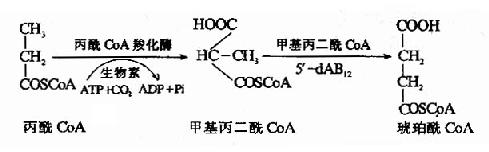
甲基丙二酰CoA变位酶的辅酶是5′-脱氧腺苷B12(5′dAB12),维生素B12缺乏或5′-dAB12生成障碍均影响变位酶活性,使甲基丙二酰CoA堆积。结果,一方面甲基丙二酰CoA脱去辅酶A,生成甲基丙二酸引起血中甲基丙二酸含量增高(甲基丙二酸血症),并从尿中排出体外(24小时排出量大于4mg时称为甲基丙二酸尿症)。另一方面又引起丙酰CoA浓度增高,可参与神经髓鞘脂类合成,生成异常脂肪酸(十五碳、十七碳和十九碳脂肪酸),引起神经髓鞘脱落、神经变性(临床上称为亚急性合并变性症)。
2.ω-氧化:脂肪酸的ω-氧化是在肝微粒体中进行,由加单氧酶催化的。首先是脂肪酸的ω?碳原子羟化生成ω-羧脂肪酸,再经ω醛脂肪酸生成α、ω-二羧酸,然后在α-端或ω-端活化,进入线粒体进入β-氧化,最后生成琥珀酰CoA。
3.α-氧化:脂肪酸在微粒体中由加单氧酶和脱羧酶催化生成α-羟脂肪酸或少一个碳原子的脂肪酸的过程称为脂肪酸的α-氧化。长链脂肪酸由加单氧酶催化、由抗坏血酸或四氢叶酸作供氢体在O2和Fe2+参与下生成α-羟脂肪酸,这是脑苷脂和硫脂的重要成分,α-羟脂肪酸继续氧化脱羧就生成奇数碳原子脂肪酸。α-氧化障碍者不能氧化植烷酸(phytanic acid,3、7、11、15-四甲基十六烷酸)。牛奶和动物脂肪中均有此成分,在人体内大量堆积便引起Refsum氏病。α-氧化主要在脑组织内发生,因而α-氧化障碍多引起神经症状。
4.不饱和脂肪酸(unsaturated fatty acid)的氧化:人体内约有1/2以上的脂肪酸是不饱和脂肪酸,食物中也含有不饱和脂肪酸。这些不饱和脂肪酸的双键都是顺式的,它们活化后进入β-氧化时,生成3?顺烯脂酰CoA,此时需要顺?3反?2异构酶催化使其生成2?反烯脂酰CoA以便进一步反应。2?反烯脂酰CoA加水后生成D?β-羟脂酰CoA,需要β-羟脂酰CoA差向异构酶催化,使其由D?构型转变成L?构型,以便再进行脱氧反应(只有L?β-羟脂酰CoA才能作为β-羟脂酰CoA脱氢酶的底物)。
不饱和脂肪酸完全氧化生成CO2和H2O时提供的ATP少于相同碳原子数的饱和脂肪酸。
(四)酮体的生成与利用
酮体(acetonebodies)是脂肪酸在肝脏进行正常分解代谢所生成的特殊中间产物,包括有乙酰乙酸(acetoacetic acid约占30%),β-羟丁酸(β?hydroxybutyric acid约占70%)和极少量的丙酮(acetone)。正常人血液中酮体含量极少(约为0.8?.0mg/dl,0.2?2mM),这是人体利用脂肪氧化供能的正常现象。但在某些生理情况(饥饿、禁食)或病理情况下(如糖尿病),糖的来源或氧化供能障碍,脂动员增强,脂肪酸就成了人体的主要供能物质。若肝中合成酮体的量超过肝外组织利用酮体的能力,二者之间失去平衡,血中浓度就会过高,导致酮血症(acetonemia)和酮尿症(acetonuria)。乙酰乙酸和β-羟丁酸都是酸性物质,因此酮体在体内大量堆积还会引起酸中毒。
1.酮体的生成过程:
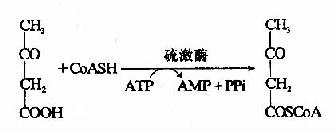
酮体是在肝细胞线粒体中生成的,其生成原料是脂肪酸β-氧化生成的乙酰CoA。首先是二分子乙酰CoA在硫解酶作用下脱去一分子辅酶A,生成乙酰乙酰CoA。
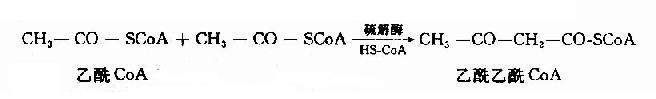
在3-羟-3-甲基戊二酰CoA(hydroxy methyl glutaryl?CoA,HMG?CoA)合成酶催化下,乙酰乙酰CoA再与一分子乙酰CoA反应,生成HMG?CoA,并释放出一分子辅酶。这一步反应是酮体生成的限速步骤。
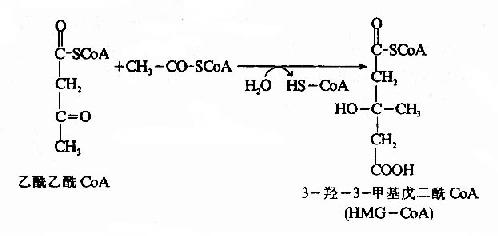
HMG-CoA裂解酶催化HMG-CoA生成乙酰乙酸和乙酰CoA,后者可再用于酮体的合成。
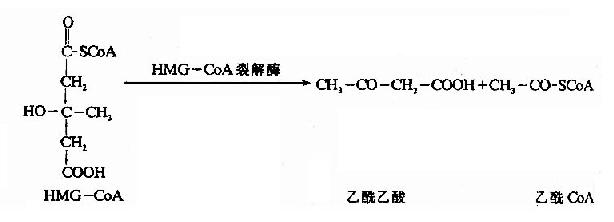
线粒体中的β-羟丁酸脱氢酶催化乙酰乙酸加氢还原(NADH+H+作供氢体),生成β-羟丁酸,此还原速度决定于线粒体中[NADH+H+]/[NAD+]的比值,少量乙栈酸可自行脱羧生成丙酮。
上述酮体生成过程实际上是一个循环过程,又称为雷宁循环(lynen cycle),两个分子乙酰CoA通过此循环生成一分子乙酰乙酸(见图5-12)。
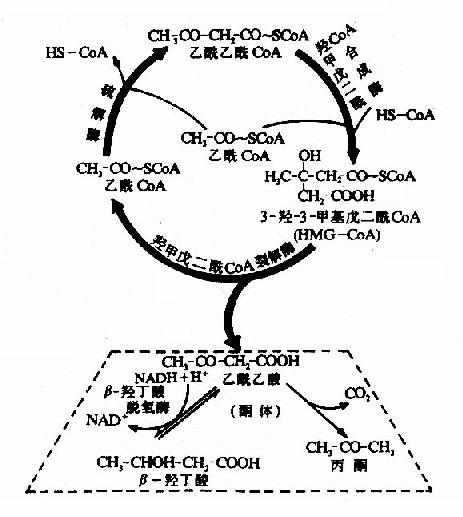
图5-12 肝脏内酮体的生成
酮体生成后迅速透过肝线粒体膜和细胞膜进入血液,转运至肝外组织利用。
2.酮体的利用过程
骨骼肌、心肌和肾脏中有琥珀酰CoA转硫酶(succinyl?Coa thiophorase),在琥珀酰CoA存在时,此酶催化乙酰乙酸活化生成乙酰乙酰CoA。?

心肌、肾脏和脑中还有硫激酶,在有ATP和辅酶T存在时,此酶催化乙酰化酸活化成乙酰乙酰CoA。
经上述两种酶催化生成的乙酰乙酰CoA在硫解酶作用下,分解成两分子乙酰CoA,乙酰CoA主要进入三羧酸循环氧化分解。
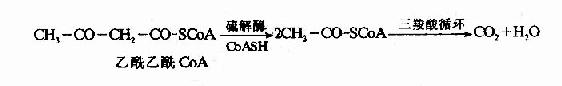
丙酮除随尿排出外,有一部分直接从肺呼出,代谢上不占重要地位,肝外组织利用乙酰乙酸和β-羟丁酸的过程可用下图表示(图5-13)。
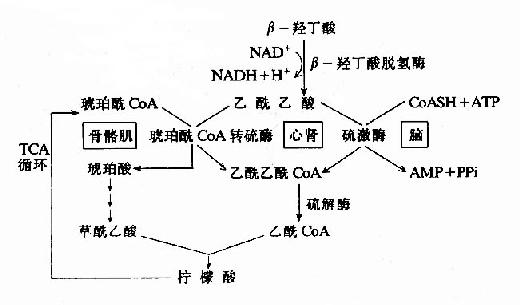
图5-13 酮体利用过程
肝细胞中没有琥珀酰CoA转硫酶和乙酰乙酸硫激酶,所以肝细胞不能利用酮体。
肝外组织利用酮体的量与动脉血中酮体浓度成正比,自中酮体浓度达70mg/dl时,肝外组织的利用能力达到饱和。肾酮阈亦为70mg/dl,血中酮体浓度超过此值,酮体经肾小球的滤过量超过肾小管的重吸收能力,出现酮尿症。脑组织利用酮体的能力与血糖水平有关,只有血糖水平降低时才利用酮体。
酮体的生成和利用过程可用下图表示(图5-14)。
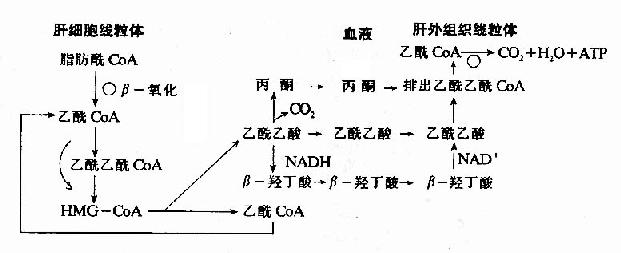
图5-14 酮体的生成和利用
3.酮体生成的意义
(1)酮体易运输:长链脂肪酸穿过线粒体内膜需要载体肉毒碱转运,脂肪酸在血中转运需要与白蛋白结合生成脂酸白蛋白,而酮体通过线粒体内膜以及在血中转运并不需要载体。
(2)易利用:脂肪酸活化后进入β-氧化,每经4步反应才能生成一分子乙酰CoA,而乙酰乙酸活化后只需一步反应就可以生成两分子乙酰CoA,β-羟丁酸的利用只比乙酰乙酸多一步氧化反应。因此,可以把酮体看作是脂肪酸在肝脏加工生成的半成品。
(3)节省葡萄糖供脑和红细胞利用:肝外组织利用酮体会生成大量的乙酰CoA,大量乙酰CoA
抑制丙酮酸脱氢酶系活性,限制糖的利用。同时乙酰CoA还能激活丙酮酸羧化酶,促进糖异生。肝外组织利用酮体氧化供能,就减少了对葡萄糖的需求,以保证脑组织、红细胞对葡萄糖的需要。脑组织不能利用长链脂肪酸,但在饥饿时可利用酮体供能,饥饿5?周时酮体供能可多达70%。
(4)肌肉组织利用酮体,可以抑制肌肉蛋白质的分解,防止蛋白质过多消耗,其作用机理尚不清楚。
(5)酮体生成增多常见于饥饿、妊娠中毒症、糖尿病等情况下。低糖高脂饮食也可使酮体生成增多。
二、脂肪酸的合成
人体内的脂肪酸大部分来源于食物,为外源性脂肪酸,在体内可通过改造加工被人体利用。同时机体还可以利用糖和蛋白转变为脂肪酸称为内源性脂肪酸,用于甘油三酯的生成,贮存能量。合成脂肪酸的主要器官是肝脏和哺乳期乳腺,另外脂肪组织、肾脏、小肠均可以合成脂肪酸,合成脂肪酸的直接原料是乙酰CoA,消耗ATP和NADPH,首先生成十六碳的软脂酸,经过加工生成人体各种脂肪酸,合成在细胞质中进行。
(一)软脂酸的生成
脂肪酸的合成首先由乙酰CoA开始合成,产物是十六碳的饱和脂肪酸即软酯酸(palmitoleic acid)。
1.乙酰CoA的转移
乙酰CoA可由糖氧化分解或由脂肪酸、酮体和蛋白分解生成,生成乙酰CoA的反应均发生在线粒体中,而脂肪酸的合成部位是胞浆,因此乙酰CoA必须由线粒体转运至胞浆。但是乙酰CoA不能自由通过线粒体膜,需要通过一个称为柠檬酸?丙酮酸循环(citratepyruvate cycle)来完成乙酰CoA由线粒体到胞浆的转移。首先在线粒体内,乙酰CoA与草酰乙酸经柠檬酸合成酶催化,缩合生成柠檬酸,再由线粒体内膜上相应载体协助进入胞液,在胞液内存在的柠檬酸裂解酶(citrate lyase)可使柠檬酸裂解产生乙酰CoA及草酰乙酸。前者即可用于生成脂肪酸,后者可返回线粒体补充合成柠檬酸时的消耗。但草酰乙酸也不能自由通透线粒体内膜,故必须先经苹果酸脱氢酶催化,还原成苹果酸再经线粒体内膜上的载体转运入线粒体,经氧化后补充草酰乙酸。也可在苹果酸酶作用下,氧化脱羧生成丙酮酸,同时伴有NADPH的生成。丙酮酸可经内膜载体被转运入线粒体内,此时丙酮酸可再羧化转变为草酰乙酸。每经柠檬酸丙酮酸循环一次,可使一分子乙酸CoA由线粒体进入胞液,同时消耗两分子ATP,还为机体提供了NADPH以补充合成反应的需要(见图5-15)。
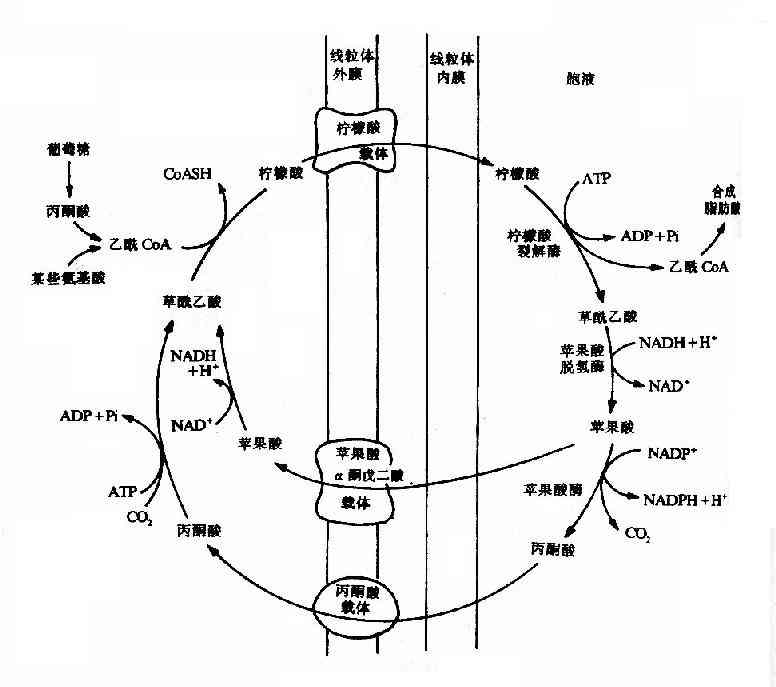
图5-15 柠檬酸-丙酮酸循环
2.丙二酰CoA的生成
乙酰CoA由乙酰CoA羧化酶(acetyl CoA carboxylase)催化转变成丙二酰CoA(或称丙二酸单酰CoA)反应如下:

乙酰CoA羧化酶存在于胞液中,其辅基为生物素,在反应过程中起到携带和转移羧基的作用。该反应机理类似于其他依赖生物素的羧化反应,如催化丙酮酸羧化成为草酰乙酸的反应等。
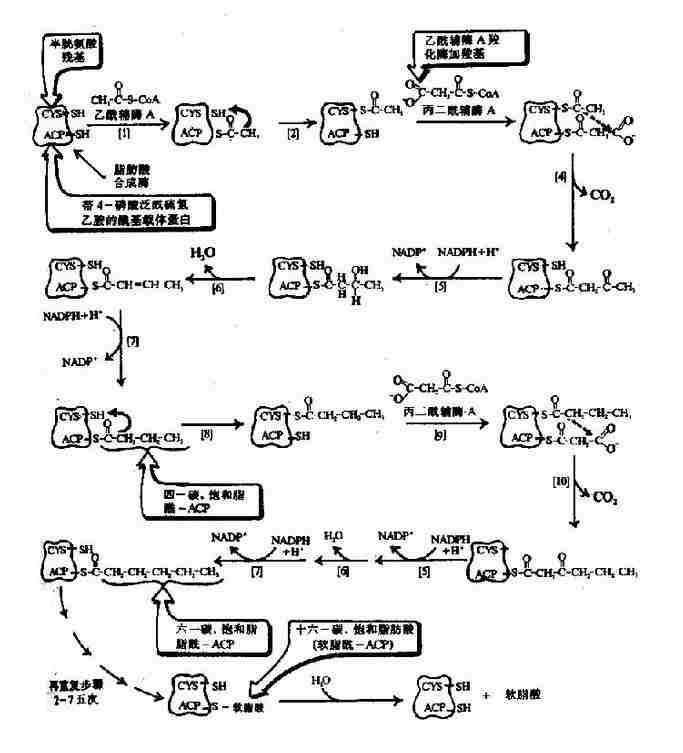
图5-16 原核生物脂肪酸合成酶复合物生成软脂酸(16:0)
由乙酰CoA羧化酶催化的反应为脂肪酸合成过程中的限速步骤。此酶为一别构酶,在变构效应剂的作用下,其无活性的单体与有活性的多聚体(由10?0个单体呈线状排列)之间可以互变。柠檬酸与异柠檬酸可促进单体聚合成多聚体,增强酶活性,而长链脂肪酸可加速解聚,从而抑制该酶活性。乙酰CoA羧化酶还可通过依赖于cAMP的磷酸化及去磷酸化修饰来调节酶活性。此酶经磷酸化后活性丧失,如胰高血糖素及肾上腺素等能促进这种磷酸化作用,从而抑制脂肪酸合成;而胰岛素则能促进酶的去磷酸化作用,故可增强乙酰CoA羧化酶活性,加速脂肪酸合成。
同时乙酰CoA羧化酶也是诱导酶,长期高糖低脂饮食能诱导此酶生成,促进脂肪酸合成;反之,高脂低糖饮食能抑制此酶合成,降低脂肪酸的生成。
3.软脂酸的生成
软脂酸的合成实际上是一个重复循环的过程,由1分子乙酰CoA与7分子丙二酰CoA经转移、缩合、加氢、脱水和再加氢重复过程,每一次使碳链延长两个碳,共7次重复,最终生成含十六碳的软脂酸(图5-16)。
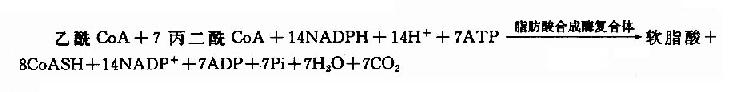
在原核生物(如大肠杆菌中)催化此反应的酶是一个由7种不同功能的酶与一种酰基载体蛋白(acyl carrier protein,ACP)聚合成的复合体。在真核生物催化此反应是一种含有双亚基的酶,每个亚基有7个不同催化功能的结构区和一个相当于ACP的结构区,因此这是一种具有多种功能的酶。
脂肪酸合成需消耗ATP和NADPH+H+,NADPH主要来源于葡萄糖分解的磷酸戊糖途径。此外,苹果酸氧化脱羧也可产生少量NADPH。
脂肪酸合成过程不是β-氧化的逆过程,它们反应的组织,细胞定位,转移载体,酰基载体,限速酶,激活剂,抑制剂,供氢体和受氢体以及反应底物与产物均不相同(表5-6)。
表5-6 脂肪酸合成和分解的比较
|
合成 |
分解 |
| 反应最活跃时期 |
高糖膳食后 |
饥饿 |
| 刺激激素 |
胰岛素/胰高血糖素高比值 |
胰岛素/胰高血糖素低比值 |
| 主要组织定位 |
肝脏为主 |
肌肉、肝脏 |
| 亚细胞定位 |
胞浆 |
线粒体为主 |
| 酰基载体 |
柠檬酸(线粒体到胞浆) |
肉毒碱(胞浆到线粒体) |
| 含磷酸酰疏基乙胺的活性载体 |
酰基载体蛋白区,CoA |
CoA |
| 氧化还原辅因子 |
NADPH |
NAD+,FAD |
| 二碳供体/产物 |
丙二酰CoA;酰基供体 |
乙酰CoA:产物 |
| 激活剂 抑制剂 |
柠檬酸脂辅酶CoA(抑制乙酰CoA羧化酶) |
丙二酰CoA(抑制肉毒碱酰基转移酶) |
| 反应产物 |
软脂酸 |
乙酰辅酶A |
(二)其它脂肪酸的生成
人体内不仅有软脂酸,还有碳链长短不等的其它脂肪酸,也有各种不饱和脂肪酸,除营养必需脂肪酸依赖食物供应外,其它脂肪酸均可由软脂酸在细胞内加工改造而成。
1.碳链的延长和缩短
脂肪酸碳链的缩短在线粒体中经β-氧化完成,经过一次β-氧化循环就可以减少两个碳原子。
脂肪酸碳链的延长可在滑面内质网和线粒体中经脂肪酸延长酶体系催化完成。
在内质网,软脂酸延长是以丙二酰CoA为二碳单位的供体,由NADPH+H+供氢,亦经缩合脱羧、还原等过程延长碳链,与胞液中脂肪酸合成过程基本相同。但催化反应的酶体系不同,其脂肪酰基不是以ACP为载体,而是与辅酶A相连参加反应。除脑组织外一般以合成硬脂酸(18C)为主,脑组织因含其他酶,故可延长至24碳的脂肪酸,供脑中脂类代谢需要。
在线粒体,软脂酸经线粒体脂肪酸延长酶体系作用,与乙酰CoA缩合逐步延长碳链,其过程与脂肪酸β氧化逆行反应相似,仅烯脂酰CoA还原酶的辅酶为NADPH+H+与β氧化过程不同。通过此种方式一般可延长脂肪酸碳链至24或26碳,但以硬脂酸最多。
2.脂肪酸脱饱和
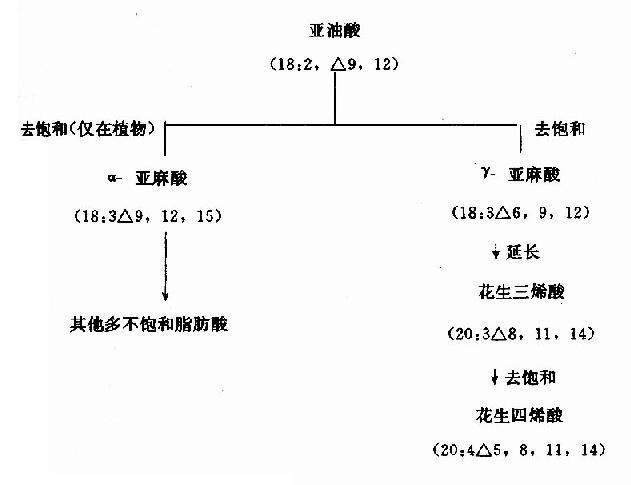
人和动物组织含有的不饱和脂肪酸主要为软油酸(16:1△9)、油酸(18:1△9)、亚油酸(18:2△9,12)、亚麻酸(18:3△9,12,15)、花生四烯酸(20:4△5,8,11,14)等。其中最普通的单不饱和脂肪酸?棗软油酸和油酸可由相应的脂肪酸活化后经去饱和酶(acylCoAdesaturase)催化脱氢生成。这类酶存在于滑面内质网,属混合功能氧化酶(见肝脏代谢章)。因该酶只催化在△9形成双键,而不能在C10与末端甲基之间形成双键,故亚油酸(linoleate)、亚麻酸(linolenate)及花生四烯酸(arachidonate)在体内不能合成或合成不足。但它们又是机体不可缺少的,所以必须由食物供给,因此,称之为必需脂肪酸(essential fatty acid)。植物组织含有可以在C?10与末端甲基间形成双键(即ω3和ω6)的去饱和酶,能合成以上3种多不饱和脂肪酸。当食入亚油酸后,在动物体内经碳链加长及去饱和后,可生成花生四烯酸。
(三)脂肪酸合成的调节
乙酰CoA羧化酶催化的反应是脂肪酸合成的限速步骤,很多因素都可影响此酶活性,从而使脂肪酸合成速度改变。脂肪酸合成过程中其他酶,如脂肪酸合成酶、柠檬酸裂解酶等亦可被调节。
1.代谢物的调节
在高脂膳食后,或因饥饿导致脂肪动员加强时,细胞内软脂酰CoA增多,可反馈抑制乙酰CoA羧化酶,从而抑制体内脂肪酸合成。而进食糖类,糖代谢加强时,由糖氧化及磷酸戊糖循环提供的乙酰CoA及NADPH增多,这些合成脂肪酸的原料的增多有利于脂肪酸的合成。此外,糖氧化加强的结果,使细胞内ATP增多,进而抑制异柠檬酸脱氢酶,造成异柠檬酸及柠檬酸堆积,在线粒体内膜的相应载体协助下,由线粒体转入胞液,可以别构激活乙酰CoA羧化酶。同时本身也可裂解释放乙酰CoA,增加脂肪酸合成的原料,使脂肪酸合成增加。
2.激素的调节
胰岛素、胰高血糖素、肾上腺素及生长素等均参与对脂肪酸合成的调节。
胰岛素能诱导乙酰CoA羧化酶、脂肪酸合成酶及柠檬酸裂解酶的合成,从而促进脂肪酸的合成。此外,还可通过促进乙酰CoA羧化酶的去磷酸化而使酶活性增强,也使脂肪酸合成加速。
胰高血糖素等可通过增加cAMP,致使乙酰CoA羧化酶磷酸化而降低活性,因此抑制脂肪酸的合成。此外,胰高血糖素也抑制甘油三酯合成,从而增加长链脂酰CoA对乙酰CoA羧化酶的反馈抑制,亦使脂肪酸合成被抑制。
(四)前列腺素、血栓素及白三烯
前列腺素(prostaglandin,PG),血栓素(thromboxane,TX)和白三烯(leukotrienes,LT)均由花生四烯酸衍生而来。它们在细胞内生成后,可作为调节物对几乎所有的细胞代谢发挥调节作用,而且与炎症、过敏反应和心血管疾病等病理过程有关。
生物膜上的膜磷脂含有花生四烯酸,它可被磷脂酶A2水解,释放花生四烯酸。花生四烯酸可在前列腺素内过氧化物合成酶催化下,消耗O2和还原性谷胱甘肽,发生氧化和环化反应,生成前列腺素H2。前列腺素H2可进一步衍生成其它前列腺素及血栓素(见图5?7)。可的松(cortisol)抑制磷酸酶A2活性,减少花生四烯酸的生成,从而抑制前列原素的合成,阿斯匹林(aspirin)和保泰松(phenylbutazone)抑制前列腺素内过氧化物合成酶活性使前列腺素和血栓素生成减少。
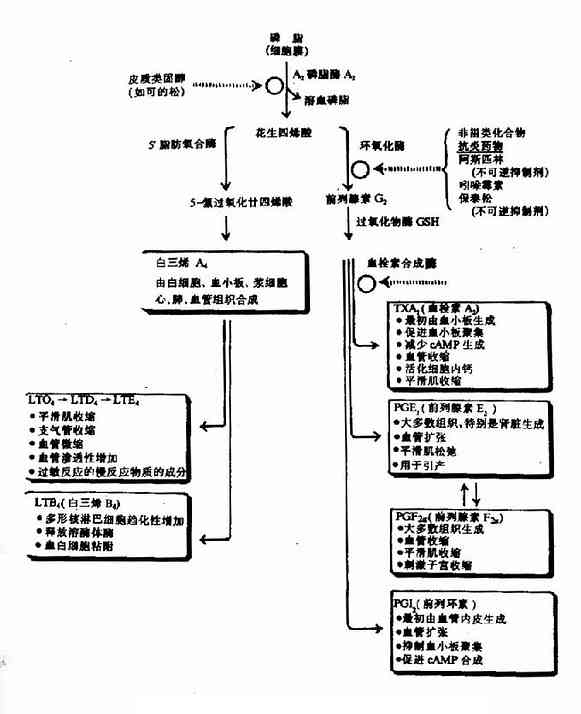
图5-17 花生四烯酸生成PG,TX和LT概况
三、PG、TX及LT的生理功能
PG等在细胞内含量很低,仅10?1pmol/L,但具有很强的生理活性。
(一)PG
PGE2能诱发炎症,促进局部血管扩张,毛细血管通透性增加,引起红、肿、痛、热等症状。PGE2、PGA2使动脉平滑肌舒张,有降低血压的作用;PGE2及PGI2抑制胃酸分泌,促进胃肠平滑肌蠕动。卵泡产生的PGE2及PGE2α在排卵过程中起重要作用,PGE2α可使卵巢平滑肌收缩,引起排卵、子宫释放的PGE2α能使黄体溶解,分娩时子宫内膜释出的PGE2α能引起子宫收缩加强,促进分娩。
(二)TX
血小板产生的TXA2及PGE2促进血小板聚集,血管收缩,促进凝血及血栓形成,而血管内皮细胞释放的PGI2则有很强的舒血管及抗血小板聚集,抑制凝血及血栓形成,与TXA2的作用对抗。北极地区爱斯基摩人摄食富含花生四烯酸的血类食物,能在体内合成PGE3,PGI3及TXA3等三类化合物。PGI3能抑制花生四烯酸从膜磷脂释放,因而抑制PGI2及TXA2的合成。由于PGI3的活性与PGI2相同,而TXA3则较TXA2弱得多,因此爱斯基摩人抗血小板聚集及抗凝血作用较强,被认为是他们不易患心肌梗塞的重要原因之一。
(三)LT
已证实过敏反应的慢反应物质(SRS?A)是LTC4、TD4及LTE4的混合物,其使支气管平滑肌收缩的作用较组胺及PGF2强100000倍,作用缓慢而持久。此外,LTG4还能调节白细胞的功能,促进其游走及趋化作用,刺激腺苷酸环化酶,诱发多核白细胞脱颗粒,使溶酶释放水解酶类,促进炎症及过敏反应的发展。
第五节 磷脂代谢
磷脂是一类含有磷酸的脂类,机体中主要含有两大类磷脂,由甘油构成的磷脂称为甘油磷脂(phosphoglyceride);由神经鞘氨醇构成的磷脂,称为鞘磷脂(sphingolipid)。其结构特点是:具有由磷酸相连的取代基团(含氨碱或醇类)构成的亲水头(hydrophilichead)和由脂肪酸链构成的疏水尾(hydrophobic tail)。在生物膜中磷脂的亲水头位于膜表面,而疏水尾位于膜内侧(图5-18)。
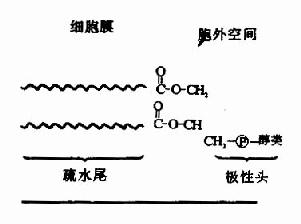
图5-18 显示胞膜定位的磷脂结构
一、甘油磷脂的代谢
(一)分类及生理功能
甘油磷脂是机体含量最多的一类磷脂,它除了构成生物膜外,还是胆汁和膜表面活性物质等的成分之一,并参与细胞膜对蛋白质的识别和信号传导。
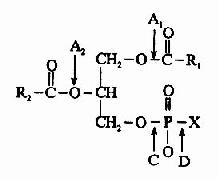
甘油磷脂基本结构是磷脂酸和与磷酸相连的取代基团(X);
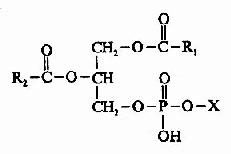
甘油磷脂由于取代基团不同又可以分为许多类,其中重要的有:
胆碱(choline)+磷脂酸→磷脂酰胆碱(phosphatidylcholine)又称卵磷脂(lecithin)
乙醇胺(ethanolamine)+磷脂酸→磷脂酰乙醇胺(phosphatidylethanolamine)又称脑磷脂(cephain)
丝氨酸(serine)+磷脂酸→磷脂酰丝氨酸(phosphatidylserine)
甘油(glycerol)+磷脂酸→磷脂酰甘油(phosphatidylglycerol)
肌醇(inositol)+磷脂酸→磷脂酰肌醇(phosphatidylinositol)
此外,还有心磷脂(cardiolipin)是由甘油的C1和C3与两分子磷脂酸结合而成。心磷脂是线粒体内膜和细菌膜的重要成分,而且是唯一具有抗原性的磷脂分子。
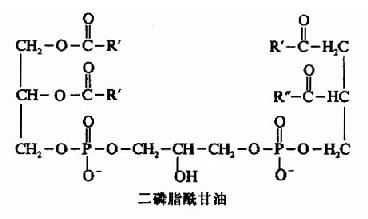
除以上6种以外,在甘油磷脂分子中甘油第1位的脂酰基被长链醇取代形成醚,如缩醛磷脂(p
lasmalogen)及血小板活化因子(plateletactivating factor,PAF),它们都属于甘油磷脂。结构式如下:
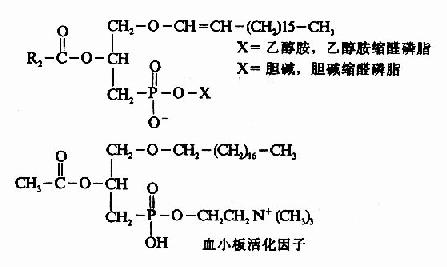
(二)甘油磷脂的合成
合成全过程可分为三个阶段,即原料来源、活化和甘油磷脂生成。甘油磷脂的合成在细胞质滑面内质网上进行,通过高尔基体加工,最后可被组织生物膜利用或成为脂蛋白分泌出细胞。机体各种组织(除成熟红细胞外)即可以进行磷脂合成。
1.原料来源
合成甘油磷脂的原料为磷脂酸与取代基团。磷脂酸可由糖和脂转变生成的甘油和脂肪酸生成(详见甘油三酯合成代谢),但其甘油C2位上的脂肪酸多为必需脂肪酸,需食物供给。取代基团中胆碱和乙醇胺可由丝氨酸在体内转变生成或食物供给。
丝氨酸——→乙醇胺——→胆碱
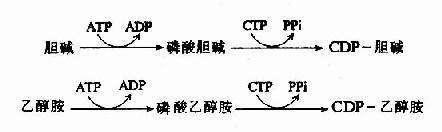
2.活化
磷脂酸和取代基团在合成之前,两者之一必须首先被CTP活化而被CDP携带,胆碱与乙醇胺可生成CDP?胆碱和CDP乙醇胺,磷脂酸可生成CDP?甘油二酯。
3.甘油磷脂生成
(1)磷脂酰胆碱和磷脂酰乙醇胺
这两种磷脂生成是由活化的CDP胆碱与CDP-乙醇胺和甘油二脂生成。此外磷脂酰乙醇胺在肝脏还可由与腺苷蛋氨酸提供甲基转变为磷脂酰胆碱。
(2)磷脂酰丝氨酸
体内磷脂酰丝氨酸合成是通过Ca++激活的酰基交换反应生成,由磷脂酰乙醇胺与丝氨酸反应生成磷脂酰丝氨酸和乙醇胺。
磷脂酰乙醇胺+丝氨酸—→磷脂酰丝氨酸+乙醇胺
(3)磷脂酰肌醇、磷脂酰甘油和心磷脂
上述三者生成是由活化的CDP?甘油二酯与相应取代基团反应生成

(4)缩醛磷脂与血小板活化因子
缩醛磷脂与血小板活化因子的合成过程与上述磷脂合成过程类似,不同之处在于磷脂酸合成之前,由糖代谢中间产物磷酸二羟丙酮转变生成脂酰磷酸二羟丙酮以后,由一分子长链脂肪醇取代其第一位脂酰基,其后再经还原(由NADPH供H)、转酰基等步骤合成磷脂酸的衍生物。此产物替代磷脂酸为起始物,沿甘油三酯途径合成胆碱或乙醇胺缩醛磷脂。血小板活化因子与缩醛磷脂的不同在于长链脂肪醇是饱和长链醇,第2位的脂酰基为最简单的乙酰基。
(三)甘油磷脂的分解
在生物体内存在一些可以水解甘油磷脂的磷脂酶类,其中主要的有磷脂酶A1、A2、B、C和D,它们特异地作用于磷脂分子内部的各个酯键,形成不同的产物。这一过程也是甘油磷酯的改造加工过程。
磷脂酶A1:自然界分布广泛,主要存在于细胞的溶酶体内,此外蛇毒及某些微生物中亦有,可有催化甘油磷脂的第1位酯键断裂,产物为脂肪酸和溶血磷脂2。
磷脂酶A2:普遍存在于动物各组织细胞膜及线粒体膜,能使甘油磷脂分子中第2位酯键水解,产物为溶血磷脂1及其产物脂肪酸和甘油磷酸胆碱或甘油磷酸乙醇胺等。
溶血磷脂是一类具有较强表面活性的性质,能使红细胞及其他细胞膜破裂,引起溶血或细胞坏死。当经磷脂酶B作用脱去脂肪酸后,转变成甘油磷酸胆碱或甘油磷酸乙醇胺,即失去溶解细胞膜的作用。
磷脂酶C:存在于细胞膜及某些细胞中,特异水解甘油磷脂分子中第3位磷酸酯键,其结果是释放磷酸胆碱或磷酸乙醇胺,并余下作用物分子中的其他组分。
磷脂酶D:主要存在于植物,动物脑组织中亦有,催化磷脂分子中磷酸与取代基团(如胆碱等)间的酯键,释放出取代基团。
二、鞘磷脂的代谢
鞘脂类(sphingolipid),组成特点是不含甘油而含鞘氨醇(sphingosine),其基本结构是:
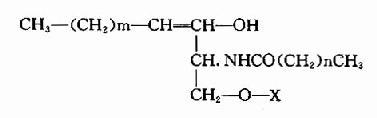
按照取代基团X的不同可分为两种
X为磷酸胆碱称为鞘磷脂(sphingmyelin)
X为糖基称为鞘糖脂(glycosphingolipid)
(一)鞘磷脂的合成
体内的组织均可合成鞘磷脂,以脑组织最为活跃,是构成神经组织膜的主要成分,合成在细胞内质网上进行。
以脂酰CoA和丝氨酸为原料,消耗NADPH生成二氢鞘氨醇,进而经脂肪酰转移酶作用生成神经酰胺。
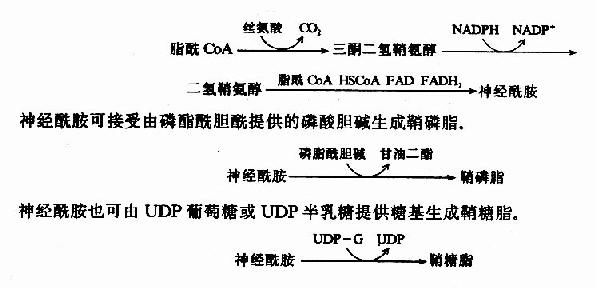
(二)鞘磷脂的分解
鞘磷脂经磷脂酶(sphingomyelinase)作用,水解产生磷酸胆碱和神经酰胺。如缺乏此酶可引起肝、脾肿大及神经障碍如痴呆等鞘磷脂沉积症。
第六节 胆固醇代谢
一、肝胆固醇的来源及释放途径
胆固醇是体内最丰富的固醇类化合物,它既作为细胞生物膜的构成成分,又是类固醇类激素、胆汁酸及维生素D的前体物质。因此对于大多数组织来说,保证胆固醇的供给,维持其代谢平衡是十分重要的。胆固醇广泛存在于全身各组织中,其中约1/4分布在脑及神经组织中,占脑组织总重量的2%左右。肝、肾及肠等内脏以及皮肤、脂肪组织亦含较多的胆固醇,每100g组织中约含200至500mg,以肝为最多,而肌肉较少,肾上腺、卵巢等组织胆固醇含量可高达1%-5%,但总量很少。肝脏胆固醇来源见图5-19。
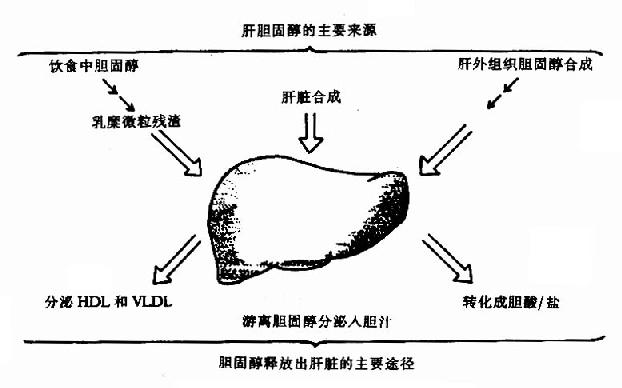
图5-19 肝胆固醇的来源及释放途径
人体固醇的来源靠体内合成及从食物摄取,正常人每天膳食中约含胆固醇300-500mg,主要来自动物内脏、蛋黄、奶油及肉类。植物性食品不含胆固醇,而含植物固醇如β谷固醇、麦角固醇等,它们不易为人体吸收,摄入过多还可抑制胆固醇的吸收。
(二)合成原料
乙酰CoA是胆固醇合成的直接原料,它来自葡萄糖、脂肪酸及某些氨基酸的代谢产物。另外,还需要ATP供能和NADPH供氢。合成1分子胆固醇需消耗18分子乙酰CoA、36分子ATP和16分子NADPH。
(三)合成基本过程
胆固醇合成过程比较复杂,有近30步反应,整个过程可根据为3个阶段。
1.3?羟-3甲基戊二酸甲酰CoA(HMGCoA)的生成
在胞液中,3分子乙酰CoA经硫解酶及HMGCoA合成酶催化生成HMGCoA,此过程与酮体生成机制相同。但细胞内定位不同,此过程在胞液中进行,而酮体生成在肝细胞线粒体内进行,因此肝脏细胞中有两套同功酶分别进行上述反应。
2.
HMGCoA在HMG CoA还原酶(HMGCoA reductase)催化下,消耗两分子NADPH+H+生成甲羟戊酸(MVA)

此过程是不可逆的,HMG还原酶是胆固醇合成的限速酶。
3.胆固醇的生成
MVA先经磷酸化、脱羧、脱羟基、再缩合生成含30C的鲨烯,经内质网环化酶和加氧酶催化生成羊毛脂固醇,后者再经氧化还原等多步反应最后失去了3个C,合成27C的胆固醇(图5-20)。
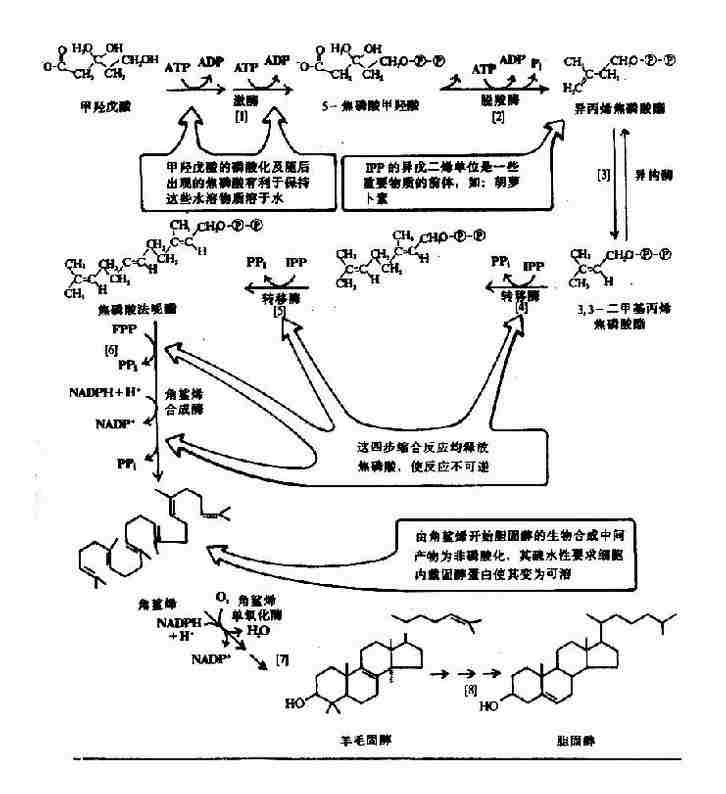
图5-20 甲羟戊酸合成胆固醇

图5-21 胆固醇的结构 显示脂肪酸在胆固醇酯中的位点
(四)胆固醇合成的调节
胆固醇合成的过程中HMGCoA还原酶为限速酶,因此各种因素通过对该酶的影响可以达到调节胆固醇合成的作用。
1.激素的调节
HMGCoA还原酶在胞液中经蛋白激酶催化发生磷酸化丧失活性,而在磷蛋白磷酸酶作用下又可以脱去磷酸恢复酶活性,胰高血糖素等通过第二信使cAMP影响蛋白激酶,加速HMGCoA还原酶磷酸化失活,从而抑制此酶,减少胆固醇合成。胰岛素能促进酶的脱磷酸作用,使酶活性增加,则有利于胆固醇合成。此外,胰岛素还能诱导HMGCoA还原酶的合成,从而增加胆固醇合成。甲状腺素亦可促进该酶的合成,使胆固醇合成增多,但其同时又促进胆固醇转变为胆汁酸,增加胆固醇的转化,而且此作用强于前者,故当甲状腺机能亢进时,患者血清胆固醇含量反而下降。
2.胆固醇浓度的调节
胆固醇可反馈抑制HMGCoA还原酶的活性,并减少该酶的合成,从而达到降低胆固醇合成的作用,细胞内胆固醇来自体内生物合成或胞外摄取。血中胆固醇主要由低密底脂蛋白(LDL)携带运输,借助细胞膜上的LDL受体介导内吞作用进入细胞。当胞内胆固醇过高,可抑制LDL受体的补充,从而减少由血中摄取胆固醇。
现知遗传性家族高胆固醇血症患者体内严重缺乏LDL受体,因此LDL携带的胆固醇不能被摄取,来自膳食的胆固醇不能从血液中被迅速清除,故血中胆固醇浓度过高,当体内总胆固醇过高,超过合成生物膜、胆汁酸及类固醇激素等的需要时,胆固醇及其酯则沉积在动脉内皮下的巨噬细胞中(这些细胞是由迁移到动脉内皮下的血单核细胞分化而成的),引起内皮下变形,进而导致血小板在动脉内壁集聚。若同时伴有动脉壁损伤或胆固醇转运障碍,则易在动脉内膜形成脂斑,继续发展可使动脉管腔变狭窄。可见动脉粥样硬化与血中高水平的胆固醇有关,特别与存在于LDL中的胆固醇水平有关。
二、胆固醇的转化
胆固醇在体内不被彻底氧化分解为CO2和H2O,而经氧化和还原转变为其它含环戊烷多氢菲母核的化合物。其中大部分进一步参与体内代谢,或排出体外。
胆固醇在体内可作为细胞膜的重要成分。此外,它还可以转变为多种具有重要生理作用的物质,在肾上腺皮质可以转变成肾上腺皮质激素;在性腺可以转变为性激素,如雄激素、雌激素和孕激素(progestogen);在皮肤,胆固醇可被氧化为7-脱氢胆固醇,后者经常紫外线照射转变为维生素D3;在肝脏,胆固醇可氧化成胆汁酸,促进脂类的消化吸收。
胆固醇在肝脏氧化生成的胆汁酸,随胆汁排出,每日排出量约占胆固醇合成量的40%。在小肠下段,大部分胆汁酸又通过肝循环重吸收入肝构成胆汁的肝肠循环(见图5?2);小部分胆汁酸经肠道细菌作用后排出体外。药物如消胆胺可与胆汁酸结合,阻断胆汁酸的肠肝循环,增加胆汁酸的排泄,间接促进肝内胆固醇向胆汁酸的转变。肝脏也能将胆固醇直接排入肠内,或者通过肠粘膜脱落而排入肠腔;胆固醇还可被肠道细菌还原为粪固醇后排出体外。
图5-22 胆汁酸和胆汁酸盐的肝肠循环