蛋白质分子是由许多氨基酸组成的,在不同的蛋白质分子中,氨基酸有着特定的排列顺序,这种特定的排列顺序不是随机的,而是严格按照蛋白质的编码基因中的碱基排列顺序决定的。基因的遗传信息在转录过程中从DNA转移到mRNA,再由mRNA将这种遗传信息表达为蛋白质中氨基酸顺序的过程叫做翻译。翻译的过程也就是蛋白质分子生物合成的过程,在此过程中需要200多种生物大分子参加,其中包括核糖体、mRNA、tRNA及多种蛋白质因子。翻译基本过程如图18-1。
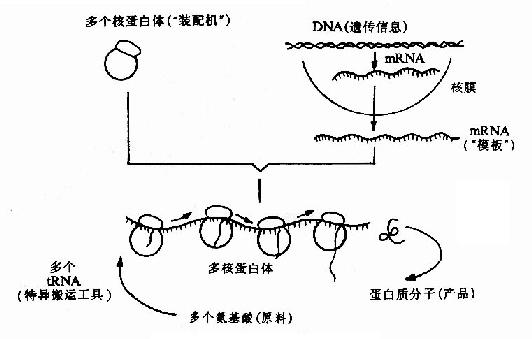
图18-1 翻译过程的基本原理
第一节 参与蛋白质生物合成的物质
(一)合成原料
自然界由mRNA编码的氨基酸共有20种,只有这些氨基酸能够作为蛋白质生物合成的直接原料。某些蛋白质分子还含有羟脯氨酸、羟赖氨酸、γ-羧基谷氨酸等,这些特殊氨基酸是在肽链合成后的加工修饰过程中形成的。
(二)mRNA是合成蛋白质的直接模板
原核细胞中每种mRNA分子常带有多个功能相关蛋白质的编码信息,以一种多顺反子的形式排列,在翻译过程中可同时合成几种蛋白质,而真核细胞中,每种mRNA一般只带有一种蛋白质编码信息,是单顺反子的形式。mRNA以它分子中的核苷酸排列顺序携带从DNA传递来的遗传信息,作为蛋白质生物合成的直接模板,决定蛋白质分子中的氨基酸排列顺序。不同的蛋白质有各自不同的mRNA,mRNA除含有编码区外,两端还有非编码区。非编码区对于mRNA的模板活性是必需的,特别是5’端非编码区在蛋白质合成中被认为是与核糖体结合的部位。见图18-2。
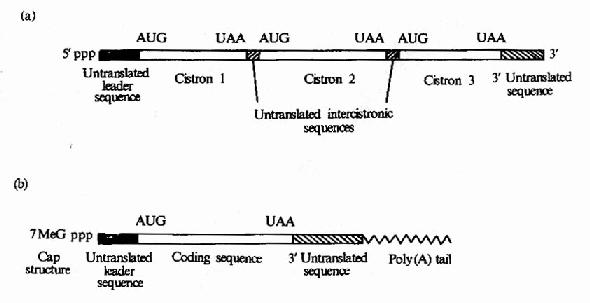
图18-2 (a)原核生物mRNA)为多顺反子(b)真核生物mRNA为单顺反子
mRNA分子上以5'→3'方向,从AUG开始每三个连续的核苷酸组成一个密码子,mRNA中的四种碱基可以组成64种密码子。这些密码不仅代表了20种氨基酸,还决定了翻译过程的起始与终止位置。每种氨基酸至少有一种密码子,最多的有6种密码子。从对遗传密码性质的推论到决定各个密码子的含义,进而全部阐明遗传密码,是科学上最杰出的成就之一,科学家们设计了十分出色的遗传学和生物化学实验,于1966年编排出了遗传密码字典。见表18-1。
表18-1 氨基酸的密码(code)
| 5’末端(第1位碱基) |
中间碱基(第二位碱基) |
3’末端(第三位碱基) |
| U |
C |
A |
G |
| U |
苯丙(Pne)F |
丝(Ser)S |
酪(Tyr)Y |
半胱(Cys)C |
U |
| 苯内(Pne) |
丝(Ser) |
酪(Tyr) |
半胱(Cys) |
C |
| 亮(Leu)L |
丝(Ser) |
终止信号 |
终止信号 |
A |
| 亮(Leu) |
丝(Ser) |
终止信号 |
色(Trp) |
G |
| C |
亮(Leu) |
脯(Pro)P |
组(His)H |
精(Arg)R |
U |
| 亮(Leu) |
脯(Pro) |
组(His) |
精(Arg) |
C |
| 亮(Leu) |
脯(Pro) |
谷胺(Gin)Q |
精(Arg) |
A |
| 亮(Leu) |
脯(Pro) |
谷胺(Gin) |
精(Arg) |
G |
| A |
|
|
|
|
|
| 异亮(ILe)I |
苏(Thr)T |
天胺(Asn)N |
丝(Ser)S |
U |
| 异亮(ILe) |
苏(Thr) |
天胺(Asn) |
丝(Ser) |
C |
| 异亮(ILe) |
苏(Thr) |
赖(Lys)K |
精(Arg)R |
A |
| *蛋(Met)M(起动信号) |
苏(Thr) |
赖(Lys) |
精(Arg) |
G |
| G |
|
|
|
|
|
| 缬(Val)V |
丙(Ala)A |
天(Asp)D |
甘(Gly)G |
U |
| 缬(Val) |
丙(Ala) |
天(Asp) |
甘(Gly) |
C |
| 缬(Val) |
丙(Ala) |
谷(Glu)E |
甘(Gly) |
A |
| 缬(Val) |
丙(Ala) |
谷(Glu) |
甘(Gly) |
G |
*位于mRNA起动部位AUG为氨基酸合成肽链的起动信号。以哺乳动物为代表的真核生物,此密码子代表蛋氨酸;以微生物为代表的原核生物则代表甲酰蛋氨酸。
遗传密码具有以下几种特点:
(1)起始码与终止码(Initiation codon and termination codon):
密码子AUG是起始密码,代表合成肽链的第一个氨基酸的位置,它们位于mRNA5′末端,同时它也是蛋氨酸的密码子,因此原核生物和真核生物多肽链合成的第一个氨基酸都是蛋氨酸,当然少数细菌中也用GUG做为起始码。在真核生物CUG偶尔也用作起始蛋氨酸的密码。密码子UAA,UAG,UGA是肽链成的终止密码,不代表任何氨基酸,它们单独或共同存在于mRNA3’末端。因此翻译是沿着mRNA分子5′→3′方向进行的。
(2)密码无标点符号:两个密码子之间没有任何核苷酸隔天,因此从起始码AUG开始,三个碱基代有一个氨基酸,这就构成了一个连续不断的读框,直至终止码。如果在读框中间插入或缺失一个碱基就会造成移码突变,引起突变位点下游氨基排列的错误。
(3)密码的简并性(Degemeracy):
一种氨基酸有几组密码子,或者几组密码子代表一种氨基酸的现象称为密码子的简并性,这种简并性主要是由于密码子的第三个碱基发生摆动现象形成的,也就是说密码子的专一性主要由前两个碱基决定,即使第三个碱基发生突变也能翻译出正确的氨基酸,这对于保证物种的稳定性有一定意义。如:GCU,GCC,GCA,GCG都代表丙氨酸。
(4)密码的通用性:
大量的事实证明生命世界从低等到高等,都使用一套密码,也就是说遗传密码在很长的进化时期中保持不变。因此这张密码表是生物界通用的。然而,出乎人们预料的是,真核生物线粒体的密码子有许多不同于通用密码,例如人线粒体中,UGA不是终止码,而是色氨酸的密码子,AGA,AGG不是精氨酸的密码子,而是终止密码子,加上通用密码中的UAA和UAG,线粒体中共有四组终止码。内部甲硫氨酸密码子有两个,即AUG和AUA;而起始甲硫氨酸密码子有四组,即AUN。
密码子结构与氨基酸侧链析性之间也有一定关系。①氨基酸侧链极性性质在多数情况下由断面子的第二个碱基决定。第二个碱基为嘧啶(Y)时,氨基酸侧链为非极性,第二个碱基为嘌呤时,氨基酸侧链则有极性。②当第一个碱基为U或A,第二个碱基为C,第三个碱基无特异性时,所决定的氨基酸侧链为极性不带电。③当第一个碱基不是U,第二个碱基是P时,氨基酸侧链则带电。在此前提下,若是一个是C或A时,表示带正电的氨基酸,第一、二个碱基分别是G、A时,此种氨革酸带负电,但上述关系也有个别例外。
一种氨基酸由多种密码子所编码的事实使人想到:同一种氨基酸的一组密码子的使用频率是否相同?许多实验证实,在原核生物和高等真核生物中同一组密码子的使用频率是不相同的。高频密码子多出现在那些表达量高的蛋白质基因中,例如,核糖体蛋白质基因,RecA蛋白质基因等。表18-2。这种使用频率与细胞内一组tRNA中的不同tRNA含量有关。
(三)tRNA是氨基酸的运载工具:
tRNA在蛋白质生物合成过程中起关键作用。mRNA推带的遗传信息被翻译成蛋白质一级结构,但是mRNA分子与氨基酸分子之间并无直接的对应关系。这就需要经过第三者“介绍”,而tRNA分子就充当这个角色。tRNA是类小分子RNA,长度为73-94个核苷酸,tRNA分子中富含稀有碱基和修饰碱基,tRNA分子3’端均为CCA序列,氨基酸分子通过共价键与A结合,此处的结构也叫氨基酸臂。每种氨基酸都有2-6种各自特异的tRNA,它们之间的特异性是靠氨基酰tRNA合成酶来识别的。这样,携带相同氨基酸而反密码子不同的一组tRNA称为同功tRNA,它们在细胞内合成量上有多和少的差别,分别称为主要tRNA和次要tRNA。主要tRNA中反密码子识别tRNA中的高频密码子,而次要tRNA中反密码子识别mRNA中的低频密码子。每种氨基酸都只有一种氨基酰tRNA合成酶。因此细胞内有20种氨基酰tRNA合成酶。
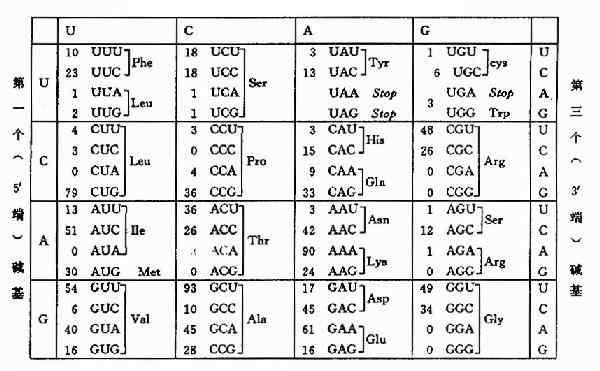
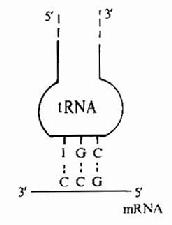
图18-3 密码子和反密码子的相互作用
tRNA分子中还有一个反密码环,此环上的三个反密码子的作用是与mRNA分子中的密码子靠碱基配对原则而形成氢键,达到相互识别的目的。但在密码子与反密码子结合时具有一定摆动性,即密码子的第3位碱基与反密码子的第1位碱基酸对时并不严格,见图18-3。配对摆动性完全是由tRNA反密码子的空间结构所决定的。反密码的第1位碱基常出现次黄嘌呤I,与A、C、U之间皆可形成氢键而结合,这是最常见的摆动现象。这种摆动现象使得一个tRNA所携带的氨基酸可排列在2-3个不同的密码子上,因此当密码子的第3位碱基发生一定程度的突变时,并不影响tRNA带入正确的氨基酸。
表18-3 反密码与密码碱基配对时的摇摆现象
| 反密码第1位碱基 |
A |
C |
G |
U |
1 |
| 密码第3位碱基 |
U |
G |
C,U |
A,G |
A,C,U |
在蛋白质生物合成过程中,特异识别mRNA上起始密码子的tRNA被称为起始tRNA,它们参加多肽链合成的起始,其它在多肽链延伸中运载氨基酸的tRNA,统称为延伸tRNA。
(四)核糖核蛋白体
核蛋白体是由rRNA和几十种蛋白质组成的亚细胞颗粒,位于胞浆内,可分为两类,一类附着于粗面内质网,主要参与白蛋白、胰岛素等分泌性蛋白质的合成,另一类游离于胞浆,主要参与细胞固有蛋白质的合成。核糖体是细胞中的主要成分之一,在一个生长旺盛的细菌中大约不20000个核糖体,其中蛋白质占细胞总蛋白质的10%,RNA占细胞总RNA的80%。
任何生物的核糖体都是由大、小两个亚基组成,现将大肠杆菌核糖体和大鼠肝细胞核糖体的蛋白质组分和RNA组成列表于18-4。1968年已在体外对大肠杆菌小亚基进行了自我装配研究,加入16s rRNA和21种蛋白质,即可形成有天然活性的30s小亚基。通过这些研究使人们能够进一步认识小亚基和大亚基中rRNA与蛋白质的特异功能。核糖体是高度复杂的体系,它的任何个别组分或局部组分都不能起整体的作用,因此必须研究核糖体中蛋白质和RNA的空间结构和位置,才能更完全地了解蛋白质合成的具体过程。过去一直认为rRNA主要起着结构上的作用,蛋白质发挥催化功能,但现在认为rRNA与蛋白质共同的构成的核糖体功能区是核蛋白体表现功能的重要部位,如GTP酶功能区,转肽酶功能区以及mRNA功能区等等。
表18-4 核蛋白体的组成及特性
| 来源 |
直径(毫微米) |
重量(道尔顿) |
含rRNA(%) |
含蛋白质(%) |
沉降系数 |
亚基 |
含rRNA |
含蛋白质种数 |
每个细胞内含有的个数 |
| 种类 |
分子量 |
| 真核细胞胞液 |
20~22 |
3.6×106 |
55 |
45 |
77S~80s |
40S(小) |
18S |
-70万 |
~34 |
106~107 |
| 60S(大) |
5s 5.8S 28S~29S |
3万 4万 140~180万 |
~40 |
| 原核细胞胞液 |
18 |
2.6×106 |
60~65 |
30~35 |
70S |
30S(小) |
16S |
55万 |
~34 |
1.5×104 |
| 50S(大) |
5s 23S |
4万 110万 |
注:真核细胞线粒体的核蛋白体组成及特性与原核细胞胞液的相同
核蛋白体作为蛋白质的合成场所具有以下几种作用:
(1)mRNA结合位点:位于30s小亚基头部,此处有几种蛋白质构成一个上的结构域,负丙与mRNA的结合,特别是16srRNA3’端与mRNa AUG之前的一段序列互补是这种结合必不可少的,见表18-5。
表18-5 大肠杆菌mRNA起始密码上游区域SD序列和16srRNA的互补
| MS2外壳蛋白 MS2复制酶 MS2A蛋白 λCro galE β-内酰氨酶 脂蛋白 核糖体蛋白S12 RNA聚合酶β trpE |
3’HOAU UCCUCCACUAG……5’ 5’……UCAACC GGAGUUUGAAUCAUG…3’ 5’……CAAACAU GAGGAUUACCCAUG …3’ 5’…… UCCU AGGAGGUUUGACCUGUG…3’ 5’…… AUGUAC UAAGGAGGUUGUAUG…3’ 5’…… AGCCUAAU GGAGCGAAUUAUG…3’ 5’…… UAUUGAAA AAGGAAGAGUAUG…3’ 5’…… AUCUA GAGGGUAUUAAUAAUG…3’ 5’…… AAAACCAGGAGCUAUUUAAUG…3’ 5’…… AGCGAGCU GAGGAACCCUAUG…3’ 5’…… CAAAAUUAGAGAAUAACAAUG…3’ |
(2)P位点:(peptidyl tRNA site)
又叫做肽酰基tRNA位或给位。它大部分位于小亚基,小部分位于大亚基,它是结合起始tRNA 并向A位给出氨基酸的位置(图18-4)。
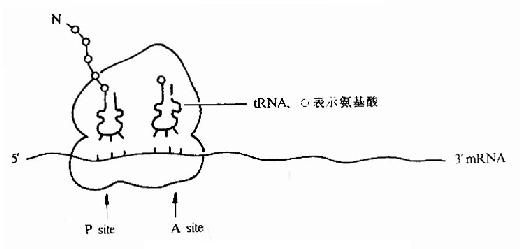
图18-4 翻译过程中的核糖体图解
(3)A位点:(Aminoacyl-tRNA site)
叫做氨基酰 tRNa 位或受位。它大部分位于大亚基而小部分位于小亚基,它是结合一个新进入的氨基酰tRNA 的位置(见后节叙述)。
(4)转肽酶活性部位:
位于P位和A位的连接处。
(5)结合参与蛋白质合成的起始因了(Initiation Factor,IF)、延长因子(ElengationFactor,EF)和终止因子或释放因子(Release Factor,RF)。
第二节 蛋白质生物合成过程
蛋白质生的合成亦称为翻译(Translation),即把mRNA分子中碱基排列顺序转变为蛋折质或多肽链中的氨基酸排列顺序过程。这也是基因表达的第二步,产生基因产物蛋白质的最后节段。不同的组织细胞具有不同的生理功能,是因为它们表达不同的基因,产生具有特殊功能的蛋白质,参与蛋白质生物合成的成份至少有200种,其主要体第主要由mRNA、tRNA、核糖核蛋白体以及有关的酶和蛋白质因子共同组成。
原核生物与真核生物的蛋白质合成过程中有很多的区别,真核生物此过程更复杂,下面着重介绍原核生物蛋白质合成的过程,并指出真核生物与其不同这处。
蛋白质生物合成可分为五个阶段,氨基酸的活化、多肽链合成的起始、肽链的延长、肽链的终止和释放、蛋白质合成后的加工修饰。
(一)氨基酰-tRNA的生成
氨基酸在进行合成多肽链之前,必须先经过活化,然后再与其特异的tRNA结合,带到mRNA相应的位置上,这个过程靠氨基酰tRNA合成酶催化,此酶催化特定的氨基酸与特异的tRNA相结合,生成各种氨基酰tRNA.每种氨基酸都靠其特有合成酶催化,使之和相对应的tRNA结合,在氨基酰tRNA合成酶催化下,利用ATP供能,在氨基酸羧基上进行活化,形成氨基酰-AMP,再与氨基酰tRNA合成酶结合形成三联复合物,此复合物再与特异的tRNA作用,将氨基酰转移到tRNA的氨基酸臂(即3'-末端CCA-OH)上(图18-5和图18-6)。
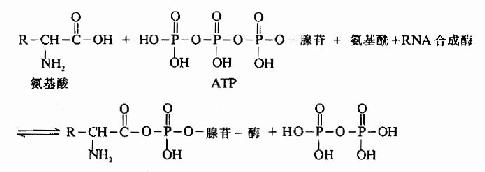
图18-6 氨基酰-tRNA的生成
原核细胞中起始氨基酸活化后,还要甲酰化,形成甲酰蛋氨酸tRNA,由N10甲酰四氢叶酸提供甲酰基。而真核细胞没有此过程。
前面讲过运载同一种氨基酸的一组不同tRNA称为同功tRNA。一组同功tRNA由同一种氨酰基tRNA合成酶催化。氨基酰tRNA合成酶对tRNA和氨基酸两者具有专一性,它对氨基酸的识别特异性很高,而对tRNA识别的特异性较低。
氨基酰tRNA合成酶是如何选择正确的氨基酸和tRNA呢?按照一般原理,酶和底物的正确结合是由二者相嵌的几何形状所决定的,只有适合的氨基酸和适合的tRNA进入合成酶的相应位点,才能合成正确的氨酰基tRNA。现在已经知道合成酶与L形tRNA的内侧面结合,结合点包括接近臂,DHU臂和反密码子臂(图18-7)。
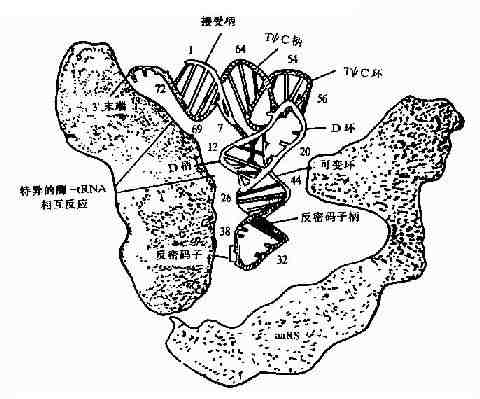
图18-7 氨基酰-tRNA合成酶与tRNA的相互作用,可见氨酸接受柄、
D柄、反密码子和可变环与酶反应
乍看起来,反密码子似乎应该与氨基酸的正确负载有关,对于某些tRNA也确实如此,然而对于大多数tRNA来说,情况并非如此,人们早就知道,当某些tRNA上的反密码子突变后,但它们所携带的氨工酸却没有改变。1988年,候稚明和Schimmel的实验证明丙氨酸tRNA酸分子的氨基酸臂上G3:U70这两个碱基发生突变时则影响到丙氨酰tRNA合成酶的正确识别,说明G3:U70是丙氨酸tRNA分子决定其本质的主要因素。tRNA分子上决定其携带氨基酸的区域叫做副密码子。一种氨基酰tRNA合成酶可以识别以一组同功tRNA,这说明它们具有共同特征。例如三种丙氨酸tRNA(tRNAAlm/CUA,tRNAAim/GGC,tRNAAin/UGC都具有G3:U70副密码子。)但没有充分的证据说明其它氨基酰tRNA合成酶也识别同功tRNA组中相同的副密码子。另外副密码子也没有固定的位置,也可能并不止一个碱基对。
(二)多肽链合成的起始
核蛋白体大小亚基,mRNA起始tRNA和起始因子共同参与肽链合成的起始。
1、大肠杆菌细胞翻译起始复合物形成的过程:
(1)核糖体30S小亚基附着于mRNA起始信号部位:原核生物中每一个mRNA都具有其核糖体结合位点,它是位于AUG上游8-13个核苷酸处的一个短片段叫做SD序列。这段序列正好与30S小亚基中的16s rRNA3’端一部分序列互补,因此SD序列也叫做核糖体结合序列,这种互补就意味着核糖体能选择mRNA上AUG的正确位置来起始肽链的合成,该结合反应由起始因子3(IF-3)介导,另外IF-1促进IF-3与小亚基的结合,故先形成IF3-30S亚基-mRNA三元复合物。
(2)30S前起始复合物的形成:在起始因子2作用下,甲酰蛋氨酰起始tRNA与mRNA分子中的AUG相结合,即密码子与反密码子配对,同时IF3从三元复合物中脱落,形成30S前起始复合物,即IF2-3S亚基-mRNA-fMet-tRNAfmet复合物,此步需要GTP和Mg2+参与。
(3)70S起始复合物的形成:50S亚基上述的30S前起始复合物结合,同时IF2脱落,形成70S起始复合物,即30S亚基-mRNA-50S亚基-mRNA-fMet-tRNAfmet复合物。此时fMet-tRNAfmet占据着50S亚基的肽酰位。而A位则空着有待于对应mRNA中第二个密码的相应氨基酰tRNA进入,从而进入延长阶段,以上过程见图18-8和图18-9。

图18-8 大肠杆菌起始复合物的形成
2、真核细胞蛋白质合成的起始
真核细胞蛋白质合成起始复合物的形成中需要更多的起始因子参与,因此起始过程也更复杂。
(1)需要特异的起始tRNA即,-tRNAfmet,并且不需要N端甲酰化。已发现的真核起始因子有近10种(eukaryote Initiation factor,eIF)
(2)起始复合物形成在mRNA5’端AUG上游的帽子结构,(除某些病毒mRNA外)
(3)ATP水解为ADP供给mRNA结合所需要的能量。真核细胞起始复合物的形成过程是:翻译起始也是由eIF-3结合在40S小亚基上而促进80S核糖体解离出60S大亚基开始,同时eIF-2在辅eIF-2作用下,与Met-tRNAfmet及GTP结合,再通过eIF-3及eIF-4C的作用,先结合到40S小亚基,然后再与mRNA结合。
mRNA结合到40S小亚基时,除了eIF-3参加外,还需要eIF-1、eIF-4A及eIF-4B并由ATP小解为ADP及Pi来供能,通过帽结合因子与mRNA的帽结合而转移到小亚基上。但是在mRNA5’端并未发现能与小亚基18SRNA配对的S-D序列。目前认为通过帽结合后,mRNA在小亚基上向下游移动而进行扫描,可使mRNA上的起始密码AUG在Met-tRNAfmet的反密码位置固定下来,进行翻译起始。
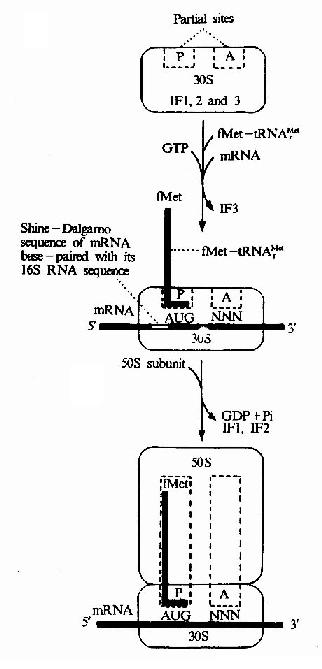
图18-9 Initiationof translation im E.cole.The initiating tRNA,tRNAMetf,is represented by theblue line,the anticodon being the horizontal short line.The fMet-tRNAMetf isdelivered to the 30s subunit by IF2.NNN represents any codon (N for anynucleotie).Note.The ribosome also has an exit site not shown in thediagram.This site will be discussed later.
通过eIF-5的作用,可使结合Met-tRNAfmet·GTP及mRNAR40S小亚基与60S大亚基结合,形成80S复合物。eIF-5具有GTP酶活性,催化GTP水解为GDP及Pi,并有利于其它起始因子从40S小亚基表面脱落,从而有利于40S与60S两个亚基结合起来,最后经eIF-4D激活而成为具有活性的80SMet-tRNAfmet·mRNA起始复合物。
真核细胞翻译起始复合物的生成见图18-10和图18-11。
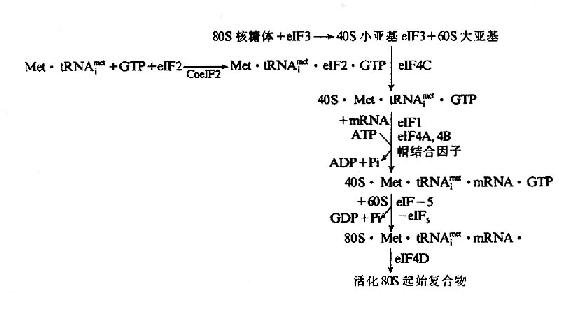
图18-10 真核细胞翻译起始复合物的形成
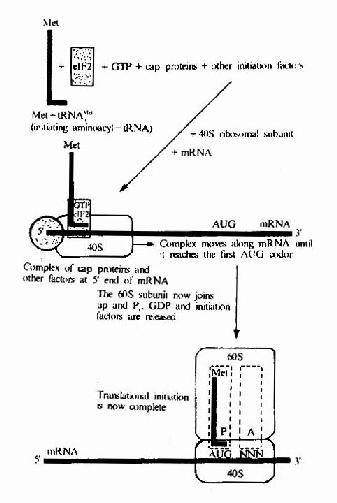
图18-11 Simplified diagram of initiation in eukaryotes.Note that severaleukaryote initiation factors besides elF2 are involved .tRNAMeti,initiatingRNA.e1F2 is the eukaryotic initiation factor corresponding to IF2 inprokaryotes.
(三)多肽链的延长:
在多肽链上每增加一个氨基酸都需要经过进位,转肽和移位三个步骤。
(1)为密码子所特定的氨基酸tRNA结合到核蛋白体的A位,称为进位。氨基酰tRNA在进位前需要有三种延长因子的作用,即,热不稳定的EF(Unstable temperature,EF)EF-Tu,热稳定的EF(stable temperature EF,EF-Ts)以及依赖GTP的转位因子。EF-Tu首先与GTP结合,然后再与氨基酰tRNA结合成三元复合物,这样的三元复合物才能进入A位。此时GTP水解成GDP,EF-Tu和GDP与结合在A位上的氨基酰tRNA分离(图18-12)。
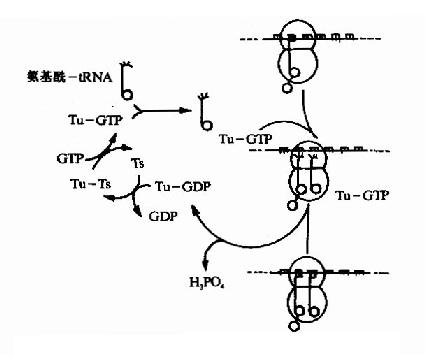
图18-12 原核生物肽链延长因子EFTu与EFTs的作用原理
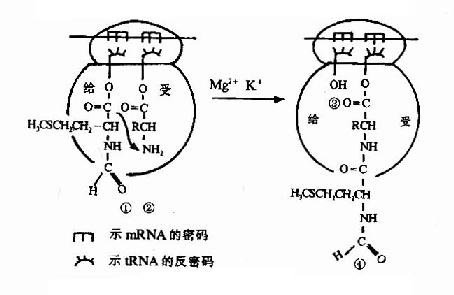
图18-13 肽键的形成
①核蛋白体“给位”上携甲酰蛋氨酰 基(或肽酰)的tRNA
②核蛋白体“受体”上新进入的氨基酰tRNA;
③失去甲酰蛋氨酰基(或肽酰)后,即将从核蛋白体脱落的tRNA;
④接受甲酰蛋氨酰基(或肽酰)后已增长一个氨基酸残基的肽键
(2)转肽--肽键的形成(peptide bond formation)
在70S起始复合物形成过程中,核糖核蛋白体的P位上已结合了起始型甲酰蛋氨酸tRNA,当进位后,P位和A位上各结合了一个氨基酰tRNA,两个氨基酸之间在核糖体转肽酶作用下,P位上的氨基酸提供α-COOH基,与A位上的氨基酸的α-NH2形成肽键,从而使P位上的氨基酸连接到A位氨基酸的氨基上,这就是转肽。转肽后,在A位上形成了一个二肽酰tRNA(图18-13)。
(3)移位(Translocation)
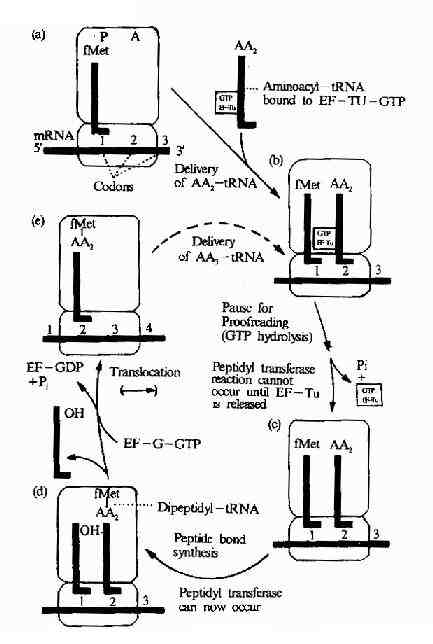
图18-14 Diagram of the elongation process in protein synthesis followinginitation.tRNAs are shown as lue lines;AA,aamicoacyl group.The positioningshown of the EF-Tu-GTP on the tRNA and on the ribosome are arbitraty .Thisdiagram does not make evident why the ribosomal enzyme catalysing the peptidebond synthesis is called peptidyl transferase .However,if you do the next roundof synthesis yourself(see text),you will see that in all subsequent rounds ofsynthesis it is a peptide that is transferred to the incoming aminoacyltRNA-hence the name.
转肽作用发生后,氨基酸都位于A位,P位上无负荷氨基酸的tRNA就此脱落,核蛋白体沿着mRNA向3’端方向移动一组密码子,使得原来结合二肽酰tRNA的A位转变成了P位,而A位空出,可以接受下一个新的氨基酰tRNA进入,移位过程需要EF-2,GTP和Mg2+的参加(图18-14)。
以后,肽链上每增加一个氨基酸残基,即重复上述进位,转肽,移位的步骤,直至所需的长度,实验证明mRNA上的信息阅读是从5’端向3’端进行,而肽链的延伸是从氮基端到羧基端。所以多肽链合成的方向是N端到C端(图18-15)。
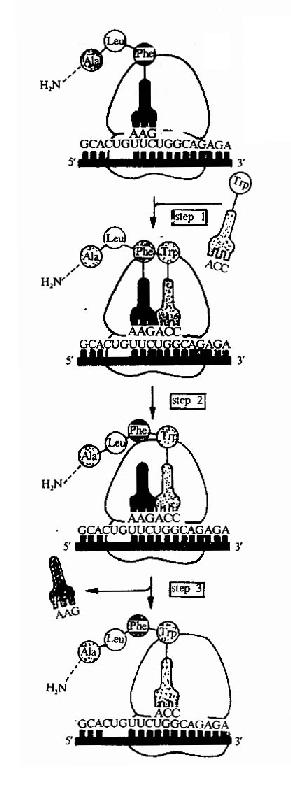 |
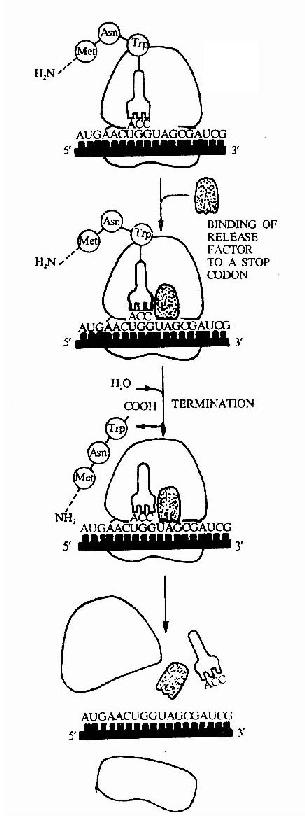 图18-16 The final phase of protein synthesis .The binding of release factor to a stop codon terminates translation.The completed polypeptide is released,and the ribosome dissociates into two separte subunits. |
| 图18-15 The elongation phase of protein synthesis on a ribosome.The three-step cycle shown is repeated over and over during the synthesos of a protein chain.An aminoacyl-tRNA moleculie binds to the A-site on the rebosome is step l,a new peptide bond is formed in sted 2,and the ribosome moves a distance of three nucleotides along the mRNA chain in step 3,ejecting an old tRNA molecule and "resetting" the ribosome so that the next aminoacyl-tRNA molecule can bind.As indicated in Figure 6-21,the p-site is drawn on the left side of the ribosome,with the A-site on the right. |
(四)翻译的终止及多肽链的释放:
无论原核生物还是真核生物都有三种终止密码子UAG,UAA和UGA。没有一个tRNA能够与终止密码子作用,而是靠特殊的蛋白质因子促成终止作用。这类蛋白质因子叫做释放因子,原核生物有三种释放因子:RF1,RF2t RF3。RF1识别UAA和UAG,RF2识别UAA和UGA。RF3的作用还不明确。真核生物中只有一种释放因子eRF,它可以识别三种终止密码子。
不管原核生物还是真核生物,释放因子都作用于A位点,使转肽酶活性变为水介酶活性,将肽链从结合在核糖体上的tRNA的CCA末凋上水介下来,然后mRNA与核糖体分离,最后一个tRNA脱落,核糖体在IF-3作用下,解离出大、小亚基。解离后的大小亚基又重新参加新的肽链的合成,循环往复,所以多肽链在核糖体上的合成过程又称核糖体循环(ribosome cycle)(图18-16)。
(五)多核糖体循环:
上述只是单个核糖体的翻译过程,事实上在细胞内一条mRNA链上结合着多个核糖体,甚至可多到几百个。蛋白质开始合成时,第一个核糖体在mRNA的起始部位结合,引入第一个蛋氨酸,然后核糖体向mRNA的3’端移动一定距离后,第二个核糖体又在mRNA的起始部位结合,现向前移动一定的距离后,在起始部位又结合第三个核糖体,依次下去,直至终止。两个核糖体之间有一定的长度间隔,每个核糖体都独立完成一条多肽链的合成,所以这种多核糖体可以在一条mRNA链上同时合成多条相同的多肽链,这就大大提高了翻译的效率(图18-17)。
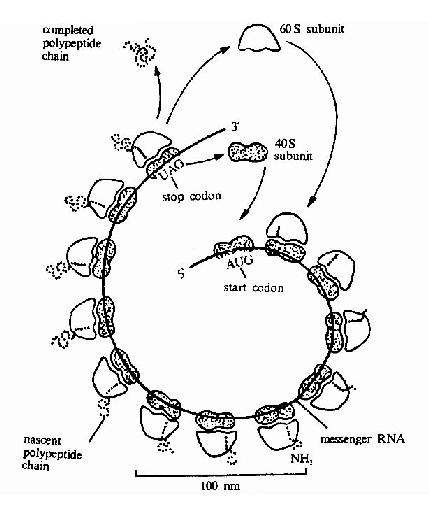
图18-17 A polyribosome.Schematicdrawing showing how a series of ribosomes can simultaneously translate the samemRNA molecule.
多聚核糖体的核糖体个数,与模板mRNA的长度有关,例如血红蛋白的多肽链mNRA编码区有450个核苷酸组成,长约150nm。上面串连有5-6个核糖核蛋白体形成多核糖体。而肌凝蛋白的重链mRNA由5400个核苷酸组成,它由60多个核糖体构成多核糖体完成多肽链的合成。
第三节 蛋白质合成后的分泌及加工修饰
不论是原核还是真核生物,在细胞浆内合成的蛋白质需定位于细胞特定的区域,有些蛋白质合成后要分泌到细胞外,这些蛋白质叫做分必蛋白。在细菌细胞内起作用的蛋白质一般靠扩散作用而分布到它们的目的地。如内膜含有参与能量代谢和营养物质转运的蛋白质;外膜含有促进离子和营养物质进入细胞的蛋白质;在内膜与外膜之间的间隙称为周质,其中含有各种水解酶以及营养物质结合蛋白。
真核生物细胞结构更为复杂,而且有多种不同的细胞器,它们又具有各不相同的膜结构,因此合成好的蛋白质还要面临跨越不同的膜而到达细胞器械,有些蛋白质在翻译完成后还要经过多种共价修饰,这个过程叫做翻译后处理。
(一)细菌中蛋白质的越膜
细胞的内膜蛋白,外膜蛋白和周质蛋白是怎样越过内膜而到其目的地的呢?绝大多数越膜蛋白的N端都具有大约15-30个以疏水氨基酸为主的N端信号序列或称信号肽。信号肽的疏水段能形成一段α螺旋结构。在信号序列之后的一段氨基酸残基也能形成一段α螺旋,两段α螺旋以反平行方式组成一个发夹结构,很容易进入内膜的脂双层结构,一旦分泌蛋白质的N端锚在膜内,后续合成的其它肽段部分将顺利通过膜。疏水性信号肽对于新生肽链跨膜及把它固定的膜上起一个拐掍作用。之后位于内膜外表面的信号肽酶将信号肽序列切除。当蛋白质全部翻译出来后,羧端穿过内膜,在周质中折叠成蛋白质的最终构象(图18-18)。
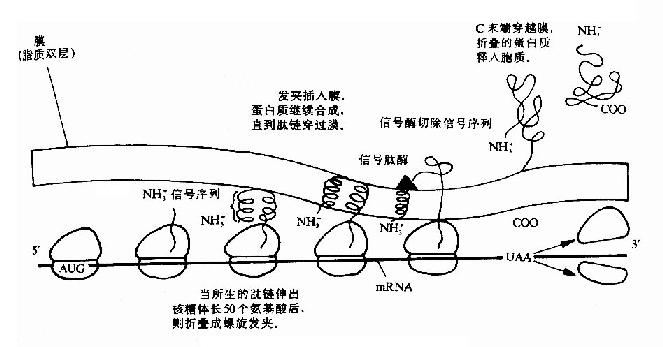
图18-18 蛋白质合成后的分泌过程
(二)真核生物蛋白质的分泌
真核生物不但有细胞核、细胞质和细胞膜,而且还有许多膜性结构的细胞器,在细胞须内合成的蛋白质怎样的到达细胞的不同部位呢?了解比较清楚的是分泌性蛋白质的转运。
像原核细胞一要,真核细胞合成的蛋白质N端也有信号肽也能形成两个α螺旋的发夹结构,这个结构可插入到内质网的膜中,将正在合成中的多肽链带和内质网内腔。80年代中期在胞浆中发现一种由小分子RNA和蛋白质共同组成的复合物,它能特异地与信号肽识别而命名为信号肽识别颗粒。它的作用是识别信号肽与核糖体结合并暂时阻断多肽链的合成。内质网外膜上的SRP受体,当ARP与受体结合后,信号肽就可插入内质网进入内腔,被内质网内膜壁上的信号肽酶水解除去SRP与受体结合后,信号肽就可插入内质网进入内腔,被内质网内腔壁上的信号肽酶水解除去SRP与受体解离并进入新的循环,而信号肽后序肽段也进入内质网内腔,并开始继续合成多肽链(图18-19)。
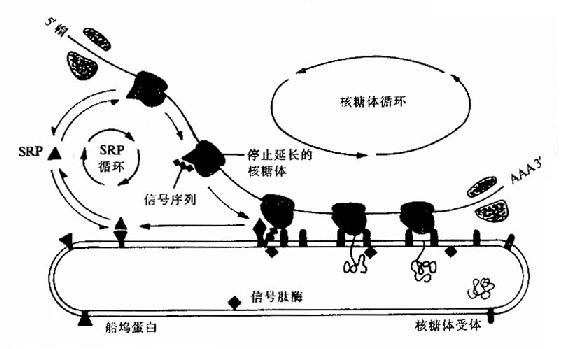
图18-19 在蛋白质越过内质网的转运过程中,SRP和船坞蛋白(或SRP受体)的作用
SRP对翻译阶段作用的重要生理意义在于:分泌性蛋白及早进入细胞的膜性细胞,能够正确的折叠、进行必要的后期加工与修饰并顺利分泌出细胞。
现以哺乳动物的胰岛素为例说明这种分泌过程。胰岛素由51个氨基酸残基组成,但胰岛素mRNA的翻译产和在兔网织红细胞无细胞翻译体系中为86个氨基酸残基,称为胰岛素原,在麦胚无细胞翻译系统中为110个氨基酸残基组成的前胰岛素原,后来证明,在前胰岛素原的N末端有一段富含疏水氨基酸的肽段做为信号肽,使前胰岛素原能穿越内质网膜进入内质网内腔,在内腔壁上信号肽被水介。所以在哺乳动物细胞内,当多肽链合成完成时,前胰岛素原已成为胰岛素原。然后胰岛素原被运到高尔基复合体,切去C肽成为成熟的胰岛素,最终排出胞外。像真核细胞的前清蛋白,免疫球白轻链,催乳素等都有相似的分必方式。
(三)蛋白质翻译后加工修饰
从核糖体上释放出来的多肽链,按照一级结构中氨基酸侧链的性质,自竹卷曲,形成一定的空间结构,过去一直认为,蛋白质空间结构的形成靠是其一级结构决定的,不需要另外的信息。近些年来发现许多细胞内蛋白质正确装配都需要一类称做“分了伴娘”的蛋白质帮助才能完成,这一概念的提出并未否定“氨基酸顺序决定蛋白空间结构”这一原则。而是对这一理论的补充,分子伴娘这一类蛋白质能介导其它蛋白质正确装配成有功能活性的空间结构,而它本身并不参与最终装配产物的组成。目前认为“分子伴娘”蛋白有两类,第一类是一些酶,例如蛋白质二硫键异构酶可以识别和水解非正确配对的二硫键,使它们在正确的半胱氨酸残基位置上重新形成二硫键,第二类是一些蛋白质分子,它们可以和部分折叠或没有折叠的蛋白质分子结合,稳定它们的构象,免遭其它酶的水解或都促进蛋白质折叠成正确的空间结构。总之“分子伴娘”蛋白质合成后折叠成正确空间结构中起重要作用,对于大多数蛋白质来说多肽链翻译后还要进行下列不同方式的加工修饰才具有生理功能。
1.氨基端和羧基端的修饰
在原核生物中几乎所有蛋白质都是从N-甲酰蛋氨酸开始,真核生物从蛋氨酸开始。甲酰基经酶水介而除去,蛋氨酸或者氨基端的一些氨基酸残基常由氨肽酶催化而水介除去。包括除去信号肽序列。因此,成熟的蛋白质分子N-端没有甲酰基,或没有蛋氨酸。同时,某些蛋白质分子氨基端要进行乙酰化在羧基端也要进行修饰。
2.共价修饰
许多的蛋白质可以进行不同的类型化学基团的共价修饰,修饰后可以表现为激活状态,也可以表现为失活状态。
(1)磷酸化:
磷酸化多发生在多肽链丝氨酸,苏氨酸的羟基上,偶尔也发生在酪氨酸残基上,这种磷酸化的过程受细胞内一种蛋白激酶催化,磷酸化后的蛋白质可以增加或降低它们的活性,例如:促进糖原分解的磷酸化酶,无活性的磷酸化酶b经磷酸化以后,变居有活性的磷酸化酶a。而有活性的糖原合成酶I经磷酸化以后变成无活性的糖原合成酶D,共同调节糖元的合成与分介。
(2)糖基化:
质膜蛋白质和许多分泌性蛋白质都具有糖链,这些寡糖链结合在丝氨酸或苏氨酸的羟基上,例如红细胞膜上的ABO血型决定簇。也可以与天门冬酰胺连接。这些寡糖链是在内质网或高尔基氏体中加入的(图18-20)。
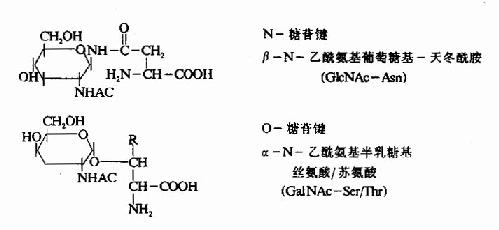
图18-20 糖蛋白中常见的糖一肽连接键
(3)羟基化:
胶原蛋白前α链上的脯氨酸和赖氨酸残基在内质网中受羟化酶、分子氧和维生素C作用产生羟脯氨酸和羟赖氨酸,如果此过程受障碍胶原纤维不能进行交联,极大地降低了它的张力强度。
(4)二硫键的形成:
mRNA上没有胱氨酸的密码子,多肽链中的二硫键,是在肽链合成后,通过二个半胱氨酸的疏基氧化而形成的,二硫键的形成对于许多酶和蛋白质的活性是必需的。
3.亚基的聚合:
有许多蛋白质是由二个以上亚基构成的,这就需这些多肽链通过非共价键聚合成多聚体才能表现生物活性。例如成人血红蛋白由两条α链,两条β链及四分子血红素所组成,大致过程如下:α链在多聚核糖体合成后自行释下,并与尚未从多聚核糖体上释下的β链相连,然后一并从多聚核糖体上脱下来,变成α、β二聚体。此二聚体再与线粒体内生成的两个血红素结合,最后形成一个由四条肽链和四个血红素构成的有功能的血红蛋白分子。
4.水介断链:
一般真核细胞中一个基因对应一个mRNA,一个mRNA对应一条多肽链,但也有少数的情况,即一种三思而行翻译后的多肽链经水介后产生几种不同的蛋白质或多肽。例如哺乳动物的鸦片样促黑皮激素原初翻译产物为265个氨基酸,它在脑下垂体前叶细胞中,POMC初切割成为N-端片断和C端片段的β-促脂解激素。然后N端片段又被切割成较小的N端片断和工9肽的促肾上腺皮质激素。而在脑下垂体中叶细胞中,β-促脂解激素再次被切割产生β-内啡肽;ACTH也被切割产生13肽的促黑激素(α-melanotropin)(图18-21)。
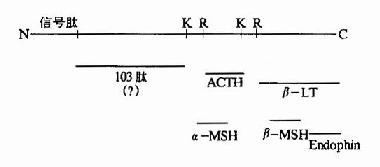
图18-21 POMC作为多种活性物质的前体
第一行为POMC前体,K、R为赖氨酸和精氨酸残基
第四节 蛋白质合成的抑制剂
影响蛋白质生物合成的物质非常多,它们可以作用于DNA复制和RNA转录,对蛋白质的生物合成起间接作用,本节主要讨论抑制蛋白质生物合成翻译过程的阻断剂。
(一)抗生素类阻断剂:
许多抗生素都是以直接抑制细菌细胞内蛋白质合成而对人体副作用最小为目的而设计的,它们可作用于蛋白质合成的各个环节,包括抑制起始因子,延长因子及核糖核蛋白体的作用等等。
1、链霉素、卡那霉素、新霉素等:
这类抗生素属于基甙类,它们主要抑制革兰氏阴性细菌蛋白质合成的三个阶段:①S起始复合物的形成,使氨基酰tRNA从复合物中脱落;②在肽链延伸阶段,使氨基酰tRNA与mRNA错配;③在终止阶段,阻碍终止因了与核蛋白体结合,使已合成的多肽链无法释放,而且还抑制70S核糖体的介离。
2、四环素和土霉素:
①作用于细菌内30S小亚基,抑制起始复合物的形成,②抑制氨西藏酰tRNA进入核糖体的A位,阻滞肽链的延伸;③影响终止因子与核糖体的结合,使已合成的多肽链不能脱落离核糖体。四环素类抗生素除对菌体70S核糖体有抑制作用外,对人体细胞的80S核糖体也有抑制作用,但对70S核糖体的敏感性更高,故对细菌蛋白质合成抑制作用更强。
3、氯霉素:
属于广谱抗生素。①氯霉素与核糖体上的A位紧密结合,因此阻碍氨基酰tRNA进入A位,②抑制转肽酶活性,使肽链延伸受到影响,菌体蛋白质不能合成,因此有较哟的抑菌作用。
4、嘌呤霉素(Puromycin)
结构与酪氨酰-tRNA相似,从而取代一些氨基酰tRNA进入核糖体的A位,当延长中的肽转入此异常A位时,容易脱落,终止肽链合成。由于嘌呤霉素对原核和真核生物的翻译过程均有干扰干扰作用,故难于用做抗菌药物,有人试用于肿瘤治疗(图18-22)。
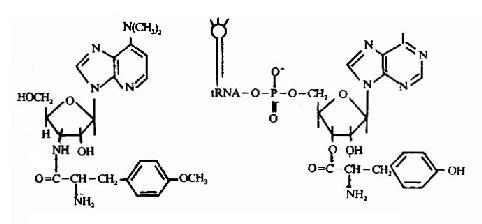
图18-22 嘌呤霉素(左)与tyr-tRNAtyr(右)
5、白喉霉素(diphtheria toxin)
由白喉杆菌所产生的白喉霉素是真核细胞蛋白质合成抑制剂。白喉霉素实际上是寄生于白喉杆菌体内的溶源性噬菌体β基因编码的由白喉杆菌转运分泌出来,进入组织细胞内,它对真核生物的延长因子-2(EF-2)起共价修饰作用,生成EF-2腺苷二磷酸核糖衍生物,从而使EF-2失活,它的催化效率很高,只需微量就能有效地抑制细胞整个蛋白质合成,而导致细胞死亡(图18-23)。
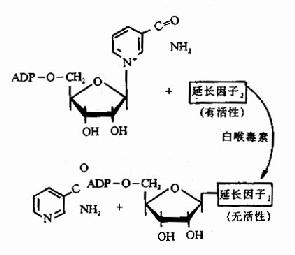
图18-23 白喉毒素的作用
(二)干扰素对病毒蛋白合成的抑制
干扰素(interferon)是病毒感染后,感染病毒的细胞合成和分泌的一种小分子蛋白质。从白细胞中得到α-干扰素,从成纤维细胞中得到β-干扰素,在免疫细胞中得到γ-干扰素。干扰素结合到未感染病毒的细胞膜上,诱导这些细胞产生寡核苷酸合成酶、核酸内切酶和蛋白激酶。在细胞未被感染时,不合成这三种酶,一旦被病毒感染,有干扰素或双链RNA存在时,这些酶被激活,并以不同的方式阻断病毒蛋白质的合成。干扰素和dsRNA激活蛋白激酶,蛋白激酶使蛋白质合成的起始因子磷酸化,使它失活,另一种方式是mRNA的降介,干扰素dsRNA激活2,5腺嘌呤寡核苷酸合成的酶的合成,2,5腺嘌呤寡核苷酸激活核酸内切酶,核酸内切酶水介mRNA(图18-24)。
由于干扰素具有很强的抗病毒作用,因此在医学上有重大的实用价值,但组织中含量很少,难于从生物组织中大量分离干扰素。现在已难应用基因工程合成干扰素以满足研究与临床应用的需要。
小结
蛋白质分子是由一个个氨基酸通过肽键连接起来的,在细胞内这种连接必须依靠核蛋白体循环来完成。mRNA携带合成蛋白质分子中氨基酸排列顺序遗传的信息。这是由每3个碱基组成一个密码来体现的,遗传密码共有64个密码子。UAA、UAG、UGA代表终止信号,AUG不仅代表起始信号,还代表蛋氨酸。tRNA携带特异的氨基酸,同时它的反密码子可识别mRNA上的密码子,核糖体上受位和给位结合的氨基酸在转肽酶的作用下形成肽键。
合成蛋白质分子的每个氨基酸首先要在特异的氨基酰tRNA合成的酶的作用下,与特异的tRNA结合,形成氨基酰tRNA,这就是氨基酸的活化。核蛋白循环过程中的起动阶段,首先要形成由起始因子,GTP、mRNA和大、小亚基构成的70S起始复合物,肽链延长时,每进入一个氨基酸,就按进位,转肽、脱落、移位、重复这四个步骤。终止时,在终止因子参与下,转肽酶将合成的肽链水解离开核糖体,核蛋白体也从mRNA脱落,重新进入又一个循环,蛋白质合成时,在一条mRNA链上,同时结合着多个核糖体,同时合成相同的多条肽链。
蛋白质合成也有许多加工修饰过程,剪切一部分肽段,加入糖、脂,进行磷酸化,羟化等等。多聚体构成的蛋白质还要经过聚合过程。
蛋白质合成的阻断剂很多,作用部位也各不相同,利用这些理论,对于研制各种抗生素有重要意义。
思考题
1、遗传密码表有哪些特点?
2、核蛋白体的主要组成及工作原理?
3、氨基酰tRNA合成酶的特点?
4、肽链合成时起始复合物的形成过程。
5、真核生物与原核生物蛋白质合成的主要异同。
6、分泌蛋白质的结构特点及加工后分泌过程是怎样进行的。