高等生物所处的环境无时无刻不在变化,机体功能上的协调统一要求有一个完善的细胞间相互识别、相互反应和相互作用的机制,这一机制可以称作细胞通讯(Cell Communication)。在这一系统中,细胞或者识别与之相接触的细胞,或者识别周围环境中存在的各种信号(来自于周围或远距离的细胞),并将其转变为细胞内各种分子功能上的变化,从而改变细胞内的某些代谢过程,影响细胞的生长速度,甚至诱导细胞的死亡。这种针对外源性信号所发生的各种分子活性的变化,以及将这种变化依次传递至效应分子,以改变细胞功能的过程称为信号转导(Signal Transduction),其最终目的是使机体在整体上对外界环境的变化发生最为适宜的反应。在物质代谢调节一章中曾涉及到神经-内分泌系统对代谢途径在整体水平上的调节,其实质就是机体内一部分细胞发出信号,另一部分细胞接收信号并将其转变为细胞功能上的变化的过程。所以,阐明细胞信号转导的机理就意味着认清细胞在整个生命过程中的增殖、分化、代谢及死亡等诸方面的表现和调控方式,进而理解机体生长、发育和代谢的调控机理。近年来,随着分子生物学技术手段的改进,人们对细胞内信号转导机理的认识也日益深入。现已知道,细胞内存在着多种信号转导方式和途径,各种方式和途径间又有多个层次的交叉调控,是一个十分复杂的网络系统。科学家们相信,将来他们会绘制出一个类似于代谢网络图的细胞信号传递的网络图,不过这个网络图可能较代谢图更为复杂。
第一节 细胞通讯方式
单细胞生物仅与环境交换信息,高等生物则根据自然需求进化出一套精细的调控通讯系统,以保持所有细胞行为的协调统一。细胞间主要以如下三种方式进行联络(图21-1)。
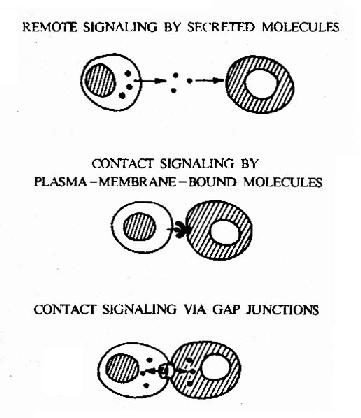
图21-1 三种细胞通讯的基本方式
(一)细胞间隙连接
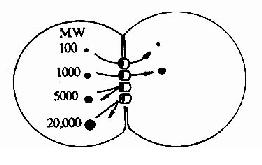
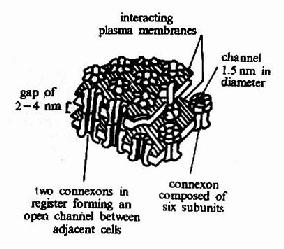
细胞间隙连接(Gap Junction)是一种细胞间的直接通讯方式。两个相邻的细胞间存在着一种特殊的由蛋白质构成的结构-连接子(Connexon),其结构见图21-2和图21-3。连接子两端分别嵌入两个相邻的细胞,形成一个亲水性孔道。这种孔道允许两个细胞间自由交换分子量为1500道尔顿以下的水溶性分子。这种直接交换的意义在于,相邻的细胞可以共享小分子物质,因此可以快速和可逆地促进相邻细胞对外界信号的协同反应。
连接子为一个多基因家庭,现已发现12个成员。在肿瘤生长和创伤愈合等过程中都观察到某些类型连接子表达的变化。因此,连接子可能对细胞的生长、分化、定位及细胞形态的维持具有重要意义。
(二)膜表面分子接触通讯
每个细胞都有众多的分子分布于膜的外表面。这些分子或为蛋白质,或为糖蛋白。这些表面分子作为细胞的触角,可以与相邻细胞的膜表面分子特异性地相互识别和相互作用,以达到功能上的相互协调。这种细胞通讯方式称为膜表面分子接触通讯(Contact signaling by plasma?membrane?bound molecules)。膜表面分子接触通讯也属于细胞间的直接通讯,最为典型的例子是T淋巴细胞与B淋巴细胞的相互作用(图21-4)。
 |
 |
| 图21-2 间隙连接功能示意图,荧光标记的不同大小的分子注入细胞后,依靠间隙连接进入另外一个细胞,图中数字表示分子量。 |
图21-3 间隙连接结构示意图 |
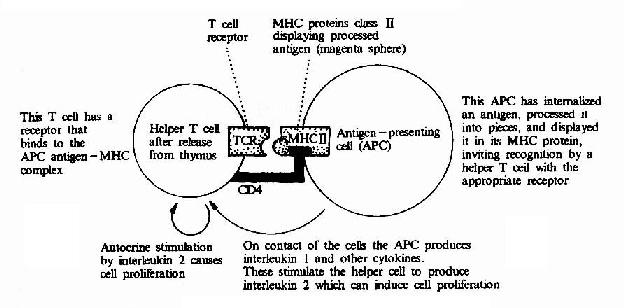
图21-4 膜表面分子接触通讯举例
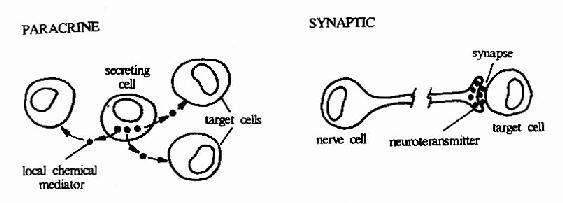
图21-5 化学信号的三种形式
(三)化学通讯
细胞可以分泌一些化学物质-蛋白质或小分子有机化合物至细胞外,这些化学物质作为化学信号(chemical signaling)作用于其它的细胞(靶细胞),调节其功能,这种通讯方式称为化学通讯。化学通讯是间接的细胞通讯,即细胞间的相互联系不再需要它们之间的直接接触,而是以化学信号为介质来介导的。根据化学信号分子可以作用的距离范围,将其分为三类(图21-5)。
1.内分泌(endocrine)系统?以激素为主,它们是由内分泌器官分泌的化学信号,并随血流作用于全身靶器官。
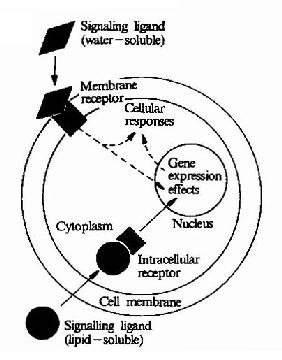
图21-6 水溶性和脂溶性化学信号的转导
2.旁分泌(paracrine)系统?以细胞因子为主,它们主要作用于局部的细胞,作用距离以毫米计算。
3.自分泌(autocrine)系统?神经介质为主,其作用局限于突触内,作用距离在100nm以内。
化学信号还可以根据其溶解性分为脂溶性化学信号和水溶性化学信号两大类。所有的化学号都必须通过与受体结合方可发挥作用,水溶性化学信号不能进入细胞,其受体位于细胞外表面。脂溶性化学信号可以通过膜脂双层结?构进入胞内,其受体位于胞浆或胞核内(图21-6)。下面分别介绍这两种受体转导生物信号的特点。
第二节 细胞内受体的信号转导机理
脂溶性化学信号(如类固醇激素、甲状腺素、前列腺素、维生素A及其衍生物和维生素D及其衍生物等)的受体位于细胞浆或细胞核内。激素进入细胞后,有些可与其胞核内的受体相结合形成激素-受体复合物,有些则先与其在胞浆内的受体结合,然后以激素-受体复合物的形式进入核内。
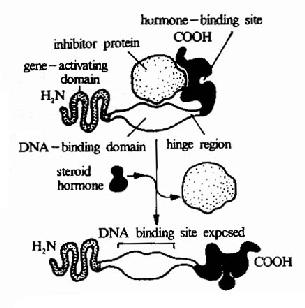
图21-7 类固醇激素及其受体的作用机理示意图
这些受体均属于转录因子,并具有锌指结构作为其DNA结合区(见第十九章)。在没有激素作用时,受体与热休克蛋白(Heat shock proteins, Hsps,见第一章)形成复合物,因此阻止了受体向细胞核的移动及其与DNA的结合。当激素与受体结合后,受体构象发生变化,导致热休克蛋白与其解聚,暴露出受体核内转移部位及DNA结合部位,从而激素受体复合物向内转移,并结合于DNA上特异基因邻近的激素反应元件(hormone response element, HRE)上(图21-7)。
不同的激素-受体复合物结合于不同的激素反应元件(表21-1)。结合于激素反应元件的激素-受体复合物再与位于启动子区域的基本录因子及其它的转录调节分子作用,从而开放或关闭其下游基因(见图17-6)。
表21-1 激素反应元件·(HRE)
| 激 素 |
DNA序列(双股) |
| 糖皮质激素 |
5′AGAACA×××TGTTCT3′ |
| 3′TCTTGT×××ACAAGA5′ |
| 雌激素 |
5′AGGTCA×××TGACCT3′ |
| 3′TCCAGT×××ACTGGA5′ |
| 甲状腺素 |
5′AGGTCATGACCT3′ |
| 3′TCCAGTACTGGA5′ |
* X代表任一核苷酸
第三节 膜受体介导的信号转导
与脂溶性的化学信号不同,亲水性信号分子(所有的肽类激素、神经递质和各种细胞因子等)均不能进入细胞。它们的受体位于细胞表面。这些受体与信号分子结合后,可以诱导细胞内发生一系列生物化学变化,从而使细胞的功能如生长、分化及细胞内化学物质的分布等发生改变,以适应微环境的变化和机体整体需要。这一过程可以称之为跨膜信号转导。在这一信号转导过程中,信号分子不进入细胞。虽然有些信号分子与受体结合后可以发生内化(internalization),但这不是主要的作用方式。这种位于膜表面的受体所介导的信号传递主要表现为,各种参与信号传递的信号分子的构象、浓度或分布发生变化,各种信号分子之间发生相互识别和相互作用。
一、膜受体的分类
随着越来越多的膜表面受体被纯化,其结构及转导信号的方式逐步得以阐明。目前,按照受体的结构及其作用方式可将其分为三大类。这三大类受体在配体种类、受体的一般结构和功能及细胞对之发生反应的方式上有所不同,见表21-2。
Table 21-2 Classification of MembraneReceptors:Characteristics of Three Groups of Receptors
| Characteristics |
Ion Channel Receptors |
G-Protein-Linked receptors |
Recetpors with a Single Transmembrane Domain |
| Endogenous ligands |
Neurotransmitter |
Neurotransmitter |
Growth factor hormone |
|
|
Hormone |
Cytokine |
|
|
Auloacoid |
|
|
|
Chemotactic factor |
|
|
|
Exogenous stimulant |
|
| Structure |
Oligomer with a pore |
Probably monomer |
Monomer of oligoner |
|
|
|
with (±)catalytic |
|
|
|
domain |
| Number of transmem |
Four per subunit |
Seven |
One per subunit |
| bane segments |
|
|
|
| Function |
Ion channel |
Activation of G proteins |
Tyrosine kinase |
|
|
|
Giuanylate cyclase(?) |
| Cellular responses |
Depolarization or |
Depolarization or |
Regulation of function |
|
hyperpolarization |
hyperpolarization |
and expression of |
|
|
Regulation of function |
proteins |
|
|
and expression of |
Proliferation or |
|
|
proteins |
differentiation |
二、膜受体信号转导的分子机理
(一)离子通道型受体及其信号转导
离子通道型受体是一类自身为离子通道的受体。这种离子通道与受电位控制的离子通道及受化学修饰调控的离子通道不同,它们的开放或关闭直接受配体的控制,其配体主要为神经递质。
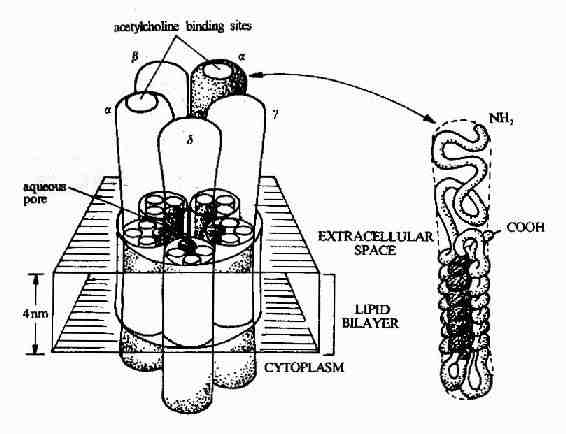
图21-8 乙酰胆碱受体的结构模式图
图21-8显示了作为离子通道受体的典型代表-乙酰胆碱受体的结构模式。乙酰胆碱受体是由5个同源性很高的亚基构成,包括2个α亚基,1个β亚基,1个γ亚基的和1个δ亚基。每一个亚基都是一个四次跨膜蛋白,分子量约60kd,约由500个氨基酸残基构成。推测跨膜部分为四条α螺旋结构,其中一条α螺旋含较多的极性氨基酸,就是由于这个亲水区的存在,使五个亚基共同在膜中形成一个亲水性的通道。乙酰胆碱的结合部位位于α亚基上。?
乙酰胆碱受体可以以三种构象存在(图21-9)。两分子乙酰胆碱的结合可以使之处于通道开放构象,但即使有乙酰胆碱的结合,该受体处于通道开放构象状态的时限仍十分短暂,在几十毫微秒内又回到关闭状态。然后乙酰胆碱与之解离,受体则恢复到初始状态,做好重新接受配体的准备。
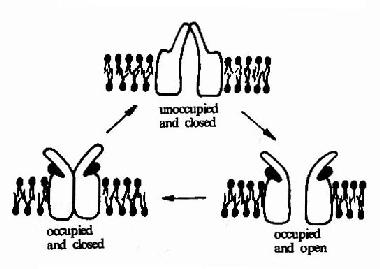
图21-9 乙酰胆碱受体的三种构象示意图
离子通道受体信号转导的最终作用是导致了细胞膜电位的改变,可以认为,离子通道受体是通过将化学信号转变成为电信号而影响细胞的功能的。
离子通道型受体可以是阳离子通道,如乙酰胆碱、谷氨酸和五羟色胺的受体,也可以是阴离子通道,如甘氨酸和γ-氨基丁酸的受体。
(二)G蛋白偶联型受体及其信号转导
G蛋白偶联型受体包括多种神经递质、肽类激素和趋化因子的受体,在味觉、视觉和嗅觉中接受外源理化因素的受体亦属G蛋白偶联型受体。这类受体在结构上均为单体蛋白,氨基末端位于细胞外表面,羧基末端在胞膜内侧。完整的肽链要反复跨膜七次(图21-10),因此亦有人将此类受体称为七次跨膜受体。由于肽链反复跨膜,在膜外侧和膜内侧形成了几个环状结构,它们分别负责与配体(化学、物理信号)的结合和细胞内的信号传递。其胞浆部分可以与一种GTP结合蛋白(简称G蛋白)相互作用,这种G蛋白是该信号传递途径中的第一个信号传递分子,这也是这类受体被称为G蛋白偶联型受体的原因。
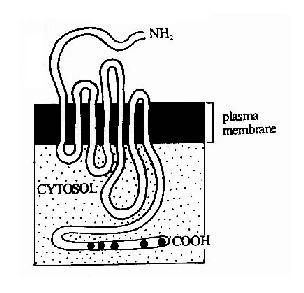
图21-10 七次跨膜受体-G蛋白偶联型受体跨膜结构示意图
G蛋白偶联受体的信号传递过程包括(1)配体与受体结合,(2)受体活化G蛋白;(3)G蛋白激活或抑制细胞中的效应分子;(4)效应分子改变细胞内信使的含量与分布,(5)细胞内信使作用于相应的靶分子,从而改变细胞的代谢过程及基因表达等功能。本节将逐一介绍这一过程的主要环节。
1.G蛋白的循环或活化(G Protein Cycle)
G蛋白偶联型受体的信号转导途径中的第一个信号传递分子是G蛋白,其活化过程称为G蛋白循环。
G蛋白以α、βγ亚基三聚体的形式存在于细胞质膜内侧。α亚基已发现有20余种,分子量为36~52kd。α亚基具有多个活化位点,其中包括可与受体结合并受其活化调节的部位、与βγ亚基相结合的部位、GDP或GTP结合部位以及与下游效应分子相互作用的部位等等。α亚基还具有GTP酶活性。α亚基结合GDP时是无活性状态,而与GTP结合时则为有活性状态,GTP的水解又使其返回无活性状态。
G蛋白中的β和γ亚基亦有数种,但不及α亚基种类多。在细胞内,β和γ亚基形成紧密结合的二聚体,只有在蛋白变性条件下方可解离,因此可以认为它们是功能上的单体。βγ亚基的主要作用是与α亚基形成复合体并定位于质膜内侧。近年来的研究表明,βγ亚基亦可作用于其下游效应分子。
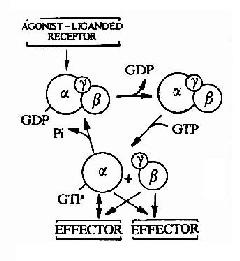
图21-11 G蛋白循环示意图
G蛋白循环的具体过程可见图21-11。当物理或化学信号刺激受体时,受体活化G蛋白使之发生构象改变。α亚基与GDP的亲和力下降,结合的GDP为GTP所取代。α亚基结合了GTP后即与βγ亚基发生解离,成为活化状态的α亚基。活化了的α亚基此时可以作用于下游的各种效应分子。这种活化状态将一直持续到GTP被α亚基自身具有的GTP酶水解为GDP。一旦发生GTP的水解,α亚基又再次与βγ亚基形成复合体,回到静止状态,重新接受新的化学信号。
由于G蛋白的种类不同,因此G蛋白可以作用于不同的效应分子,或对同一效应分子进行不同的调节。
2.效应分子及细胞内信使
G蛋白活化之后,可作用于腺苷酸环化酶和磷脂酶C等效应分子(Effector)上。有的α亚基(Gs)可以激活腺苷酸环化酶;有的α亚基(αi)可以抑制腺苷酸环化酶。腺苷酸环化酶催化ATP生成环状AMP(cAMP)的反应,因此细胞内的cAMP水平在配体与受体结合后,可受G蛋白α亚单位的作用而升高或降低,从而将细胞外信号转变为细胞内信号。这种细胞内信号可再作用于下游分子。这种细胞内信号的传递方式是G蛋白偶联型受体传递信号的主要方式,这些细胞内信号分子被称为细胞内信使。细胞内信使亦被称为第二信使。已知的细胞内信使包括cAMP、cGMP、甘油二酯(DAG)、IP3、和Ca2+等等(图21-12、13、14)。G蛋白的α亚基种类、其作用的效应分子及所调节的细胞内信使可参见表21-3。
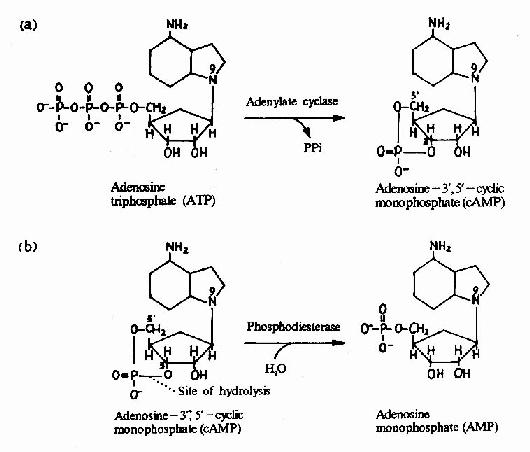
图21-12 cAMP的生成与水解
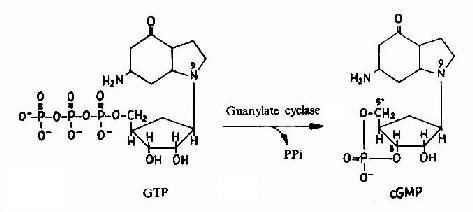
图21-13 cGMP的生成
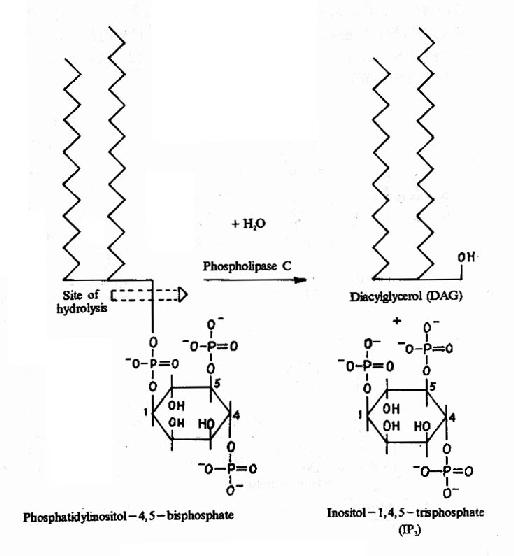
图21-14 DAG和IP3的生成
细胞内信使一般具有以下三个特点:(1)多为小分子,且不位于能量代谢途径的中心;(2)在细胞中的浓度或分布可以迅速地改变;(3)作为变构效应剂可作用于相应的靶分子,已知的靶分子主要为各种蛋白激酶。
表21-3 G蛋白的α亚基及其效应分子
| Ca种类 |
效应分子 |
细胞内信使 |
靶分子 |
| as |
腺苷酸环化酶活性急↑ |
cAMP↑ |
蛋白激酶A活性↑ |
| ai |
腺苷酸环化酶活性↓ |
cAMP↓ |
蛋白激酶A活性↓ |
| aq |
磷脂酶C活性↑ |
Ca2+IP↑3DAG |
蛋白激酶C活化↑ |
| at |
cGMP磷脂二酯酶↑活性 |
cGMP↓ |
Na+通道关闭 |
cAMP是第一个被发现的细胞内信使,催化它生成的腺苷酸环化酶为一重要的Gαi和Gαs的效应分子。cAMP是很多激素的细胞内信使。另一类重要的细胞内信使是在磷脂酰肌醇特异性磷脂酶C作用下,由PIP2(二磷酸磷脂酰肌醇)水解生成的三磷酸肌醇(IP3)和甘油二酯(DAG)。
需要指出的是,除G蛋白偶联型受体在其信号转导过程中需细胞内信使作为信号的传递者外,细胞内还存在受其它的信号转导方式调控的细胞内信使。九十年代以来,越来越多的以小分子物质作为细胞内信使参与细胞功能调控的过程得以阐明。
G蛋白偶联型受体在G蛋白介导下的信号传递过程可见图21-15和图21-16。
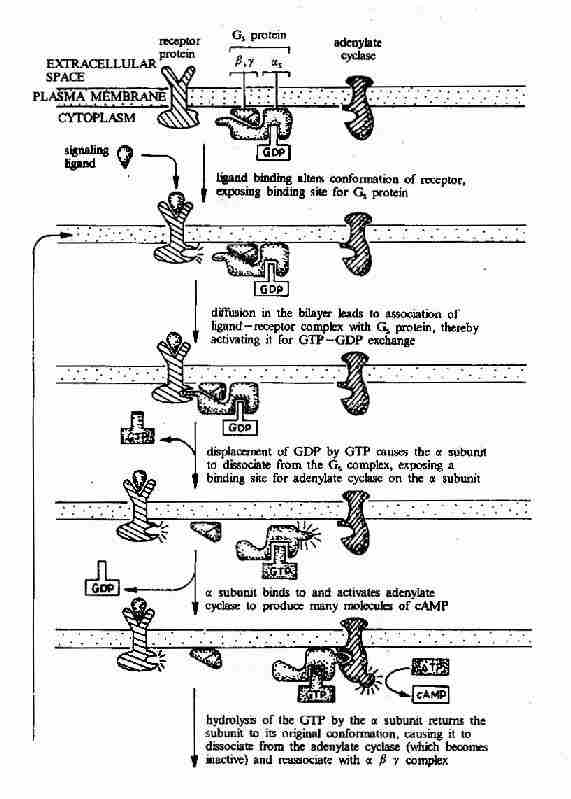
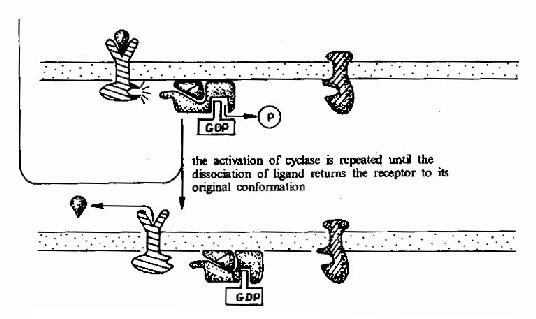
图21-15 G蛋白偶联型受体-G蛋白-腺苷酸环化酶信号转导途径示意图
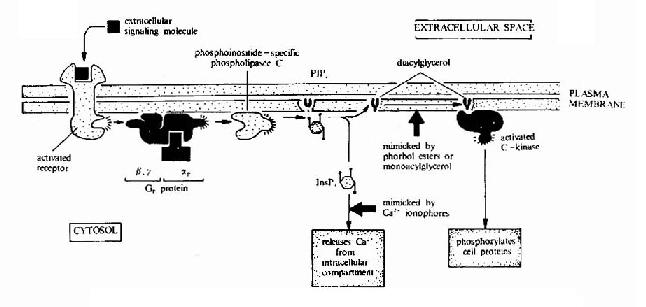
图21-16 G蛋白偶联型受体-G蛋白-磷脂酶C信号转导途径示意图
3.细胞内信使作用的主要靶分子
活化的Gα可作用于相应的效应分子,从而使相应的细胞内信使浓度发生迅速的改变。这些细胞内的信使可分别作用于相应的靶分子,从而使得细胞中的各种酶类和蛋白分子的活性发生改变。这些细胞内信使所作用的靶分子主要为各种蛋白激酶(表21-3)
(1)蛋白激酶A
cAMP作用于cAMP依赖性蛋白激酶(cAMP-dependent Protein Kinase,简称为cAPK),亦称为蛋白激酶A(Protein Kinase A, PKA),目前后一种命名较为公认。cAMP可以作为该激酶的变构激活剂,使无活性的蛋白激酶A转变为有活性的蛋白激酶A(详见第十一章,图11-4)。活化了的蛋白激酶A可作用于多种与糖脂代谢相关的酶类、一些离子通道和某些转导因子,使它们发生磷酸化并改变其活性状态。
(2)蛋白激酶G
细胞内的另一种环核苷酸信使为环鸟苷酸-cGMP。cGMP作用于cGMP依赖性蛋白激酶-cGMP?dependent Protein Kinase, cGPK),亦称为蛋白激酶G(Protein Kinase G、PKG)。与PKA一样,PKG是目前较为公认的命名。蛋白激酶G以cGMP作为变构效应剂,在脑和平滑肌中含量较丰富。1997年,人们发现,PKG的基因突变与果蝇的觅食行为有关。我们可以推测,PKG很有可能在神经系统的信号传递过程中具有重要作用。
(3)蛋白激酶C
另外一些重要的细胞内信使还包括磷脂酰肌醇的衍生物如DAG、PIP3(三磷酸磷脂酰肌醇)、磷脂酰胆碱的衍生物、鞘磷脂的衍生物以及Ca2+等等。这些小分子信使的一个重要靶分子是蛋白激酶C(Protein KinaseC、PKC)。
PKC有多种同工酶形式,均以希腊字母排列,有PKCα、PKCβI、PKCβⅡ和PKCγ等等。不同的同功酶在结构和组织分布上各有不同,其对辅助因子(包括上述细胞内小分子信使)的需求亦有差别,并且对底物有选择性。
PKC在细胞的生长分化的调控中及其它多种细胞功能上具有关键性的调节作用,是一类非常重要的信号转导分子。细胞信号转导过程中的多条途径都可以导致PKC的活化。已经有很多实验研究证明,PKC的抑制剂可以使细胞失去对生长分化刺激信号的反应,表明这些功能都依赖于PKC的调控。例如,肥大细胞的脱颗粒反应(释放出大量组织胺等血管活性物质)是机体变态反应的重要形式之一。体外实验表明,如果用PKC抑制剂预先处理细胞,细胞就不会对刺激信号再发生脱颗粒反应。如果用改变细胞膜通透性的方式使胞内的PKC漏出,细胞也会失去发生脱颗粒反应的能力,此时若再加入PKC使之回到细胞中,则又可恢复细胞的脱颗粒反应。其它很多类似的实验亦表明,细胞的很多其它功能也受到PKC的调控。
(三)单次跨膜受体及其信号转导
多种生长因子和细胞因子的受体为一类结构上为单次跨膜的糖蛋白。与七次跨膜受体(G蛋白偶联型受体)相对应,将其称为单次跨膜受体,即它们的跨膜区仅为单向一次性的,而不像七次跨膜受体那样有反复的跨膜区段。
单次跨膜受体依照其结构特点可进一步分成多个家族和亚家族,其分类见表21-4及图21-7。
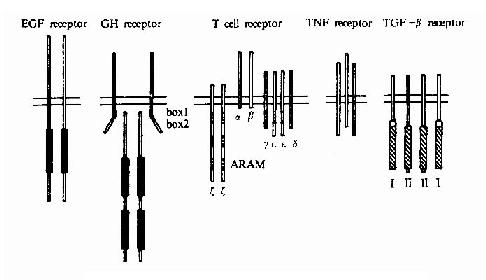
图21-17 各类单次跨膜受体的代表性举例
Table21-4Families of ReceptorsActivated by Dimerization or Oligomerization
| Receptor Type |
Family |
Examples |
Characteristics |
|
PDGF receptor |
PDGFR-α,PDGFR-βSCFR |
Five immunoglobulin-like |
| family |
(Kit),CSF-R(Fms),Flk-2 |
domains extracellularly |
|
| EGF receptor family |
EGFR(ErbB),ErbB2(Neu),ErbB3,ErbB4 |
Two cysteine-rich |
|
| IGF receptor family |
insulin R,IGF-1R |
domains extracllularly |
|
| HGF receptor family |
HGFR(Met),MSPR(Ron) |
Disulphide-bound heteroteramer of a and βchain |
|
| VEGF receptor family |
Flt-1,Flk-1(KDR) |
Seven immunolobulin-like domains extracellularly |
|
| Neurotrophin receptor family |
Trk,TrkB,TrkC |
|
|
| Eph receptor family |
Eph ,E1k,Eck,Cck5,Sek,Erk |
Two FNIII-like domains and a cysteinerichdomain extracellularly |
|
|
Class 1 cytokine receptor family |
|
|
| CH receptor subfamily |
GHR,EPOR,PRLR,G-CSFR |
Form homodimers |
|
| IL-3 receptor subfamily |
IL-3R,GM-CSFR,IL-5R |
Form complexes with the cβ subunit |
|
| IL-6 receptor subfamily |
IL-6R,LIFR,CNTFR,IL-11R |
Form complexs with gp 130 |
|
| IL-2receptor subfamily |
IL-2R,IL-2Rβ,IL-4R,IL-7R |
Form complexes with il-2Rγ |
|
|
IFN-α/βR,IFN-γRα,IFN-γRβIL-10R |
|
|
| TNF receptor family |
|
TNFR-1,TNFR-11MLNGFR,CD40,OX-40,Fas,CD27,CD30 |
Form trimers |
|
|
TCR |
Complex of α,β,γ,δ,ε,ζandηsubunits |
|
BCR |
Complex of IgM and heterodimers ofα/βsubunits |
|
| Serine/threonine kinase receptor family |
Type Ⅱ receptor family |
TGFβR-Ⅱ,ActR-Ⅱ,ActR-ⅡB |
Form hetero-oligomers with type Ireceptors,i, e,TGFβ-I,ActR-1,ActR-1B,BMPR-1A,BMPR-1B,ALK-1 |
Receptorfamilies and subfamilies discussed in the text are presented .Abbreviationsused: R, receptor; R, receptor; PDGF,platelet-derived growth factor; SCF, stemcell factor; CSF, colony-stimulationg factor; EGF,epidermal growth factor; FGF,fibroblast growth factor; IGF, insulin-like growth factor;HGF, hepatocytegrowth factor;MSP,macrophage-stimulating protein;VEGF,vascular endothelialgrowth factor;FN,fibronectin;GH,growthhormone;EPO,erythropoietin;PRL,prolactin;IL,interleukin;LIF,leukemia inhibitoryfactor;CNTR,ciliary neurotrophic factore;IFN,interferon;TNF,tumor necrosisfactor;Lngfr,low affinity nerve growth factor rcecptor;TCR,T ,cellrcecptor;BCR,B cell rcecptor;receptor;TGFR,transfoming growth factorβAct,activin;BMP,bone morphogenic protein,Alternative desingations are givenwithin parentheses.
单次跨膜受体所介导的信号传递与转换过程与G蛋白偶联型受体介导的信号转导有着很大差别。我们已经知道,G蛋白偶联型受体所介导的主要是经由G蛋白的激活,然后作用于相应的效应分子,接下来最主要的是导致细胞内信使含量及分布的迅速改变从而调节靶分子的活性并改变细胞的功能状态。单次跨膜受体介导的信号转导过程则主要是蛋白分子的相互作用,并且有蛋白酪氨酸激酶的广泛参与。对这些信号转导途径的了解在九十年代中取得了许多重要的进展。为跟踪和理解这些信号转导过程,我们首先需要知道参与这一过程的重要信号转导分子和其中的一些特殊结构。
1.几类重要的介导单次跨膜受体信号转导的蛋白分子的结构及功能
(1)蛋白激酶
蛋白激酶是指能够将γ-磷酸基因从磷酸供体分子上转移至底物蛋白的氨基酸受体上的一大类酶。磷酸供体可以是ATP,也可以是其它类三磷酸核苷酸。由于蛋白激酶常常是多底物的,因此蛋白激酶是根据底物中氨基酸残基的特异性而不是根据底物蛋白的特异性来分类的。国际生化学会命名委员会建议将蛋白激酶分为五大类:
| 激 酶 |
磷酸基团的受体 |
| 蛋白丝氨酸/苏氨酸激酶 |
丝氨酸/苏氨酸羟基 |
| 蛋白酪氨酸激酶 |
酪氨酸的酚羟基 |
| 蛋白组/赖/精氨酸激酶 |
咪唑环,胍基,ε-氨基 |
| 蛋白半胱氨酸激酶 |
巯基 |
| 蛋白天冬氨酸/谷氨酸激酶 |
酰基 |
前两类激酶目前了解的较多,很多已经获得了cDNA克隆,但对后两者的了解仍很有限。
蛋白丝/苏氨酸激酶和蛋白酪氨酸激酶的分类见表21-5。
表21-5 蛋白激酶分类
| 1.蛋白丝氨酸/苏氨酸激酶 |
| (1) Cyclic nucleotide regulated |
| A. PKA α cAMP?dependent protein kinase catalytic,α form |
| B. PKA βcAMP?dependent protein kinase catalytic, β form |
| C. PKA γcAMP?dependent protein kinase catalytic,γ form |
| D. cGPK?α cGMP?dependent protein kinase α form |
| E. cGPK?β cGMP?dependent protein kinase β form |
| (2) Diacylglycerol regulated:[BH] |
| PKC α protein kinase C α |
| PKC β protein kinase C β |
| PKC γ protein kinase C γ |
| PKC δ protein kinase C δ |
| PKC ε protein kinase C ε |
| PKC ζ protein kinase C ζ |
| PKC η protein kinase C η |
| (3)Calcium/calmodulin regulated[BH] |
| CaMⅠ Calcium/calmodulin?dependent protein kinase Ⅰ |
| CaMⅡα Calcium/calmodulin?dependent protein kinase Ⅱα |
| CaMⅡβ Calcium/calmodulin?dependent protein kinase Ⅱβ |
| CaMⅡγ Calcium/calmodulin?dependent protein kinase Ⅱγ |
| CaMⅢCalcium/calmodulin?dependent protein kinase Ⅲ |
| CaMⅣCalcium/calmodulin?dependent protein kinase Ⅳ |
| PSKHI Putative protein?serine kinase |
| (4) Ribosomal S6 protein kinase |
| S6kⅠ,S6KⅡ,70kDaS6 |
| (5) Serpentine receptor kinase |
| ① β ARK β?Adrenergic receptor protein kinase |
| ② β ARK?related protein kinase |
| ③ Rhodopsin kinase |
| (6) Casein kinase Ⅱ |
| (7) Glycogen synthase kinase 3 |
| (8) cdc 2 family |
| (9) cdc 2 related protein kinase |
| (10)MAP kinase (mitogen activated protein kinases) |
| EPK-1, ERK-2, ERK-3, ERK-5(extracellular signal-regulated kinase) |
| JNK(c-Jun N-terminal kinase), P38, etc. |
| (11)MOS/Raf protein kinase |
| 2.蛋白酪氨酸激酶 |
| (1) Growth factor receptors |
| EGFR: EGFR.erbB2,erbB3 |
| INSR:INSR, IGF?1R |
| FGFR:FGFR, FGFR2, c?kit |
| DGFR:PDGFR, CSFIR |
| (2) Non?receptor tyrosine kinase |
| src family: src,Yes,Lyn,Fyn,Lck,etc |
| Syk family:Syk, ZAP70 |
| JAK family: JAK1,JAK2, JAK3 |
| Tec family: Btk,Itk,etc |
表中列出的多种蛋白激酶都属于重要的信号转导分子,在此不可能一一介绍。在这些蛋白激酶中,对于细胞功能影响较大的有PKA、PKG、PKC、MAPK和PTK等。PKA、PKG和PKC已在G蛋白偶联受体中提及,因此这里仅介绍MAPK和PTK。
①MAP激酶(Mitogen Activated Protein Kinase, MAPK)
MAPK属于蛋白丝/苏氨酸激酶,是接受膜受体转换与传递的信号并将其带入细胞核内的一类重要分子,在多种受体信号传递途径中均具有关键性作用。在未受刺激的细胞内,MAPK为静止型,当其接收上游分子棗MAPKK(MAp Kinase Kinase)的磷酸化调控信号后,MAPK中相邻的苏氨酸和酪氨酸均被磷酸化,从而成为活化形式的MAPK(图21-18)。目前在MAPK的上游存在着一个
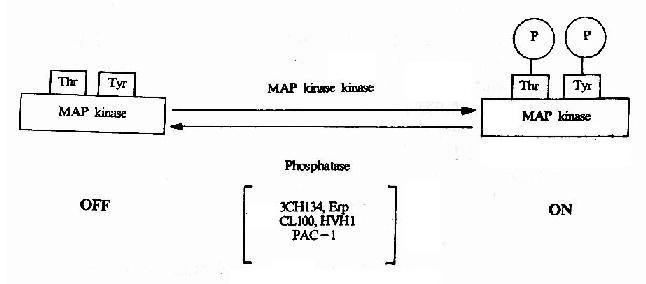
图21-18 MAPK的活化
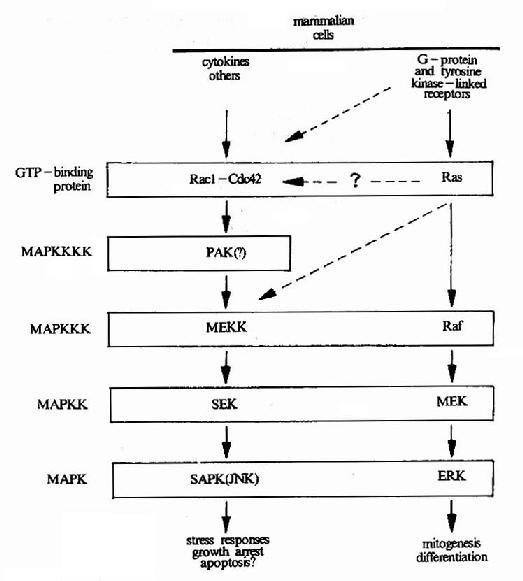
图21-19 MAPK的逐级激活
由蛋白激酶构成的MAPK逐级激活系统。上述使MAPK磷酸化的MAPKK又受到MAPKKK(MApKinase Kinase Kinase)的调节。这种逐级激活系统又再受其上游分子的调控(图21-19)。
MAPK被激活以后,转移至细胞核内。在核内,它可以使一些转录因子发生磷酸化从而改变胞内基因表达的状态。另外,它也可以使一些其它的酶发生磷酸化使之活性发生改变。目前已经知道,MAPK参与多种细胞功能的调控,尤其是在细胞增殖、分化及凋亡过程中,它具有关键性作用。
MAPK途径在果蝇中已发现了7种不种类型,在哺乳动物细胞中已证实至少有三种MAPK成员,即ERK、JNK和P38。它们的调控机制和作用的靶分子均有所差异。
②蛋白酪氨酸激酶(Protein Tyrosine Kinase, PTK)
蛋白酪氨酸激酶作用于蛋白质中的酪氨酸残基使之磷酸化,很多细胞信号转导的最早期事即为多种蛋白质的酪氨酸磷酸化。在细胞的生长与分化过程中,酪氨酸磷酸化大部分具有正向调节作用,无论是生长因子作用后正常细胞的增殖、恶性肿瘤细胞的增殖,还是T细胞、B细胞或肥大细胞的活化都伴随着瞬间发生的多种蛋白分子的酪氨酸磷酸化。蛋白酪氨酸激酶的抑制剂可以阻断上述细胞的应答反应。
根据蛋白酪氨酸激酶在细胞内的位置可以将其分为三类:
A.蛋白酪氨酸激酶受体
这一类蛋白酪氨酸激酶为跨膜蛋白,其胞外部分为配体结合区,中间有跨膜区,胞内部分含有蛋白酪氨酸激酶的催化结构域(图21-17)。
蛋白酪氨酸激酶受体与配体结合后往往形成二聚体,继而发生酶活性的增高,使受体胞内部分的酪氨酸磷酸化增强,磷酸化的受体酶活性进一步增强。此外更重要的是,磷酸化的受体可以慕集含有SH2结构域(见后)的信号分子,从而将信号传递至下游分子。
B.位于胞浆部分的蛋白酪氨酸激酶
胞浆内亦含有多种PTKs,这些蛋白激酶或接受受体传递的激活信号,或受其它蛋白质的调节而发生活性改变,其主要作用是作为受体和最终效应分子之间的中间介导分子。已知的主要种类有:
(1)src家族:src、Fyn、Lck、Lyn等,与受体结合存在,当配体与受体结合后被激活;
(2)Tec家族:Btk、Itk、Tec等,与受体结合或不结合存在,配体结合后被激活;
(3)ZAP70家族:ZAP70和Syk,与磷酸化的受体结合后被激活;
(4)JAK家族:JAK1、JAK2、JAK3等。
这些PTKs或者直接与受体形成复合物,或者间接地依次被激活,在传递受体信号过程中起着接力棒的作用。它们的结构见图21-20。
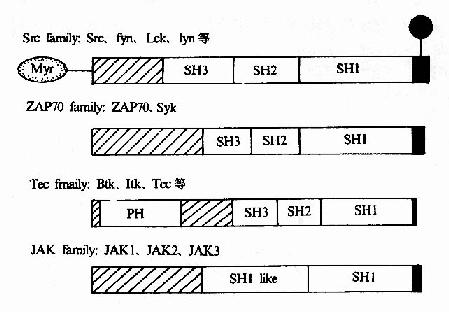
图21-20 胞浆PTK的结构
C.核内蛋白酪氨酸激酶
大部分的酪氨酸蛋白激酶位于胞膜上或胞浆内,近年来却发现核内也存在着酪氨酸蛋白激酶,这对于信号在核内的传递有重要意义。重要的核内PTKs有Abl和Wee。Abl既存在于胞核内,也存在于胞浆中,已发现它参与转录过程和细胞周期的调节;Wee只存在于核内,它可调节Cyclin-2的活性,抑制其磷酸化,对细胞进入有丝分裂期具有调节作用。
(2)蛋白磷酸酶(Protein Phosphotase)
蛋白磷酸(酯)酶是指具有催化已经磷酸化的蛋白分子发生去磷酸化反应的一类酶分子。它们与蛋白激酶相对应存在,共同构成了磷酸化与去磷酸化这一重要的蛋白质活性的开关系统。正如蛋白激酶催化的磷酸化由于底物不同,有的表现为活性增高,有的表现为活性降低一样,蛋白磷酸酶所催化的去磷酸化反应也对于不同的底物有不同的反应(图21-21)。
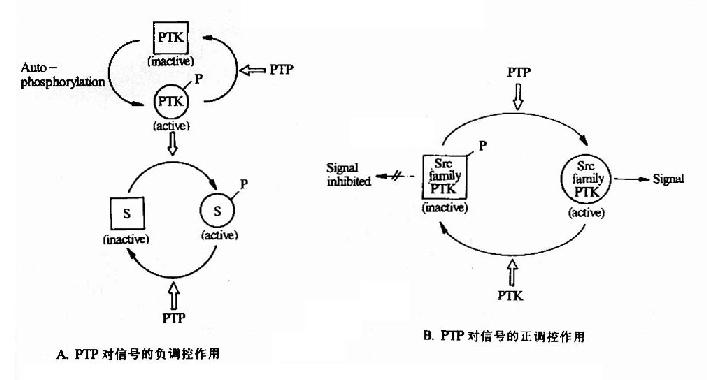
图21-21 蛋白酪氨酸磷酸酶对蛋白酪氨酸激酶的调控作用
PTK:Protein Tyrosine Kinase PTP:Protein Tyrosine Phosphotase S:Substrate
蛋白磷酸酶的分类也与蛋白激酶类似,是根据它所作用的氨基酸残基决定的。目前已知的蛋白磷酸酶包括蛋白丝氨酸/苏氨酸磷酸酶和蛋白酪氨酸磷酸酶两大类,另外还有个别的蛋白磷酸酶具有双重作用,即可同时作用于酪氨酸和丝氨酸残基。
蛋白激酶和蛋白磷酸酶均作用于有限的底物,它们的催化作用的特异性及其在细胞内的分布特异性决定了信号转导途径的精确性。
(3)低分子量G蛋白(Small G Protein)
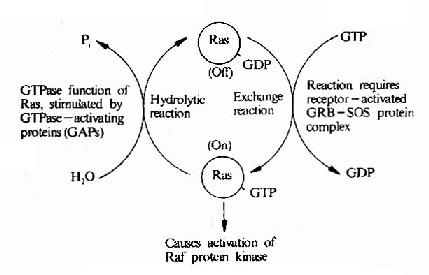
图21-22 Ras的活化及其调控因子
低分子量GTP结合蛋白在多种细胞反应中具有开关作用,它们位于MAPK系统的上游,是一类重要的信号转导分子。第一个被发现的低分子量G蛋白是Ras,因此这一类蛋白质被称为Ras超家族成员。由于它们均由一个GTP酶结构域构成,亦将之称为Ras样GTP酶。
低分子量G蛋白的共同特点是,当结合了GTP时即成为活化形式,这时可作用于下游分子使之活化,而当GTP水解成为GDP时(自身为GTP酶)则回复到非活化状态。这一点与Gα类似,但是Ras家族的分子量明显低于Gα。
在细胞中存在着一些专门控制低分子量G蛋白活性的低分子量G蛋白调节因子,这些调节因子受膜受体信号的影响,调节低分子量G蛋白活性,低分子量G蛋白再作用于MAPK系统。在这些调节因子中,有的可以增强低分子量G蛋白的活性,如鸟嘌呤核苷酸交换因子(GEF)和鸟嘌呤核苷酸解离抑制因子(GDI),有的可以降低低分子量G蛋白活性,如GTP酶活化蛋白(GAP)等(图21-22)。
目前已知的Ras超家族成员已超过50种,它们又可以分为数个亚家族,在细胞内分别控制不同的信号转导途径,每一个成员都有其各自的特点。
(4)介导信号转导分子相互作用的结构元件
细胞中存在着众多的信号转导分子,它们是如何相互识别、相互作用而构成不同的细胞转导途径的呢?90年代以来,人们逐步发现了在信号转导分子中存在着一些特殊的结构域。这些结构域大约由50~100个氨基酸构成,它们在不同的信号转导分子中具有很高的同源性。这些结构域的作用是在细胞中介导信号转导分子的相互识别,共同形成不同的信号传递链或称为信号转导途径(Signal Transduction Pathway),并进而形成信号转导的网络(SignalTransduction Network)。换句话讲,这些结构域像电路中的接头元件一样把不同的信号分子连接起来。这些结构域被称为调控结合元件(Modular Binding Domain)。目前已经知道了近十种这样的结构域,例如:
SH2 domain (src Homology 2domain)
SH3 domain(src Homology 3 domain)
PH domain (Pleckstrin Homology domain)
PTB domain(Protein TyrosineBinding domain)
A.SH2结构域:由约100个氨基酸组成,介导信号分子与含磷酸酪氨酸蛋白分子的结合。这种结合依赖于酪氨酸残基的磷酸化及其周围的氨基酸残基所构成的基序(motif)。
例:YEEI与src family的SH2结合
YMXM与growth factor receptor、P13Kp85的SH2结合
YVIP与PLCγ的SH2结合
YXNX与Grb2的SH2结合
B.SH3结构域:由50~100个氨基酸组成,介导信号分子与富含脯氨酸的蛋白分子的结合,其亲和力亦与脯氨酸残基及邻近氨基酸残基所构成的基序序列相关。
例:RKLPPRPSK与P13K的亲和力为9.1μM
PALPPLPRY与P13K的亲和力为17μM
C.PH结构域:由100~120个氨基酸组成,其功能尚未完全确定。目前已知它可以与磷脂类分子PIP2、PIP3、IP3等结合。同时也发现,一些蛋白分子,如PKC和G蛋白的βγ亚单位也可以与PH结构域结合。
D.PTB结构域:由约160个氨基酸组成,与SH2一样,PTB结构域也可以识别一些含磷酸酪氨酸的基序,但其结合基序与SH2结构域有所差别。
作为调控结合元件,它们在结构和功能上有如下特点:
①一个信号分子可以含有两种以上的调控结合元件(图21-23),因此可以同时与两种以上的其它信号分子相结合,例如,在蛋白酪氨酸激酶Btk中即有PH结构域、SH3结构域和SH2结构域等3个调控结合元件。
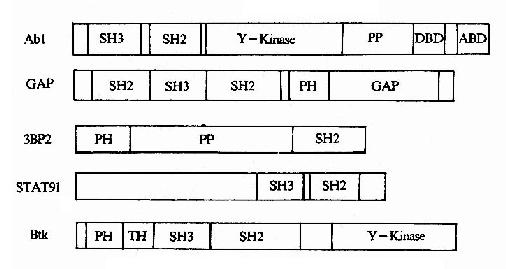
图21-23 信号转导分子中的调控结合元件
Y-Kinase:tyrosine kinaseDBD:DNA binding domain PP:Pro?rich
ABD:actin?binding domainGAP: GTPase activating domain
②同一类调控结合元件可存在于多种不同的信号转导分子中,例如,PH结构域存在于某些蛋白激酶、低分子量G蛋白调节分子及细胞骨架蛋白等多种信号转导分子中。这些调控结合元件的一级结构仍然是不同的,因此对所结合的信号分子具有选择性,这是保证信号分子相互作用具有特异性的基础。
③这些结构域本身均为非催化结构域。
2.两条典型的信号转导途径
(1)表皮生长因子受体介导的信号转导途径
表皮生长因子与其受体-表皮生长因子受体结合后可引发一系列细胞内变化,最终使细胞发生分化或增殖。表皮生长因子受体是一种受体酪氨酸蛋白激酶,而受体酪氨酸蛋白激酶→Ras→MAPK级联途径是表皮生长因子刺激信号传递到细胞核内的最主要途径。它由以下成员组成:表皮生长因子受体→含有SH2结构域的接头蛋白(如Grb2)→鸟嘌呤核苷酸释放因子(如SOS)→Ras蛋白→MAPKKK(如Raf1)→MAPKK→MAPK→转录因子等(图21-24)。
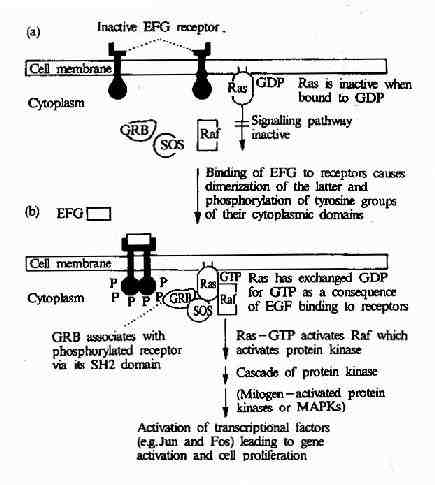
图21-24 EGF受体介导的信号转导过程
表皮生长因子与受体结合后,可以使受体发生二聚体化,从而改变了受体的构象,使其中的蛋白酪氨酸激酶活性增强,受体自身的酪氨酸残基发生磷酸化,磷酸化的受体便形成了与含SH2结构域的蛋白分子Grb2结合的位点,导致Grb2与受体的结合。Grb2中有两个SH3结构域,该部位与一种称为SOS的鸟苷酸交换因子结合,使之活性改变,SOS则进一步活化Ras,激活的Ras作用于MAPK激活系统,导致ERK的激活。最后ERK转移到细胞核内,导致某些转录因子的活性改变从而改变基因的表达状态及细胞的增殖与分化过程。
(2)γ-干扰素受体介导的信号转导
γ-干扰素是由活化T细胞产生的,它具有促进抗原提呈和特异性免疫识别的作用,并可促进B细胞分泌抗体。γ-干扰素与受体结合以后,也可以导致受体二聚体化,二聚体化的受体可以激活JAK-STAT系统,后者将干扰素刺激信号传入核内。JAK(Janus Kinase)为一种存在于胞浆中的蛋白酪氨酸激酶,它活化后可使干扰素受体磷酸化。STAT(Signal Transducerand Activator of Transcription)可以通过其SH2结构域识别磷酸化的受体并与之结合。然后STAT分子亦发生酪氨酸的磷酸化,酪氨酸磷酸化的STAT进入胞核形成有活性的转录因子,影响基因的表达(图21-25)。
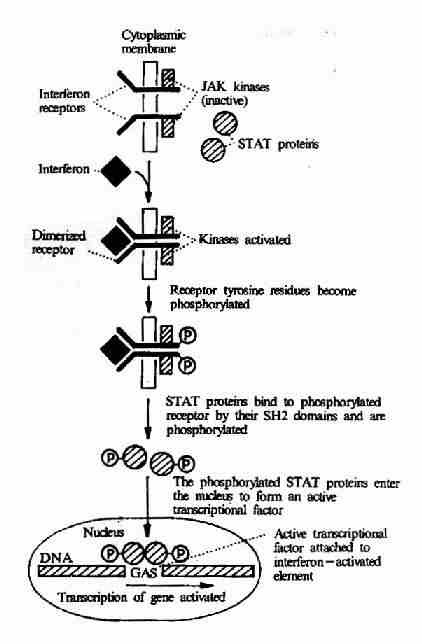
图21-25 γ-干扰素受体介导的信号转导过程
JAK:Janus kinase
STAT: Signal Transducer andActivator of Transcription
GAS: γ?interferon?activated sequenceelement
上述两条信号转导途径仅仅是多种信号转导途径的代表,尽管90年代以来科学家们在细胞信号转导的分子机理研究方面已经取得了一些成就,但距离阐明细胞中存在的全部传递网络系统还十分遥远,有待科学家们不断努力,在下个世纪实现人类认识自我的愿望。