女性生殖系统包括卵巢、输卵管、子宫、阴道和外生殖器。乳腺也列入本章叙述。卵巢产生卵细胞和分泌性激素;输卵管输送卵细胞,也是卵受精的场所;子宫是孕育胎儿的器官。女性生殖器官有明显的年龄变化,10岁以前生殖器官生长迟缓,10岁后逐渐发育生长,至青春期(13~18岁),生殖器官迅速发育成熟,卵巢开始排卵并分泌性激素,子宫内膜出现周期性变化,乳房增大,性成熟,具有生育能力。更年期(45~55岁)的卵巢功能逐渐减退,生殖器官日趋萎缩。绝经期以后,卵巢退变,结缔组织增生,不再排卵。
一、卵巢
卵巢表面覆盖一层单层扁平或立方的表面上皮,上皮下方为薄层致密结缔组织构成的白膜。卵巢的外周部分称皮质,中央为髓质。皮质较厚,含有不同发育阶段的卵泡以及黄体和退变的闭锁卵泡等,卵泡间的结缔组织富有网状纤维和梭形基质细胞。髓质由疏松结缔组织构成,与皮质无明显分界,含有许多血管和淋巴管等。近卵巢门处有少量平滑肌束及门细胞(图17-1)。
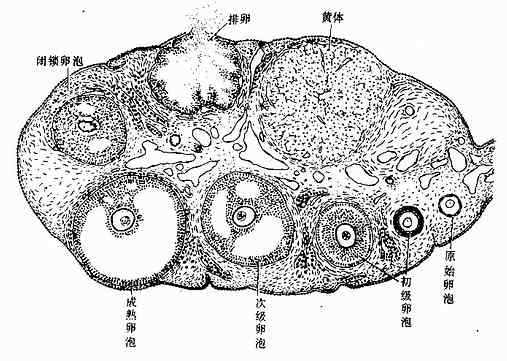
图17-1 卵巢
(一)卵泡的发育与成熟
新生儿两侧卵巢有70万~200万个原始卵泡,青春期约有4万个,至40~50岁时仅剩几百个。在胎儿及儿童期可偶见少量卵泡生长,但都不能发育成熟。从青春期至绝经期30~40年生育时期,卵巢在垂体周期性分泌的促性腺激素的影响下,每隔28天左右有1个卵泡发育成熟并排出1个卵细胞,左右卵巢交替排卵。一生中约排卵400余个,其余卵泡均于不同年龄先后退化为闭锁卵泡。
卵泡由卵母细胞(oocyte)和卵泡细胞(follicular cell)组成。卵泡发育是个连续的生长过程,其结构发生一系列变化,一般可分为原始卵泡、初级卵泡、次级卵泡和成熟卵泡四个阶段。初级卵泡和次级卵泡又合称为生长卵泡。
1.原始卵泡 原始卵泡(primordial follicle)位于皮质浅部,体积小,数量多(图17-2)。卵泡中央有一个初级卵母细胞(primary oocyte),周围为单层扁平的卵泡细胞(又称颗粒细胞)。初级卵母细胞圆形,较大,直径约40μm ,核大而圆,染色质细疏,着色浅,核仁大而明显,胞质嗜酸性。电镜下观察,胞质内除含有一般细胞器外,核周处有层状排列的滑面内质网(称环层板),并可见内质网与核膜相连,这可能与核和胞质间物质传递有关。初级卵母细胞是在胚胎时期由卵原细胞分裂分化液组成,随即进入第一次成熟分裂,并长期停滞于分裂前期(12~50年不等),直至排卵前才完成第一次成熟分裂。卵泡细胞较小,扁平形,细胞与外周结缔组织之间有薄层基膜。卵泡细胞具有支持和营养卵母细胞的作用,卵泡细胞与卵母细胞之间有许多缝隙连接。
2.初级卵泡 初级卵泡(primary follicle)由原始卵泡发育形成。此时期的初级卵母细胞体积增大,卵泡细胞由单层扁平变为立方形或柱状,随之细胞增殖成多层(5~6层)。在排列紧密的卵泡细胞间开始出现考尔-爱克斯诺小体(call-Exner body),其数量随卵泡的生长而增多(图17-2)。小体为圆形囊泡,腔面是一层基膜,周围紧密排列的卵泡细胞,腔内含有卵泡细胞分泌的物质,参与卵泡液的形成。卵巢颗粒细胞肿瘤与考尔-爱克斯诺小体的分化有关,在初级卵泡早期,卵母细胞和卵泡细胞之间出现一层含糖蛋白的嗜酸性膜,称为透明带(zona pellucida),它是卵泡细胞和初级卵母细胞共同分泌形成的。电镜下可见初级卵母细胞的微绒毛和卵泡细胞的突起伸入透明带(图17-3,17-4),卵泡细胞的长突起可穿越透明带与卵母细胞膜接触。在卵泡细胞与卵母细胞之间或卵泡细胞之间有许多缝隙连接。这些结构有利于卵泡细胞将营养物质输送给卵母细胞以及细胞间离子、激素和小分子物质的交换,沟通信息,协调功能。此外,在受精过程中,透明带对精子与卵细胞间的相互识别和特异性结合具有重要意义。随着初级卵泡的体积增大,卵泡渐向卵巢皮质深部移动。卵泡周的结缔组织梭形细胞逐渐密集形成卵泡膜,它与卵泡细胞之间隔以基膜。
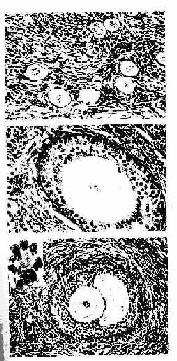
图17-2 人卵巢HE ×160
A原始卵泡(↑) B初级卵泡 ↑示透明带
C次级卵泡 ↑示考尔- 爱克斯诺小体,左上角为该小体的高倍像
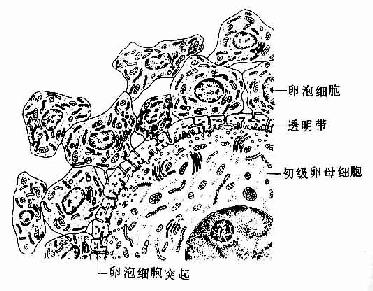
图17-3 初级卵泡超微结构模式图
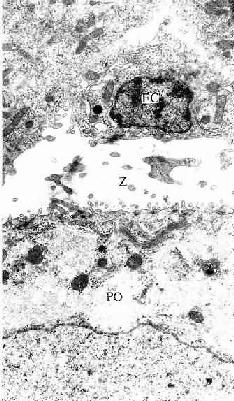
图17-4 大鼠卵泡电镜像 ×10500PO初级卵母细胞,
Z透明带,FC卵泡细胞(白求恩医科大学尹昕、朱秀雄教授供图)
3.次级卵泡 初级卵继续生长成为次级卵泡(secondary follicle),卵泡体积更大,卵泡细胞增至6~12层,细胞间出现一些不规则的腔隙,并逐渐合并成一个半月形的腔,称为卵泡腔(follicullar antrum),腔内充满卵泡液(图17-2)。卵泡液是由卵泡细胞分泌和卵泡膜血管渗出液组成,卵泡液除含有一般营养成分外,还有卵泡分泌的类固醇激素和多种生物活性物质,对卵泡的发育成熟有重要影响。随着卵泡液的增多及卵泡腔扩大,卵母细胞居于卵泡的一侧,并与其周围的颗粒细胞一起突向卵泡腔,形成卵丘(cumulus oophorus)。此时初级卵母细胞直径可达125~150/μm。紧贴透明带的一层柱状卵泡细胞呈放射状排列,称放射冠(corona radiata)。分布在卵泡腔周边的卵泡细胞较小,构成卵泡壁,称为颗粒层(stratum granulosum)。在卵泡生长过程中,卵泡膜分化为内、外两层。内膜层(theca interna)含有较多的多边形或梭形的膜细胞(theca cell)及丰富的毛细血管,膜细胞具有分泌类固醇激素的结构特征。外膜层(theca externa)主要由结缔组织构成,胶原纤维较多,并含有平滑肌纤维。具有卵泡腔的次级卵泡和成熟卵泡又称为囊状卵泡。
4.成熟卵泡 成熟卵泡(mature follicle)是卵泡发育的最后阶段。卵泡体积很大,直径可达20mm,并向卵巢表面突出(图17-1,17-5)。成熟卵泡的卵泡腔很大,颗粒层甚薄,颗粒细胞也不再增殖。此时的初级卵母细胞又恢复成熟分裂,在排卵前36~48小时完成第一次成熟分裂。产生1个次级卵母细胞(secondary oocyte)和1个很小的第一极体(first polar body)。第一极体位于次级卵母细胞和透明带之间的卵周间隙(perivitelline space)内。次级卵母细胞随即进入第二次成熟分裂,停止于分裂中期。人每个月经周期,可有若干个原始卵泡生长发育,通常只有1个卵泡发育成熟并排卵。

图17-5 猫卵巢内的近成熟卵泡 HE×160
传统认为,人原始卵泡发育至成熟排卵是在1个月经周期的增生期内完成(约10~15天)。近些年对某些动物和人卵泡生长发育的研究揭示,卵泡生长速度较慢,1个原始卵泡发育至成熟排卵,并非在1个月经周期内完成,而是跨几个周期才能完成。在1个周期内,卵巢虽然有若干不同发育状况的卵泡,但其中只有1个卵泡发育至一定大小时才可在垂体促性腺激素的作用下,于月经周期增生期内迅速生长成熟并排卵。Gougen观察手术切除的人卵巢,研究卵泡生长至排卵所需的时间,观察卵泡膜内层细胞的分化,并结合颗粒细胞数量的增长,将有膜细胞的卵泡生长分为8个等级,且以体外培养颗粒细胞分裂周期的时间为参数,计算卵泡生长每个等级所需的时间。分级情况如下(图17-6):初级卵泡进入第一级是在黄体期开始时,约经25天在第2个月经周期的卵泡期转入第2级,此时卵泡腔出现;约经20天黄体期末转入第3级,此时期的颗粒细胞分裂增殖较明显;又经15天,于第3个月经周期,转入第4级;再经10天,在黄体期末转入第5级;此后相继转入第6,7,8级,其间各相隔5天,此阶段的健康卵泡数很少。健康的7级和8级卵泡仅见于第4个月经周期的卵泡期中期和晚期。
从初级卵泡后期至成熟排卵约需85天(图17-6)。从小囊状卵泡发育至排卵约需2个月。
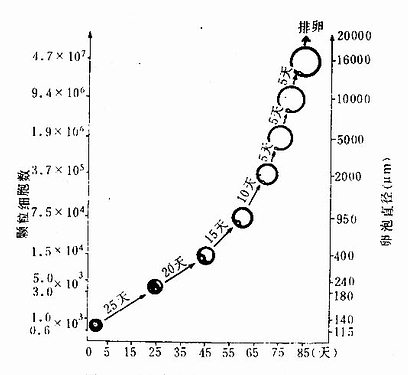
图17-6 人卵泡生长过程中卵泡膜分化与颗粒细胞数的增长
卵泡发育过程中还有内分泌功能,主要分泌雌激素。雌激素是颗粒细胞和膜细胞在FSH和LH的作用下协同合成的。膜细胞合成的雄激素透过基膜进入颗粒细胞,在芳香化酶系的作用下雄激素转变为雌激素,这是雌激素合成的主要方式,称此为“两细胞学说”(图17-7)。合成的雌激素小部分进入卵泡腔,大部分释放入血,调节子宫内膜等靶细胞的生长分化。
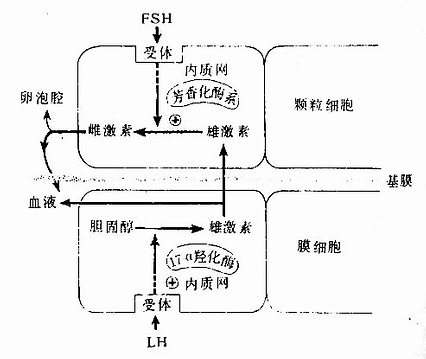
图17-7 颗粒细胞与膜细胞协同合成雌激素示意图
(二)排卵
成熟卵泡破裂,卵母细胞自卵巢排出的过程称为排卵(ovulation)。排卵时间约在月经周期的第14天。在排卵前,垂体释放LH量骤增,使卵泡发生一系列变化。卵泡液增多,突向卵巢表面的卵泡壁、白膜和表面上皮均变薄,局部缺血,形成圆形透明的卵泡小斑(follicular stigma)(图17-8)。排卵时,卵丘与卵泡壁分离,小斑处的结缔组织被胶原酶和透明质酸酶解聚,LH促进颗粒细胞合成的前列腺素使卵泡膜外层的平滑肌收缩,导致小斑破裂。卵母细胞及其外周的透明带和放射冠细胞随卵泡液从卵巢排出,经腹膜腔进入输卵管。卵排出后若在24小时内不受精,次级卵母细胞即退化;若与精子相遇受精,次级卵母细胞即完成第二次成熟分裂,形成1个成熟的卵细胞(ovum)和1个第二极体(secondary polar body)。卵母细胞经过两次成熟分裂,卵细胞的染色体减半,从二倍体细胞(46,XX)变为单倍体细胞(23,X)。
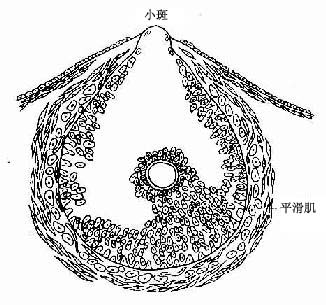
图17-8 成熟卵泡排卵模式图
(三)黄体的形成和功能
成熟卵泡排卵后,残留在卵巢内的卵泡壁塌陷,卵泡膜内的血管和结缔组织伸入颗粒层。在LH的作用下。卵泡壁的细胞体积增大,分化为一个体积很大并富含血管的内分泌细胞团,新鲜时呈黄色,称为黄体(corpus luteum)(图17-1)。颗粒细胞分化为粒黄体细胞(granular lutein cell),膜细胞分化为膜黄体细胞(theca lutein cell)。粒黄体细胞较大,呈多角形,染色较浅,数量多;膜黄体细胞较小,圆形或多角形,染色较深,数量少,分布于黄体的周边部(图17-9)。这两种细胞具有分泌类固醇激素细胞的结构特征,细胞内有丰富的滑面内质网和管状嵴的线粒体,还有脂滴和黄色脂色素。黄体的主要功能是分泌孕激素和一些雌激素,前者由粒黄体细胞分泌,后者主要由两种细胞协同分泌。
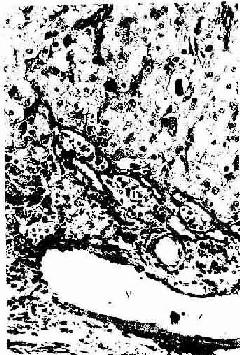
图17-9 人卵巢黄体细胞 HE×400
G粒黄体细胞 T膜黄体细胞V血管
黄体的发育因卵细胞是否受精而差别甚大。卵细胞若未受精,黄体仅维持2周,称月经黄体(corpus luteum of menstruation),黄体细胞迅速变小和退化,渐被结缔组织取代,称为白体(corpus albicans)。卵细胞若受精,黄体在胎盘分泌的人绒毛膜促性腺激素(HCG)的作用下继续发育增大,直径可达4~5cm ,称妊娠黄体(corpus luteum of pregnancy)。妊娠黄体可保持6个月,以后也退化为白体。妊娠黄体的粒黄体细胞还分泌松弛素(relaxin),它可使妊娠子宫平滑肌松弛,以维持妊娠。
(四)卵泡闭锁与间质腺
卵巢的绝大部分卵泡不能发育成熟,它们在卵泡发育的各阶段逐渐退化,退化的卵泡称为闭锁卵泡(atresic follicle)(图17-1,17-5)。卵泡闭锁时形态结构的变化与卵母的大小相关。原始卵泡退化时,卵泡细胞首先出现核固缩,细胞形态不规则。卵泡细胞变小且分散,两种细胞随后均自溶消失。初级卵泡和早期次级卵泡的退化与原始卵泡相似,但退化的卵泡内可见残留的透明带,卵泡腔内常见中性粒细胞和巨噬细胞。晚期次级卵泡的闭锁变化较特殊,卵泡塌陷,卵泡膜的血管和结缔组织伸入颗粒层及卵丘,膜细胞一度增大,形成多边形上皮样细胞,胞质中充满脂滴,形似黄体细胞,并被结缔组织和血管分隔成分散的细胞团索,称为间质腺(interstitial gland)。成人卵巢间质腺细胞数量少,且散在分布于基质中;猫及啮齿动物卵巢的间质腺较多,有分泌雌激素的功能。
(五)门细胞
门细胞(hilus cell)位于卵巢门近系膜处,则一些较大的上皮样细胞,细胞结构与睾丸间质细胞类似,胞质内富含胆固醇和脂色素等。妊娠期和绝经期的门细胞较明显,有分泌雄激素的功能。倘若门细胞增生或发生肿瘤时,患者常伴有男性化症状。
二、输卵管
输卵管主要分漏斗部、壶腹部、峡部和子宫部,管壁均由粘膜、肌层和浆膜三层组成。
粘膜形成许多纵行而分支的皱襞,壶腹部的皱襞最发达,高而多分支,故管腔不规则(图17-10);至子宫部的皱襞渐减少。粘膜上皮为单层柱状。由纤毛细胞和分泌细胞组成(图17-11)。纤毛细胞以漏斗部和壶腹部最多,至峡部和子宫部逐渐减少,纤毛向子宫方向摆动,使卵移向子宫并阻止病菌进入腹膜腔.分泌细胞表面有微绒毛,顶部胞质内有分泌颗粒,其分泌物构成输卵管液。输卵管上皮细胞在卵巢雌激素和孕激素的作用下,随月经周期而有变化。雌激素促进输卵管上皮细胞的生长的功能活动,在子宫内膜增生晚期(排卵前)。纤毛细胞变成高柱状,纤毛增多,分泌细胞顶部充满分泌颗粒,功能旺盛。至分泌晚期,两种细胞均变矮,分泌细胞的分泌颗粒排空,纤毛细胞的纤毛也减少。在月经期和妊娠期,上皮细胞矮小。粘膜固有层为薄层细密的结缔组织,并有少量散在的平滑肌。
肌层以峡部最厚,由内环行和外纵行两层平滑肌组成。壶腹部肌层较薄,环行肌明显,纵行肌散在分布。输卵管浆膜由间皮和富含血管的疏松结缔组织组成。
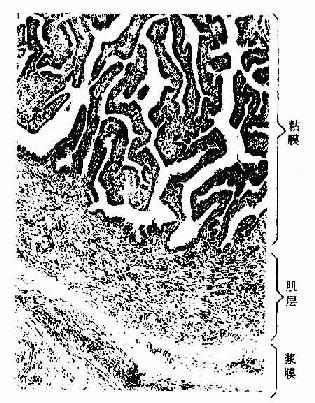
图17-10 人输卵管壶腹部 HE × 83
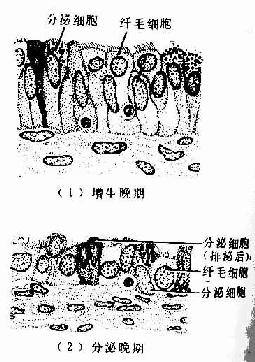
图17-11 输卵管上皮
三、子宫
子宫为肌性器官,腔窄壁厚,分底部、体部、颈部三部分。体部和底部的子宫壁由外向内分为外膜、肌层和内膜(又称粘膜)(图17-12)。
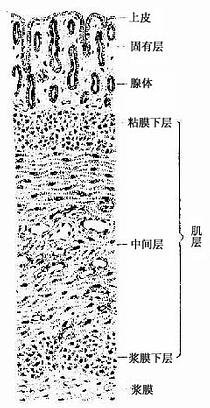
图17-12 子宫壁
(一)子宫壁的组织结构
1.外膜 子宫外膜(perimetrium)于底部和体部为浆膜,其余部分纤维膜。
2.肌层 子宫肌层(myometrium)甚厚,由成束或成片的平滑肌组成,肌束间以结缔组织分隔。肌层分层不明显,各层肌纤维互相交织,自内向外大致可分为粘膜下层、中间层和浆膜下层。粘膜下层和浆膜下层主要为纵行平滑肌束,中间层较厚,分内环行的外纵行肌,富含血管。成年妇女子宫平滑肌纤维长约50μm,妊娠时肌纤维显着增长,可长达500μm以上,肌纤维可分裂增殖,结缔组织中未分化的间充质细胞也可分化为肌纤维,使肌层增厚。分娩后,部分肌纤维恢复正常大小,部分肌纤维退化消失,增大的子宫恢复原状。子宫平滑肌的收缩受激素的调节,其收缩活动有助于精子向输卵管运送及经血排出和胎儿娩出。
3.内膜 子宫内膜(endometrium)由单层柱状上皮和固有层组成。内膜表面的上皮向固有层内深陷形成许多管状的子宫腺,其末端近肌层处常有分支。表面上皮与腺上皮结构相似,均由分泌细胞和少量纤毛细胞构成,但分布于子宫功能层的腺上皮细胞对卵巢激素反应敏感而有周期性变化,固有层较厚,血管较丰富,并有大量分化较低的梭形或星状细胞,称为基质细胞(stroma cell)。
子宫底部和体部的内膜可分为功能层(functional layer)和基底层(basal layer)两层。功能层位于浅部,较厚,自青春期起在卵巢激素的作用下发生周期性剥脱和出血。妊娠时,胚泡植入功能层并在其中生长发育。基底层较薄,位于内膜深部与肌层相邻,此层无周期性脱落变化,有修复内膜的功能。
子宫动脉的分支经外膜穿入子宫肌层,在中间层内形成弓形动脉。从弓形动脉发出许多放射状分支,垂直穿入内膜,在内膜与肌层交界处,每条小动脉发出一小而直的分支称基底动脉,分布于内膜基底层,它不受性激素的影响。小动脉主干从内膜基底层一直延伸至功能层浅部,呈螺旋状走行,称螺旋动脉(图17-13)。螺旋动脉在内膜浅部形成毛细血管网,毛细血管汇入小静脉,穿越肌层,汇合成子宫静脉。螺旋动脉对卵巢激素的作用很敏感。
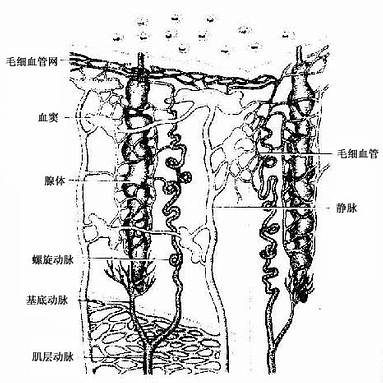
图17 -13 子宫内膜血管与腺模式图
(二)子宫内膜周期性变化
自青春期起,在卵巢分泌的雌激素和孕激素的周期性作用下,子宫底部和体部的功能层内膜出现周期性变化,每28天左右发生一次内膜脱与出血及修复和增生,称为月经周期(menstrual cycle)。每个月经周期是从月经第1天起至下次月经来前一天止。内膜周期性变化一般分为三期,即月经期、增生期和分泌期(图17-14)。
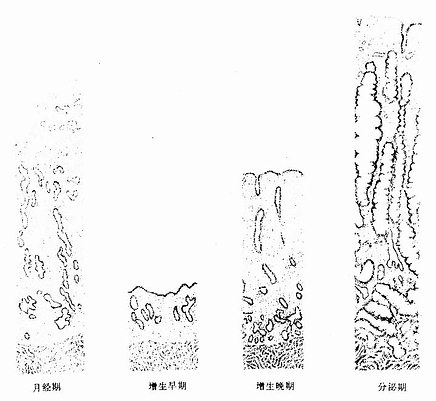
图17-14 子宫内膜周期性变化示意图
1.月经期月经期(menstrual phase)为周期第1~4天。由于卵巢内的黄体退化,雌激素和孕激素分泌量骤然下降,子宫内膜功能层的螺旋动脉发生持续性收缩,内膜缺血,组织坏死。螺旋动脉在收缩之后,又突然短暂地扩张,血液溢入结缔组织,最终突破退变坏死的内膜表层,流入子宫腔,从阴道排出,即为经血。退变及坏死的内膜呈小块状剥脱,直至功能层深部。月经期的持续时间一般为3~5天,因个体而差异并受环境变化的影响。在月经终止前,内膜基底层子宫腺残端的细胞迅速分裂增生,并铺展在脱落的内膜表面,内膜修复而进入增生期。
2.增生期 增生期(proliferation phase)又称卵泡期(follicular phase),为周期的第5~14天。此时期的卵巢内有若干卵泡生长,在卵泡分泌的雌激素作用下,子宫内膜发生增生性变化。在月经终止前,子宫内膜已修复,增生早期的子宫腺短直而细,数量较少。在整个增生期内的上皮细胞与基质细胞不断分裂增殖,子宫腺细胞对激素的反应也较强,雌激素使腺上皮逐渐生长与分化(图17-15)。至增生晚期(第11~14天),内膜增厚达1~3mm,子宫腺也增多,并不断增长和弯曲,上皮细胞分化成熟,胞质中糖原积聚,腺腔扩大。螺旋动脉也增长并弯曲。至增生期未,卵巢内的成熟卵泡排卵,子宫内膜由增生期转入分泌期。
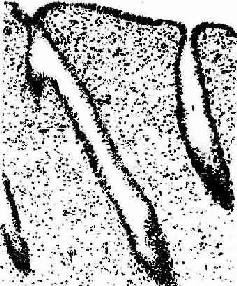
图17-15 人子宫内膜增生期
HE×320 ↓子宫腺
3.分泌期 分泌期(secretory phase)又称黄体期(luteal phase)。此时卵巢已排卵,黄体形成。子宫内膜在黄体分泌的雌激素和孕激素,尤其是孕激素的作用下继续增厚,于分泌早期(排卵后2天),子宫腺更弯曲,腔也变大,腺细胞核下区出现大量糖原聚积,细胞核则移至细胞顶部。在HE染色切片中,糖原被溶解,构成光镜下所见的核下空泡(图17-16)。随后,腺细胞核下区糖原渐转移至细胞顶部即核上区,并以顶浆分泌方式排入腺腔,腺腔内可见含糖原的嗜酸性分泌物(图17-17)。腺细胞分泌活动于周期第21天达高峰。腺细胞排泌后,细胞低矮,腺腔扩大呈锯齿状(图17-14)。此时期的固有层内组织液增多,内膜水肿,螺旋动脉增长并更弯曲,伸至内膜表层。于分泌晚期,基质细胞增生并分化形成两种细胞。一种为前蜕膜细胞(predecidual cell),细胞体积大而圆,胞质中含有糖原及脂滴;于妊娠期,前蜕膜细胞在妊娠黄体分泌的孕激素影响下,继续发育增大,成为蜕膜细胞。另一种细胞为内膜颗粒细胞,细胞体积较小,圆形,胞质内含有颗粒,细胞分泌松弛素。至分泌晚期,内膜可厚达5mm。卵若受精,内膜继续增厚;卵若未受精,卵巢内的月经黄体退变,孕激素和雌激素水平下降,内膜脱落又转入月经期。
绝经后,卵巢功能退化,激素分泌停止,子宫内膜萎缩变薄,仅残留稀少而细小的腺体。

图17-16 人子宫内膜分泌早期的子宫腺HE×400 ↑示腺细胞核下空泡
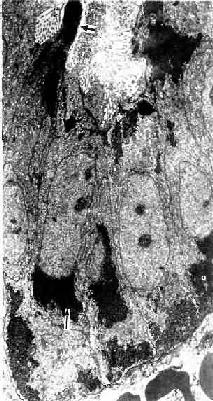
图17-17人子宫内膜分泌早期子宫腺电镜像 ×6000
↑腺细胞核下糖原斑,(
)顶浆分泌
(三)子宫颈
子宫颈为子宫下端较窄的圆柱体,长约3cm,突入阴道的部分称为宫颈道部,在阴道穹窿以上的部分称阴道上部。子宫颈管腔细窄呈梭形,子宫颈壁由外向内分为外膜、肌层和粘膜。外膜是结缔组织构成的纤维膜,肌层由平滑肌及含有丰富弹性纤维的结缔组织组成,平滑肌数量从宫颈上端至下端逐渐减少。子宫颈粘膜由单层柱状上皮及固有层组成。子宫颈管前、后壁粘膜分别形成一条纵襞,从纵襞向外又伸出许多斜行皱臂,皱臂之间的裂隙形成腺样隐窝。粘膜上皮由分泌细胞、纤毛细胞及储备细胞(reserve cell)构成。宫颈粘膜无周期性脱落,但上皮细胞的活动受卵巢激素的调节。分泌细胞数量较多,胞质中充满粘原颗粒,雌激素促使细胞分泌增多,分泌物为稀薄粘液,有利于精子通过。孕激素使细胞分泌减少,分泌物粘稠呈凝胶状,形成阻止精子及微生物进入子宫的屏障。纤毛细胞数量较少,纤毛向阴道方向摆动,以助分泌物排出。储备细胞小,位于柱状细胞与基膜之间,散在分布,细胞分化较低,在上皮受损伤时有增殖修复功能。子宫颈慢性炎症时,储备细胞增殖化生为复层扁平上皮,在增生过程中也可发生癌变.在宫颈外口处,单层柱状上皮移行为复层扁平上皮,两种上皮分界清晰,交界处是宫颈癌好发部位.
子宫颈阴道部的复层扁平上皮与阴道上皮相似,细胞内含丰富的糖原。在性激素周期的影响下,上皮细胞的结构和功能可略有变化。
绝经后,宫颈变小,质硬,粘膜萎缩,腺样隐窝减少,分泌功能低下。
(四)卵巢和子宫内膜周期性变化的神经内分泌调节
女性生殖器官的周期性变化,主要在神经系统调控下受下丘脑、脑垂体和卵巢的激素的调节,称此为下丘脑-垂体-卵巢轴(图17-18).下丘脑弓状核等神经内分泌细胞分泌促性腺激素释放激素(G nRH),促使腺垂体分泌FSH和LH,LH的合成与释放受GnRH的严格控制,FSH的分泌还受其他因素的影响。FSH刺激卵泡的生长和成熟,并分泌雌激素(雌二醇),在FSH的协同作用下促成排卵及黄体形成。
月经来潮时,血液内的FSH开始略有升高;在卵泡发育早期,FSH维持较低水平,随着卵泡的生长,雌激素分泌量逐渐增高,子宫内膜呈增生期变化。约在排卵前2天,血液内雌激素含量达高峰,高水平的雌激素和GnRH的作用促使垂体分泌大量LH,出现排卵前LH释放高峰;与此同时血液内FSH也增高,但峰值比LH低。雌激素可增强促性腺激素细胞对GnRH的反应性,并促使其合成的激素大量释放,排卵常发生于LH高峰后24小时左右。排卵后,卵泡壁LH的作用下形成黄体,分泌大量孕激素(孕酮)和一些雌激素,子宫内膜在这两种激素作用下呈分泌期变化。血液内高水平的孕激素和雌激素还对下丘脑和垂体起负反馈作用,分别掏LH和FSH的分泌。当黄体缺乏LH的支持作用,即逐渐退化,孕激素和雌激素水平下降,子宫内膜遂发生退变和剥脱。
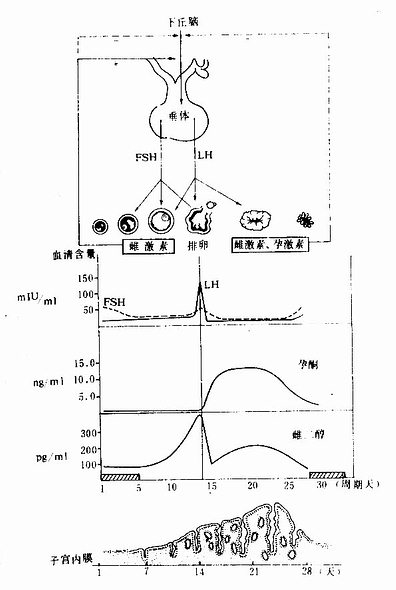
图17-18下丘脑、垂体、卵巢内分泌与子宫
内膜周期变化的关系
四、阴道
阴道壁由粘膜、肌层和外膜组成。阴道粘膜形成许多横形皱襞,粘膜上皮为非角化型复层扁平上皮,较厚,一般情况下表层细胞虽含透明角质颗粒,但不出现角化(图17-19)。在阴道脱垂病人,局部上皮可出现角化。阴道上皮的脱落与更新及其一定的周期性变化受卵巢激素的影响,雌激素促使阴道上皮增厚,并使细胞合成大量糖原。在月经周期增生晚期阴道上皮最厚。在子宫内膜分泌晚期雌激素水平下降时,阴道上皮细胞脱落明显,上皮变薄。临床可通过阴道上皮脱落细胞的涂片观察,了解卵巢内分泌功能状态。脱落细胞中除阴道上皮细胞外,还有子宫颈及子宫内膜的脱落细胞,故阴道涂片检查也是诊断生殖道肿瘤的一种方法。阴道上皮细胞脱落后,细胞内糖原被阴道内的乳酸杆菌分解为乳酸,使阴道分泌物保持酸性,有一定的抗菌作用。绝经后阻道粘膜萎缩,上皮变薄,脱落细胞少,阴道液pH值上升,细菌易繁殖而导致阴道炎。粘膜固有层的浅层是较致密的结缔组织,含有丰富的毛细血管和弹性纤维,深层有丰富的静脉丛。

图17 -19 成人阴道粘膜 HE×160
阴道肌层为平滑肌,较薄弱,肌束呈螺旋状,交错成格子状排列,其间的结缔组织中弹性纤维较丰富。阴道肌层的这种结构特点使阴道壁易于扩大。阴道外口有骨骼肌构成的环行括约肌,称尿道阴道括约肌。外膜为富于弹性纤维的致密结缔组织。
五、乳腺
乳腺于青春期开始发育,其结构随年龄和生理状况的变化而异。妊娠期和授乳期的乳腺分泌乳汁,称活动期乳腺。无分泌功能的乳腺,称静止期乳腺。
(一)乳腺的一般结构
乳腺被结缔组织分隔为15~25个叶,每个叶又分为若干小叶,每个小叶是一个复管泡状腺。腺泡上皮为单层立方或柱状,在上皮细胞和基膜间有肌上皮细胞。导管包括小叶内导管、上间导管和总导管。小叶内导管多为单层柱状或立方上皮,小叶间导管为复层柱状上皮,总导管又称输乳管,开口于乳头,管壁为复层扁平上皮,下乳头表皮相续。
(二)静止期乳腺
静止期乳腺是指未孕女性的乳腺,腺体不发达,仅见少量导管和小的腺泡,脂肪组织和结缔组织丰富(图17-20)。在排卵后,腺泡和导管略有增生。。
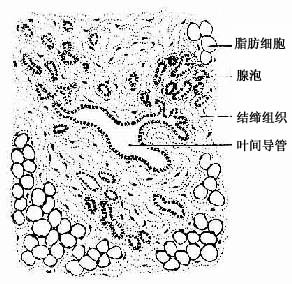
图17-20 静止期乳腺
(三)活动期乳腺
妊娠期在雌激素和孕激素的作用下,乳腺的小导管和腺泡迅速增生,腺泡增大,上皮为单层柱状或立方细胞,结缔组织和脂肪组织相应减少。至妊娠后期,在垂体分泌的催乳激素的影响下,腺泡开始分泌。乳腺为顶浆分泌腺,分泌物中含有脂滴、乳蛋白、乳呼抗体等,称为初乳。初乳内还有吞噬脂肪的巨噬细胞,称初乳小体(图17-21)。
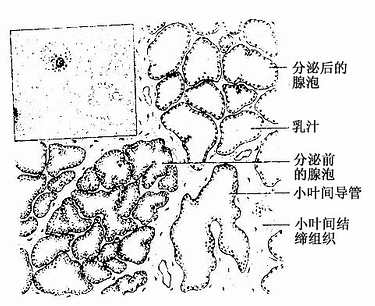
图17-21 妊娠期乳腺左上示的初乳中的脂滴和初乳小体
哺乳期乳腺结构与妊娠期乳腺相似,但腺体发育更好,腺泡腔增大。腺泡处于不同的分泌时期,有的腺泡呈分泌前期,腺细胞呈高柱状;有的腺泡处于分泌后期,朱细胞呈立方形或扁平形,腺腔充满乳汁(图17-21)。腺细胞内富含粗面内质网和线粒体等,呈分泌状态的腺细胞内有许多分泌颗粒和脂滴(图17-22)。
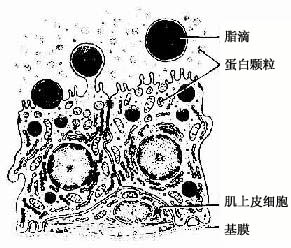
图17-22 哺乳期乳腺腺细胞超微结构模式图
断乳后,催乳激素水平下降,乳腺停止分泌,腺组织逐渐萎缩,结缔组织和脂肪组织增多,乳腺又转入静止期。绝经后,体内雌激素及孕激素水平下降,乳腺组织萎缩退化,脂肪也减少。