淋巴细胞是具有特异免疫识别功能的细胞系,人和哺乳类动物的淋巴细胞系是由形态相似、功能各异的不均一细胞群所组成。按其个体发生、表面分子和功能的不同,可将淋巴细胞系分为T细胞和B细胞二个亚群,每个亚群又可分为不同的亚类。另外还有一群单核细胞,其来源可能与淋巴细胞相关,但不具有特别识别功能,称为天然杀伤细胞(natural killer cell,NK)可归类为第三群淋巴细胞。
成熟的T和B细胞均为单核的小淋巴细胞。在光学显微镜下,单纯从形态学是能加以区别的。但在它们的细胞膜上都有不同的分子结构,包括膜抗原分子和膜受体分子。这些表面标志都是结合在膜上的巨蛋白分子,可用不同的方法检测,借以鉴定和区分淋巴细胞系的不同亚群和亚类。
研究这些膜分子的结构与功能将有助于了解淋巴细胞活化的机制。研究这些膜分子基因的表达与调控,对了解淋巴细胞的起源、分化与成熟都具有十分重要的理论意义。并且在淋巴细胞的分类、诊断与相关疾病的治疗及发病学等方面都具有应用意义。
第一节 T细胞
一、T细胞主要表面分子
T细胞是由一群功能不同的异质性淋巴细胞组成,由于它在胸腺内分化成熟故称为T细胞。成熟T细胞由胸腺迁出,移居于周围淋巴组织中淋巴节的副皮质区和脾白髓小动脉的周围。不同功能成熟的T细胞均属小淋巴细胞,在形态学上不能区分,但可借其细胞膜表面分子不同加以鉴别(表8-1)。
在T细胞发育不同阶段以及成熟T细胞在静止期和活化期,其细胞膜分子表达的种类和数量均不相同。这些分子为抗原性不同的糖蛋白。它们与T细胞对抗原的识别、细胞的活化、信息的传递、细胞的增殖和分化以及T细胞的菜单达相关。它们也与T细胞在周围淋巴组织中的定位相关。
由于这些分子在T细胞表面相当稳定,故可视为T细胞的表面标志,可以用以分离。鉴定不同功能的T细胞。这些分子的单克隆抗体对临床相关疾病的诊断和治疗也具有重要应用价值。
表8-1 T细胞主要表面分子
| 名称 |
生化特性 |
配体 |
功 能 粘附 信号传导 |
| TCR |
αβ异二聚γδ异二聚体 |
MHC-肽复合分子 |
+ + |
| CD3 |
五聚体 |
- |
- + |
| CD4 |
单体分子 |
MHCⅡ类分子 |
+ + |
| CD8 |
双体分子 |
MHCⅠ类分子 |
+ + |
| CD28 |
同二聚体分子 |
B7/BB1 |
+ + |
| CD2(LFA-2) |
单体分子 |
CD58(LFA-3) |
+ + |
| CD11α/CD18 (LFA-1) |
αβ异二聚体分子 |
CD54 (ICAM-1) (ICAM-2) |
+ + |
| CDw49/CD29 (VLA-4、5、6) |
αβ异二聚体分子 |
VCAM-1 |
+ ? |
| CD44)(Pgp-1) |
单体分子 |
ECM |
+ + |
| CD45 |
单体分子 |
? |
? + |
(一)T细胞抗原识别受体(TCR)
1.TCRαβ TCR是T细胞识别蛋白抗原的特异性受体,不同的T细胞克隆其抗原识别受体的分子结构也是不相同的。大多数成熟T细胞(约占95%)的TCR分子是由α和β二条异二聚体肽链组成的TCRαβ分子。二条肽链都由膜外区、穿膜区及胞浆区组成。TCR属于Ig超家族,膜外区可包括可变区(V区)及稳定区(C区)。
编码人TCRα链和β链基因座分别定位于第14号和7号染色体。α链是由V、J、C基因段编码的肽链。每个基因座又各有不同的等位基因,在T细胞发育分化早期与Ig基因一样经历基因重排、转录和转译成为肽链。TCR的特异性是由α链和β链的V-J及V-D-J基因片段决定的,故二条链基因重排后可形成千万种不同特异性的TCR分子,故可识别环境中多种多样的抗原。在通常情况下,异种蛋白抗原分子必须与细胞表面的自身MHC分子结合才能TCR识别。所以TCR只能识别细胞膜上的MHC分子与抗原分子,这是与B细胞识别原的主要不同特性。
2.TCRγδ另一种TCR是由γ和δ链组成的TCRγδ分子,它是由γ和δ基因编码的分子。这种TCRγδ细胞多见一胸腺内早期T细胞(CD4-,CD8-,TCRγδ+),而在人周围血成熟T细胞(CD3+,TCRγδ+)中所占的比例甚少,约为1%~10%。在小鼠脾、表皮细胞和肠粘膜上皮细胞中亦可发现γδ+T细胞。对这种新发现的T细胞的生理功能尚不不清楚,但它们可能是具有原始受体的第一防线的防御细胞,与清除表皮及上皮细胞内异物有关,它们可能是具有原始受体的第一防线的防御细胞,与清除表皮及上皮细胞内异物有关。它们可识别高度保守的抗原,如结核杆菌、肠毒素和热休克蛋白等抗原,在人和小鼠均表明它们可识别MHC或MHC样分子。
(二)CD3分子
此分子可表达于所有成熟T细胞表面,它是由五条肽链非共价结合组成的复合分子,分别称为γ、δ、ε、ζ和η链。五条肽链均由胞外区、穿膜区和胞浆区组成。γ、δ和ε为单体,ζ和η链其胞外区可由双硫键连接组成为同二聚体ζζ(约占90%)和异二聚体ζη分子(约占10%)。
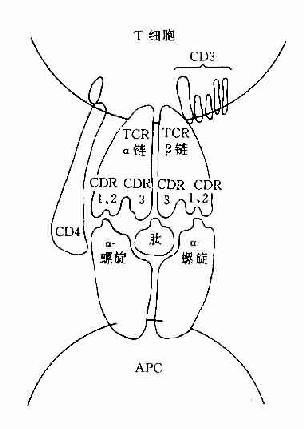
图8-1 TCR识别普通抗原
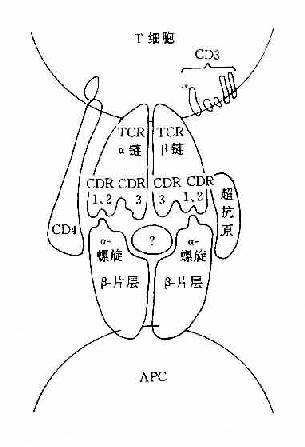
图8-2 TCR识别超抗原
CD3分子可与TCR分子以非共价结合形成一个TCR-CD3复合受体分子,是T细胞识别抗原的主要识别单位。其中TCR是识别异种抗原和自身MHC分子多态性决定族的受体,而CD3分子交不参予抗原识别,它具有稳定TCR结构和传递活化信号的作用。
(三)CD4和CD8分子
这二种分子可同时表达于胸腺内早期胸腺细胞,称为双阳性胸腺细胞(CD4+、CD8+,DP)。而在成熟T细胞这二种分子是互相排斥的,只能表达一种分子,故可将成熟T细胞分为二类,即CD4+细胞和CD8+细胞。在外周淋巴组织中CD4+T约占65%,CD8+T约占35%。
这二种分子同属于Ig超家族,都不具有多样性。其分子结构都由胸外区、穿膜区及胸内区组成。CD4分子为55KD的单体,CD8分子为34KD多肽组成的双体分子。
这二种分子与抗原识别无关,但可与带有MHC分子的细胞结合,它们是细胞与细胞间相互作用的粘附分子。CD4分子是MHCⅡ类分子的受体,它可与MHCⅡ类分子的非多态区结合。CD8分子可与MHCⅠ类分子的非多态区结合。因此这二种分子具有增强TCR与抗原呈递细胞或靶细胞的亲和性,并有助于激活信号的传递。
(四)CD28分子
这种分子可表达于全部CD4+T细胞及50%CD8+细胞。它是80~90KD的由双硫键连接的同源二聚体分子,属Ig基因超家族。
近年的研究证明T细胞的活化需要双信号,即由TCR-CD3复合分子可提供起始信号或第1信号,还必须有协同刺激信号(costimulatouy signal)或第2信号才能使T细胞活化。在T细胞膜上已发现有多种分子与协同刺激信号产生有关,如CD2、LFA-1、VLA-4及CD28分子等。称这种分子为辅助分子或协同刺激受体分子。
其中以CD28分子最为重要,已证明它的配体分子存在于B细胞或其它抗原呈递细胞上,命名为B7或BB1分子。它是50KD单体分子的穿膜蛋白,也属Ig基因超家族。B7/BB1分子在静止期B细胞、巨噬细胞或树突状细胞等表达弱,而活化型细胞表达增强。
(五)CD2分子
此分子亦称为LFA-2、Len-5或羊红细胞受体等名称。为55KD单体分子,属Ig基因超家族,亦为穿膜糖蛋白分子。可存在于成熟T细胞及胸腺细胞,亦可发现于NK细胞。
CD2分子是细胞间粘附分子,其配体分子称为白细胞功能相关抗原-3(LFA-3,CD58),为55-70KD糖蛋白分子。可广泛表达于造血细胞和非造血细胞。CD2分子与羊红细胞上LFA-3结合形成花环,称为E-花环,可用鉴定和分离人T细胞。
CD2也是信号传导分子,可使T细胞活化,它不依赖于TCR途径,是T细胞活化第二途径。特别是在胸腺内早期发育阶段的胸腺细胞尚未表达TCR,此时胸腺细胞的活化与增殖可能是通过CD2分子与胸腺上皮细胞表面的LFA-3分子结合而使之活化。
(六)极迟活化分子
极迟活化分子(very late activation,VLA)或称β1粘合素(β1integrins),本族分子具有共同的β链(CD29),计有3种分子即VLA-4、VLA-5和VLA-6分子。它们可表达于静止T细胞上,但活化T细胞有仅数量增多而且对特异配体的亲和力也增强。VLA分子可与细胞外基质(ECM)配体分子相结合,可为T细胞活化提供协同刺激信号。VLA-4还可使淋巴细胞与Peyer小体的高内皮微静脉以及炎症部位的内皮细胞结合,其配体分子称为血管细胞粘附分子-1(VCAM-1)。
(七)细胞因子受体
细胞因子受体(cytokine receptor,CKR)可表达于静止及活化T细胞表面,静止T细胞表面的细胞因子受体亲和力弱,数量少,而活化T细胞表面CKR亲和力高且数量多。
T细胞表面可有多种细胞因子受体,包括IL-2R、IL-4R、IL-6R及IL-7R等。其中IL-2R由α(P55)及β(P70)链组成,α链为低亲和力,β链为中等亲和力,而αβ异聚体分子则为高亲和力受体。
(八)CD44及CD45分子
CD44分子亦称Pgp-1细胞外基质受体Ⅲ或Hermes分子。它可表达于多种细胞,包括T细胞、胸腺细胞、B细胞、粒细胞、巨噬细胞、红细胞、神经细胞、上皮及纤维母细胞等。CD44分子可使淋巴细胞与高内皮微静脉(HEV)结合,移行于血管,组织和淋巴之间,与淋巴细胞再循环密切相关,可视为一种归巢受体(homingreceptor,HR)。人记忆T细胞比未受体抗原刺激的天然T细胞可表达高水平CD44分子。
CD45分子亦称白细胞共同抗原(leukocyte common antigen)包括一组膜糖蛋白,只表达于不成熟和成熟白细胞,可包括T和B细胞、胸腺细胞、单核-巨噬细胞以及中性粒细胞。CD45分子的异构体(isofoums)常限定在某些T细胞表面表达,故称之为CD45R。
未受抗原刺激的天然T细胞可表达CD45RA,而记忆T细胞可表达CD45RO。另外,CD45R分子胞浆区含有内源性酪氨酸磷酸酶活性,它可能对各种活化途径具有重要调节作用。
二、T细胞亚群的分类及功能
T细胞是不均一的群体,按其抗原识别受体,可将T细胞分为二大类。一类是TCRαβ、T细胞,另一类是TCRγδ细胞(表8-2)。
表8-2 TCRαβ+T细胞与TCRγδT细胞的特性
|
TCRαβT细胞 |
TCRγδT细胞 |
| 分子结构 |
二硫键相连的异二聚体分子 |
二硫键相连的异二聚体分子 |
| 多样性 |
多 |
少 |
| 分布 |
周围血60%~70% |
周围血1%~10%表皮及肠粘膜上皮 |
| 表型 |
CD4+CD8+(DP)60% CD4-CD8-(DN)35% CD2+100% CD5+>95% |
CD4-CD8-(DN) CD2+ CD5- |
| 发育 |
胸腺(发生晚) |
胸腺(发生早)存在胸腺外途径 |
| 功能 |
识别与MHC分子结合的多肽复合 分子抗原 |
可能的作用 · 第一线防御细胞的原始受体 · 可识别MHC或MHC样分子 · 识别由MHC 样分子呈递的抗原 |
TCRαβT细胞也是不均一的群体,根据其表型(phenotype)即其细胞表面的特征性分子的不同,可将成熟T细胞分为二个亚类(subsets)即CD4+T细胞和CD8+细胞。
根据TCRαβT细胞的功能可将其分为二类。一类为调节性T细胞,可包括辅助性T细胞(helperT lymphocte,TH)和抑制性T细胞(suppressorT lymphocyte,Ts)。另一类为效应性T细胞(effectorT cell),可包括杀伤性T细胞(eytolytie T cell,CTL,或TC)和迟发型超敏性T细胞(delayed type hypersensitivity Tlymphoctye,TDTH)。
(一)TCRαβT细胞
二类T细胞表型分子均呈CD2+、CD3+阳性,但γδT细胞为CD4-、CD8-双阴性细胞(double negative cell,DN)或CD8+,而αβT细胞其表型为CD4+或CD8+单阳性细胞(single positive cell,SP)。
在末梢血主要为αβT细胞可占95%,而γδT细胞只占1%~10%。αβT细胞为主要参予免疫应答的T细胞,而对γδT细胞功能不十分了解,可能是具有原始受体的第一防线的防御细胞,与抗原感染有关。
(二)CD4+细胞
TCRαβTCD4+细胞(简称为CD4+细胞)的分子表型为CD2+、CD3+、CD4+、CD8-。其TCR识别抗原是MHCⅡ类分子限制性。CD4+T细胞也是不均一的细胞群,按其功能可包括二种T细胞,即辅助性T细胞(TH),和迟发型超敏性T细胞(TDTH)。前者为调节性T细胞,后者为效应性T细胞。
CD4+T细胞能促进B细胞、T细胞和其它免疫细胞的增殖与分化,协调免疫细胞间的相互作用。T细胞在静止状态不产生细胞因子,活化后才能产生。
近年来,根据建立的小鼠TH细胞克隆,分析其产生的细胞因子种类,发现具有不同的调节功能,可将TH细胞分为二类,即TH1和TH2(表8-3)。TH1与细胞免疫及迟发型超敏性炎症形成有关,故亦称为炎症性T细胞,相发于TDTH细胞。TDTH细胞。TH2可辅助B细胞分化为抗体分泌细胞,与体液免疫相关,相当于TH细胞。
表8-3 小鼠TH1及TH2特性
| 特性 |
TH1(炎症性T,Tinf) |
TH2(辅助性T,TH) |
| 功能 |
|
|
| Ig产生 |
+ |
++ |
| B细胞增殖 |
+ |
++ |
| 迟发型超敏性(DTH) |
++ |
- |
| 细胞毒性(CTL) |
++ |
- |
| MФ活化 |
+ |
+ |
| 细胞因子 |
|
|
| IL-2 |
++ |
- |
| IFN-γ |
++ |
- |
| TNF-β |
++ |
- |
| IL-3 |
++ |
++ |
| GM-CSF |
+ |
++ |
| TNF-α |
+ |
++ |
| IL-4 |
- |
++ |
| IL-5 |
- |
++ |
| IL-6 |
- |
++ |
| IL-10 |
- |
++ |
| 细胞因子受体 |
|
|
| IL-1 |
- |
++ |
| IL-2 |
++ |
++ |
| IL-4 |
+ |
++ |
近年一些学者在过敏性疾病的患者及健康人末硝血中也建立了人TH1和TH2克隆,也证实了在人也存在TH1和TH2细胞(表8-4)。这二类细胞是互相制约的,它们的失调与感染性疾病以及自身免疫性疾病相关。
(三)CD8+T细胞
CD8+T细胞也是不均一的细胞群,按其功能可包括抑制性T细胞(TS)和杀伤性T细胞(TC),前者为调节性T细胞,后者为效应性T细胞。
1.TC细胞 杀伤T细胞(TC)其分子表型为CD2+、CD3+、CD4+、CD8+。其TCRαβ只能识别自己MHCⅠ类分子与抗原肽片段结合的复合分子,所以是MHCⅠ类分子限制性。TC细胞主要识别存在于靶细胞表面上的MHCⅠ类分子与抗原结合的复合物,如被病毒感染的靶细胞或癌细胞等。因此,TC效应细胞与抗原病毒免疫、抗肿瘤免疫以及对移植物的移植排斥反应有关。
表8-4 人TH1及TH2特性
| 特性 |
TH1 |
TH2 |
| 细胞因子 |
|
|
| IL-2 |
+ |
± |
| IFN-γ- |
+ |
- |
| IL-4 |
- |
+ |
| IL-5 |
- |
+ |
| 辅助功能 |
|
|
| IgG/IgA/IgM产生 |
+ |
++ |
| IgE产生 |
- |
+ |
| 细胞毒性 |
+ |
- |
| 抗原反应性 |
|
|
| TT.PPD |
+ |
- |
| 变应原 |
- |
+ |
注:TT,破伤风类毒素;PPD:纯化结核菌素
2.Ts细胞 Ts细胞是一类与TH细胞和Tc细胞性质不同的淋巴细胞。Ts细胞是美国学者Gershon于70年代在小鼠体内证明它的存在。他是给小鼠经静脉注射大剂量抗原(羊红细胞)则小鼠呈现不应答状态即耐受状态。如果把这种耐受小鼠的淋巴细胞,注入正常同基因小鼠同素小鼠体内,可抑制其抗体产生。其后证明这种具有抑制作用的淋巴细胞是Thy-1+T细胞,故称这种细胞为Ts细胞。
现已证明,人Ts细胞的分子表型与Tc相同,也是CD2+、CD3+、CD4+、CD8+。它的功能是抑制免疫应答的活化期。Ts细胞的抑制作用是通过它所分泌的抑制因子(TSF)介导的,其作用的靶细胞是抗原特异的TH和或B细胞。
Ts细胞可发挥两种重要作用,首先它对在胸腺内不能形成自身耐受的自身反应性T细胞克隆有抑制作用,同时它对非已抗原透发的免疫应答也有抑制作用。实验证明,Ts细胞功能变化是引起各种免疫功能异常的重要原因之一。
由于对Ts细胞的研究进展缓慢,尚有许多疑问有待解决。这主要是因为尚不能获得较大量的纯化Ts细胞,对建立稳定的Ts细胞克隆以及建立具有特异抑制活性的Ts杂交瘤均未获成功。因此,对Ts细胞的一些基本问题,如Ts细胞抗原识别受体(TCR)的性质及其分泌的抑制因子(TSF)的特性等问题,均有待明确。故目前尚不能描述它们的分子结构及作用方式。
Ts细胞是否是一种独立的T细胞功能亚类,学者间还存在很大争论,今后必需证明它的TCR性质和找出其独特的表面标志,才能解决这一问题。
(四)CD45RA与CD45ROT细胞
近年应用单克隆抗体发现一组新的细胞膜表面分子,命名为CD45分子。它可广泛存在于造血系细胞膜表面,故也称之为白细胞共同抗原(leukocyte common antigen,LCA),分子量约为200KD的糖蛋白分子。根据其胞外区表位的不同已发现有6种异构体分子,在人已鉴定出3种异构体分子,即CD45RA、CD45RB和CD45RO。应用这种异构体分子可将T细胞分为二个新亚群。凡未经抗原刺激的T细胞可称之为原始T细胞(naive tcell,Tn)为CD45RA+T细胞群,而经抗原刺激分化为记忆T细胞(memory T cell,Tm)为CD45RO+细胞群,二群T细胞功能特性不同(表8-5)。
表8-5 Tn与Tm特性
| 特性 |
Tn |
Tm |
| CD45 |
CD45RA |
CD45RO |
| 归巢受休表达 |
高水平 |
低水平 |
| 粘附分子表达 |
低水平 |
高水平 |
| 再循环 |
血流→淋巴组织 |
直接移行至抗原部位 |
| 寿命 |
短(数目) |
长(数月) |
| 再次抗原刺激 |
- |
+++ |
T细胞可随血流及淋巴分布于体内各部位,在正常情况下,T细胞在周围组织中的数目是相对稳定的。如在胸导管淋巴液中可占90%,在脾中约占30%,淋巴节中约占75%,末梢血中可占60%~80%。CD4+和CD8+细胞的比例,在周围各组织中大致相同,即CD4+约占60%,CD8+约占30%。CD8+的比值在正常人约为2,若其比值<1.0或>2.0可视调节细胞(TH/TS)比例异常,与临床一些疾病相关。可应用抗各种表型抗原的单克隆抗体检测全T细胞的数量及其亚类((TH/TS)的比值,常有助于疾病的诊断。
三、T细胞在胸腺内的发育
在一个体内能特异识别各种抗原的T细胞总数称之为T细胞库(T cell repertoire),成熟的T细胞库具有二种基本特性。其一为T细胞识别抗原是MHC限制性的,即每一个体的T细胞只能识别与其自身MHC分子结合的异种抗原分子。另一特性为T细胞库对自己抗原是耐受性的,即每一个体的T细胞不能单独识别自己MHC分子或是与之结合的自己抗原分子,即所谓自身耐受现象。
如果不能维持自身耐受,将导致发生抗自己组织抗原的免疫应答和自身免疫性疾病。所以了解成熟T细胞库是如何发育形成的,不仅对了解T细胞特异性的产生是重要的,而且有助于揭示自身免疫病的致病机制。
胸腺是T细胞发育成熟的主要部位,故称之为中枢免疫器官。胸腺微环境为T细胞发育分化创造了条件。对T细胞发育细胞发育分化的研究主要是在小鼠体内进行的,并由此推论至人类。
(一)胸腺微环境
胸腺微环境主要由胸腺基质细胞(thymic stroma cell,TSC)细胞外基质(extracellular matrix,ECM),和细胞因子等组成。当T祖细胞(pro-T)自胚肝或骨髓进入胸腺后,在胸腺微环境作用下,可诱导其发育分化。在其分化成熟过程中,可先后发生各种分化抗原的表达,各种细胞受体的表达,并通过正和负选择过程,最终形成T细胞库。最后成熟T细胞被迁移出胸腺,并定居于周围淋巴器官,参于淋巴细胞再循环,可分布于全身组织等一系列复杂过程。
1.胸腺基质细胞胸腺基质细胞可包括起源于胸腺胚基内胚层的上皮细胞和来源于骨髓的巨噬细胞、树突状细胞(dendritic cell,DC)、纤维母细胞、网织细胞和肥大细胞等。在基质细胞中以上皮细胞数量最多、分布最广,可分为皮质上皮细胞和髓质上皮细胞。它们在T细胞分化不同阶段都起重要作用,上皮细胞主要与正选择过程相关,而巨噬细胞等则与负选择过程相关。
2.细胞外基质 T细胞在胸腺内的发育是由皮质向髓质移行的过程中完成的。在此过程发育中的T细胞即胸腺细胞需与胸腺基质细胞直接相互接触,或是通过细胞外基质介导二种细胞间接触,因此ECM在T细胞的分化发育中也起重要作用。现已确定的细胞外基质有胶原蛋白(collegen),网状纤维、葡糖胺以及一些糖蛋白如纤维粘连素(fibronectin,FN),层粘连蛋白(laminin,LN)等。
3.细胞因子胸腺细胞和胸腺基质细胞都能分泌细胞因子,并都有一些细胞因子受体,可相互调节胸腺细胞与胸腺基质细胞的分化发育和维持胸腺微环境的稳定(表8-6)。
表8-6 胸腺细胞和上皮细胞产生的细胞因子及受体
|
|
|
细胞因子 |
细胞因子受体 |
|
胸腺细胞 |
上皮细胞 |
胸腺细胞 |
上皮细胞 |
| IL-1 |
+ |
+ |
+ |
+ |
| IL-2 |
+ |
- |
+ |
+ |
| IL-3 |
+ |
+ |
- |
- |
| IL-4 |
+ |
- |
+ |
+ |
| IL-6 |
+ |
+ |
+ |
+ |
| IL-7 |
+ |
+ |
+ |
+ |
| IL-8 |
- |
+ |
- |
- |
| IFNγ |
+ |
- |
+ |
+ |
| IFNα |
+ |
+ |
+ |
+ |
| TGFα |
- |
- |
- |
+ |
| GM-CSF |
- |
+ |
- |
- |
| M-CSF |
- |
+ |
- |
- |
| G-CSF |
- |
+ |
- |
- |
(二)T细胞在胸腺内的发育过程
通过对小鼠T细胞发育的研究表明,当来自胚肝或骨髓的T祖细胞(pro-t)进入胸腺后,可经历不同的发育阶段,其TCRαβ、CD3以及协同受体CD4和CD8等分子的表达水平不同,是受高度调节的发育过程。
实验证明,小鼠T细胞在胸腺内的分化发育可分为三个阶段:即早期T发育为双阴性细胞阶段,其主要表型为CD4-和CD8-,故称为双阴性细胞(DN)。第二阶段为不成熟胸腺细胞,即由DN细胞经单阳性细胞(CD4-、CD8+、)进而分化为双阳性(CD4+、CD8+、)细胞(doublepositive,DP)。第三阶段为由DP细胞经正、负选择过程,分化发育为具有免疫功能的成熟T细胞,只表达CD4+或CD8+,故称为单阳性细胞(single positive,SP),然后迁出胸腺,移居于周围淋巴器官。
上述四群细胞都是不均一的群体,而且由一个分化阶段发育为另一阶段还有许多移行型细胞,因此对T细胞发育的了解尚有许多问题需待进一步深入研究。
1.早期T细胞发育阶段由胚或骨髓干细胞衍生的T细胞进入胸腺后经前T细胞(pre-T)发育为双阴性细胞,这一过程可视为早期T细胞发育阶段。
Pro-T细胞(表型为CD410、CD3-、CD8+、CD25-、C-kit+、Lin-、TCRαβ-)通过其表面粘附分子与胸腺毛细胞血管内皮细胞上的配体分子结合,并在上皮细胞分泌的多种趋化因子作用下,穿过血胸屏障进入胸腺。在皮质区进行增殖和分化,经Pre-T(表型为CD3-、CD4-、CD8-、CD25-、C-kit10,其TCRβ及γ基因发生重排及转录)进一步发育为DN细胞(其表型为CD3+、CD4-、CD8-、CD25-、TCRαβ-),但其TCRβ-βCD3可表达于细胞表面,与基质细胞配基结合后,经p56lek传导信号,诱导CD4/CD8分子表达及TCRβ基因发生等位排斥。由此使T细胞发育进入DP阶段,并发生胸腺内的选择过程,最终发育为单阳性(SP)的成熟T细胞库。
2.胸腺选择过程 主要发生于DP阶段,此时TCRαβ基因重排、转录及表达,形成TCRαβ-CD3复合分子,并具有识别配基(自已MHC分子+自己抗原分子)的功能。DP细胞与不同胸腺基质细胞(TSC)相互作用,可导致不同的结果。
胸腺细胞经选择作用后,能存活或被排除,基于它们TCRαβ的特异性,决定于TCR与MHC分子的结合和在胸腺内表达的抗原分子。阳性选择过程可使能自己MHC分子限制性的T细胞克隆增殖,产生功能性成熟T细胞;而阴性选择过程,可使对自己抗原反应性T细胞克隆被排除或不应答,形成自身免疫耐受(表8-7,图8-3)。这是二个顺序过程,提示阳性选择可能发生在阴性选择之前。
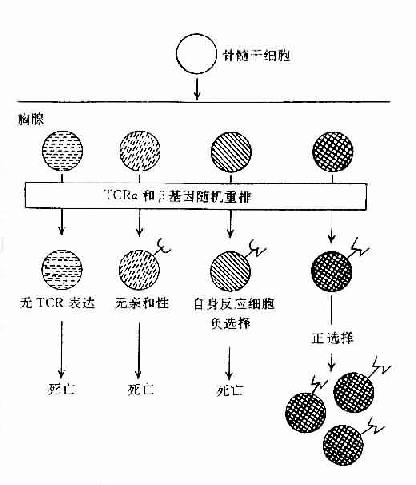
图8-3胸腺内TCR特异选择
1)阳性选择(positiveselection,PS):主要发生在DP细胞与皮质型上皮细胞之间的相互作用。凡TCR与自已MHc 分子有亲和性的胸腺细胞可与之结合并导致克隆增殖,而无亲和性的胸腺细胞将导致死亡。在此过程中大部分DP细胞死亡,只有小部分DP细胞存活并增殖。此过程可排除所有非已MHC限制性T细胞克隆,保存自己MHC限制性T细胞克隆和潜在的有害的自身反应性T细胞克隆。此过程可使DP细胞分化为SP细胞。
2)阴性选择(negativeselection,NS):主要发生于DP细胞与胸腺内巨噬细胞(MФ),树突状细胞(DC)或髓质上皮细胞间的相互作用。胸腺细胞TCR与存在于上述细胞上自己抗原与自己MHC复合物有高亲和性者结合,可导致自身反应性T细胞克隆死亡并被排除,称之为克隆排除(clonal deletion)或克隆存在但受抑制不能活化,称之为克隆不应答(clonal anergy)。现已证明克隆排除与细胞程序性死亡(PCDD)相关,克隆不应答与缺乏活化信号相关,称这种耐受为中枢耐受。但不在胸腺表达的自己抗原,其自身的反应性T细胞仍能发育成熟,并漏出周围淋巴组织,可能由Ts细胞抑制其活性,导致周围自身耐受,所以自身耐受的形成是由多种机制完成的。经胸腺阴性选择作用后,排除了自身反应性T细胞克隆,只有识别非已抗原与自已MHC分子结合的T细胞克隆存活,并由DP细胞分化为具有功能的单阳生(SP)细胞(CD4+或CD8+T细胞)。所以成熟T细胞库表现为自己MHC限制性和自己耐受二种特征。
表8-7 胸腺内阳性/阴性选择
| 胸腺外组织(胚肝,骨髓) |
T祖细胞(progenitor-T,Pro-T) |
| 胸腺皮质 |
↓ CD4-CD8-(DN) ↓ CD4+CD8+(DP) ↓ 阳性选择 获得自己MHC限制性 CD4+ CD8+(SP) (自身反应与非自身反应性克隆) |
| 胸腺髓质 |
阴性选择↓排除自反性克隆或不应答(自己耐受) CD4+ CD8+ (MHCⅡ限制TH) (MHCⅠ限制性TC) |
| 周围淋巴组织 |
CD4+ CD8+ (TCRαβ) (TCRαβ) |
第二节 B细胞
B细胞首先证明是在鸟类淋巴样器官法氏囊内发育成熟的,故称之为B细胞。哺乳类动物B细胞,在胚胎早期系在胚肝,晚期至出生后则在骨髓内分化成熟。成熟B细胞可定居于周围淋巴组织,如淋巴结的皮质区和脾的红髓及白髓的淋巴小结内。
B细胞是体内唯一能产生抗体(免疫球蛋白分子)的细胞。体内含有识别抗原特异性不同的抗体分子,其多样性是来自千百万种不同B细胞克隆。每一B细胞克隆的特性是由其遗传性决定的,可产生一种能与相应抗原特异结合的免疫球蛋白分子。外周血中,B细胞约占淋巴细胞总数的10%~15%。
一、B细胞膜主要表面分子
(一)B细胞抗原识别受体(BCR)
BCR与TCR一样,也是由复合分子组成。即由特异识别抗原的分子信号传导分子组成的BCR复合分子(图8-4)。BCR识别抗原分子早已证明是由B细胞表面免疫球蛋白分子(surface immunoglobulin,sig)组成,它是由二条相同的重链(H)和二条相同的轻链(L)构成的4肽链分子。sIg均为单体结构,在正常人外周血中多数B细胞可同时表达sIgM和sIgD,少数B细胞只表达sIgG、sIgA或sIgE。sIg是鉴别B细胞的主要特征,可用荧光素标记的抗Ig抗体检测B细胞。
近年的研究证明BCR还存在另一组分子,是由二硫键连接的异二聚分子组成,称之为sIgα和Ig-β链(分别命名为CD79a和CD79b)。它们的分子结构相关,是由Ig超家族基因mb-1和B29分别编码的糖蛋白分子,它们的功能与信号传导有关,与TCR中CD3分子的作用相似。
BCR能识别可溶性蛋白抗原分子,它识别的表位是构像决定簇,这一特性与TCR明显不同(表8-8)。B细胞经BCR对抗原的摄取、加工和呈递作用,通过信号传导可引起胞浆内一系列生化变化及核内基因的活化、增殖、分化、不应答或诱导细胞程序性死亡。
表8-8 BCR与TCR识别抗原的比较
| · BCR-Igα、Igβ · 配体-受体相互作用,抗原-BCR · 直接结合游离抗原 · 可与任何蛋白质抗原发生应答 · 识别的抗原表位空间构型决定簇15AA |
TCAR-CD3 三分子复合物、抗原-MHC-TCR 不能与游离抗原结合 只能与MHC·肽应答 识别的抗原表位降解的线性肽片段8~12AA |
(二)Fc受体
许多免疫细胞表面都有Fc受体,它是结合免疫球蛋白Fc段的分子结构。结合不同类别Ig的Fc受体,其性质各异,细胞上FcR的类型和数目也是不固定的。
大多数B细胞表面具有IgGFe受体Ⅱ(FerR),能与IgGFe段结合。活化B细胞此受体密度明显增高,分化至晚期又下降。FerR可与免疫复合物结合,有利于B细胞对抗原的捕获和结合,以及B细胞的活化和抗体产生。如将鸡红细胞(E)与其IgG抗体(A)结合形成的复合物与B细胞混合后,可见B细胞周围有红细胞粘附形成的花环,称为EA花环,也是检测B细胞的一种方法。
近年发现在活化B细胞表面可具有IgEFe受体(FerRⅡ)即CD23分子,它是一种B细胞生长因子受体,可能与B细胞分化增殖有重要作用。
(三)补体受体(CR)
大多数B细胞表面有能与C3b和C3d结合的受体,分别称为CRⅠ和CRⅡ(即CD35和CD21)。CRⅠ主要见于成熟B细胞,活化B细胞其密度明显增高,但进入分化晚期又下降。CR可与抗原和抗体及补体形成的免疫复合物结合,促进B细胞的活化,CRⅡ也是EB病毒的受体。
(四)细胞因子受体(CKR)
活化B细胞可表达多种细胞因子体,如IL-1、IL-2、IL-4、IL-5以及IFN-γ等受体,与相应因子结合可促进B细胞的增殖和分化。
(五)丝裂原受体
B细胞表面的丝裂原受体与T细胞不同,因此刺激B细胞转化的丝裂原也不同。如用美洲商陆(PWM),或脂多糖与外周血淋巴组织共同培养时,B细胞相应受体可与之结合而被激活,并进行增殖分化为淋巴母细胞,称为B细胞有丝分裂原反应,也称淋巴细胞转化试验,可用于对B细胞的功能检测。
(六)主要组织相容性抗原(MHC)
B细胞发育未成熟时,已表达MHCⅡ类分子,活化B细胞MHCⅡ类分子表达明显增多。MHCⅡ类分子能增强B和T细胞间的粘附作用,同时也是呈递抗原的分子。MHCⅡ类分子交联与信号传导有关,可促进B细胞活化。近年证明超抗原可与MHCⅡ类分子有高亲和性,亦与促进B细胞的活化有关。
(七)B细胞分化抗原(CD分子)
近年来应用单克隆抗体鉴定出存在于B细胞表面的特有抗原分子,而不存在于其它免疫细胞上。这些抗原可表达于B细胞发育分化的不同阶段,故称为分化抗原,对B细胞的分化和鉴定具有重要意义。
通过对CD分子的结构与功能研究,表明这些分子不仅是B细胞的特异表面标志,而且具有重要的生理功能。实验证明B细胞的活化,除了由BCR与其相应抗原结合后提供活化的起始信号外,还需由其表面的辅助分子与其相应配体分子结合后,提供的协同刺激信号,才能使B细胞处于活化状态,即B细胞的活化与T细胞一样,也是由双信号介导的。
目前已发现有一系列辅助分子参与这一过程,它们是CD19、CD21、CD20、CD22、CD40及CD45等分子。这些分子对B细胞的活化、增殖、分化或耐受体形成都具有重要作用(表8-9)。
表8-9 参与B细胞信号传导的主要CD分子
| CD |
分子量(KD) |
化学性质 |
表达细胞 |
功能 |
| CD19 |
95 |
糖蛋白 |
前B细胞 成熟B细胞 |
B活化调节 发育调节 |
| CD20 |
35 |
糖蛋白 |
前B细胞 成熟B细胞 |
活化、增殖、分化 |
| CD21 |
145 |
糖蛋白 |
成熟B细胞 |
B活化调节 B发育调节 |
| CD22 |
135 |
糖蛋白 |
成熟B细胞 |
B活化调节 |
| CD40 |
|
|
活化B细胞 |
B细胞增殖、分化调节 |
| CD45 |
180~220 |
糖蛋白 |
成熟B细胞 |
B细胞活化调节 |
二、B细胞亚类
(一)CD54+B细胞的生物学特性
根据B细胞表型的不同,目前可将B细胞分为二个亚类。最初认为Ly-1(CD5)抗原是小鼠T细胞的表面标志,但以后发现在一部分B细胞群中其面也可表达Ly-1抗原,即Ly-1+(CD5+)B细胞,称这种细胞群为B1细胞。而另一亚类B细胞,其表型则为即Ly-1-(CD5-)B细胞,即通常B细胞,称之为B2细胞。在人也证明存在与小鼠相当的B细胞亚类,即CD5+(Leu-1+)B细胞(B1)和(CD5-(Lun-1+)B细胞(B2)二个亚类。
B1细胞群和B2细胞群无论在起源、表型和生物学特性等方面均有所不同。近年根据表型的不同可将B1细胞群进一步分为Bia和Blb。B细胞亚类表型见表8-10。
表8-10 B细胞亚类表型
| 膜标志 |
B1 |
B2(通常B细胞) |
| B1a |
B1b |
| LgM |
+++ |
+++ |
+ |
| LgD |
± |
± |
+++ |
| CD5 |
+ |
- |
- |
| CD11 |
+ |
+ |
- |
| CD23 |
- |
- |
+ |
| CD44 |
+ |
+ |
- |
| MHCⅡ |
+++ |
+++ |
+++ |
CD5+B细胞比通常B细胞(CD5-)出现早。新生期小鼠脾细胞及腹腔中CD5+B细胞约占30%,随着鼠龄的增长而减少。成年鼠腹腔CD5+B细胞约占20%~40%,脾只占1%~2%,而在末梢血、淋巴结及骨髓内未发现,故正常小鼠CD5+B细胞主要存在于腹腔中。人胎脾细胞CD5+B细胞可占90%,但随年龄增长而减少。
CD5+B细胞与通常B细胞可能存在不同分化途径,其前驱细胞骨髓内不存在,胎儿期可能由大网膜内前驱细胞产生。分化后前驱细胞供给停止,但其自身有再生能力,藉以维持其细胞库。
CD5+B细胞与通常B细胞其表面标志也不同,CD5+B与通常B细胞比较,CD45R抗原呈弱阳性,sIgM强阳性,sIgd弱阳性。腹腔CD5+B其Mac-1+、CD23+为特征而通常B细胞为Mac-1+、CD23-。
通常B细胞(CD5-)一般受外来抗原刺激,经活化、克隆扩增,发生体细胞突变,产生高亲和性特异性抗体。而CD5+B细胞对外源抗原只产生有限的应答,主要对一些自已抗原产生应答,其应答特征是不依赖T细胞的,其产生的抗体也无亲和性成熟。故CD5+B细胞产生的抗体为低亲和性和多反应性的IgM型自身抗体及一些天然抗体(表8-11)。
表8-11 小鼠B细胞亚类比较
|
CD5+(Ly-1)B |
CD5-B(通常B细胞) |
| 发生 |
早 |
晚 |
| 发育部位 |
腹腔/胸腔 |
淋巴器官 |
| 成体细胞群 |
自我再生 |
不断新生 |
| 成体细胞来源 |
成熟Ly-IB(腹腔) |
Ig-祖细胞(骨髓、肝) |
| 发育调节 |
成熟Ly-IB反馈抑制 |
? |
| 形态 |
大 |
小 |
| 抗体产生 |
|
|
| IgM自身抗体 |
+++ |
? |
| IgM抗菌抗体 |
+++ |
+~+++ |
| 抗半抗原 |
? |
+++ |
| TD抗原 |
- |
++ |
| 亲和力成熟 |
- |
+ |
(二)CD5+细胞的作用
通常B细胞来自集合淋巴结(peyer'spatches,PP)抗原刺激后,可再回归肠产生高亲和性特异性抗体。而存在于固有层的CD5+B细胞,可接受肠道内抗原刺激,产生多价低亲和性抗体,以防御外来微生物的入侵。故肠道内可有二类B细胞发挥抗感染免疫作用。
CD5+B细胞是IgM型自身抗体的主要产生细胞,它可能形成自身反应细胞库,与自身免疫病的发生有关。已发现天然自身免疫病NZB小鼠体内CD5+B细胞比率高并与自身抗体产生相关。用xid基因导入NZB小鼠,则CD5+B细胞消失,自身抗体也下降。在人慢性风湿性关节炎、Sjogren症候群,以及全身性硬皮病等患者末梢血中,CD5+B细胞比正常人明显增加,而且在关节液中发现CD5+B细胞也增多。上述发现提示CD5+B细胞与自身免疫病的发生相关,但在系统性红斑狼疮患者中未发现CD5+B细胞增加现象,所以CD5+B细胞是否与各种自身免疫病相关,尚有待进一步研究。
三、B细胞的发育
鸟类的法氏囊是B细胞分化的场所。哺乳类动物在胚胎早期,B细胞分化的最早部位是卵黄囊,此后在脾和骨髓,出生后则在骨髓内分化成熟。
B细胞分化过程可分为二个阶段,即抗原非依赖期和抗原依赖期。在抗原非依赖期,B细胞分化与抗原刺激无关,主要在中枢免疫器官内进行。而抗原依赖期是指成熟B细胞受抗原刺激后,可继续分化为合成和分泌抗体的浆细胞阶段,主要在周围免疫器官内进行。
(一)骨髓微环境
早期B细胞的增殖与分化,其发生是与骨髓造血微环境(hemopoietic inductive microenviroment,HIM)密切相关。HIM是由造血细胞以外的基质细胞(stroma cell)及其分泌的细胞因子和细胞外基质(extracellular matrix,ECM)组成。基质细胞可包括巨噬细胞、血管内皮细胞、纤维母细胞、前脂肪细胞、脂肪细胞等。由间质细胞分泌的纤粘连蛋白、胶原蛋白及层粘连蛋白等形成细胞外基质,此外还可合成和分泌众多的细胞因子。HIM的作用主要是通过细胞因子可调节造血细胞的增殖与分化,通过粘附分子可使造血细胞与间质细胞相互直接接触,有利于造血细胞的定位和成熟细胞的迁出(表8-12,图8-5)。
表8-12 骨髓微环境与造血干细胞的相互作用
| 基质细胞 |
相互作用的媒介分子 细胞外基质 |
细胞因子 |
| 纤维母细胞 |
纤粘连蛋白 |
SCF |
| 巨噬细胞 |
层粘连蛋白 |
G-CSF |
| 内皮细胞 |
胶原蛋白等 |
M-CSF |
| 前脂肪细胞 |
|
GM-CSF |
| 脂肪细胞 |
|
IL-4 |
|
|
IL-6 |
|
|
IL-7 |
|
|
TGF-β |
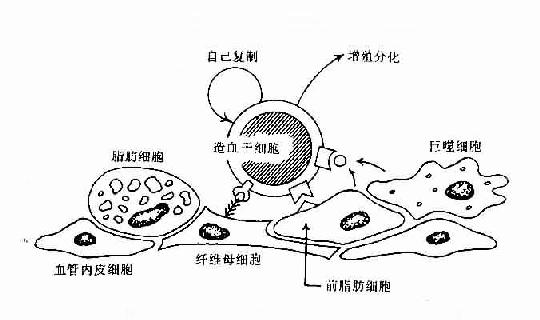
图8-5 骨髓基质细胞与造血干细胞相互作用示意图
(二)B细胞在骨髓内的发育
B细胞与其它血细胞一样,也是由骨髓内多能干细胞分化而来。过去曾认为T和B细胞可能来自共同的淋巴样干细胞,但迄今对基分化途径、分化部位以及其特异的表面标志尚未明确,有待进一步研究。
已证明,B细胞在骨髓内的发育,可经过祖B细胞(pro-B)、前B细胞(pre-B)、不成熟B细胞(immatureB)及成熟B细胞(mature)几个阶段。成熟B细胞释放至周围淋巴组织,构成B细胞库,在此阶段经抗原刺激后,可继续分化为合成和分汔抗体的浆细胞,即抗原依赖的分化阶段。
B细胞在骨髓内分化各阶段的主要变化为免疫球蛋白基因的重排和膜表面标志的表达。B细胞在发育分化过程中,同样也经历选择作用,以除去非功能性基因重排B细胞和自身反应性B细胞,形成周围成熟的B细胞库(表8-13,图8-13)。
表8-13 B细胞分化特征
|
Pro-B |
Pre-B |
不成熟B |
成熟B |
PC |
| 抗原依赖 |
- |
- |
+ |
+ |
- |
| 基质细胞依赖(配体?) |
+ |
+ |
- |
- |
- |
| H链V基质重排 |
- |
DJ→VDJ |
VDJ |
VDJ |
- |
| H链蛋白 |
μ- |
μ+ |
μ+ |
μ+δ+ |
+ |
| L链蛋白 |
k-λ- |
k-λ- |
K+或λ+ |
K+或λ+ |
+ |
| Vpre-B/γ5蛋白 |
+ |
+ |
± |
+ |
- |
| SIgM |
- |
- |
+ |
+ |
- |
| SIgD |
- |
- |
- |
+ |
- |
| thy-1 |
+ |
- |
- |
- |
- |
| B220 |
+ |
+ |
+ |
+ |
- |
| Tdt |
+ |
- |
- |
- |
- |
| mb-1(CD79a) |
+ |
+ |
+ |
+ |
- |
| B29(CD79b) |
- |
+ |
+ |
+ |
- |
| CD19 |
+ |
+ |
+ |
+ |
- |
| CD21 |
- |
+ |
+ |
+ |
- |
| PCA-1 |
- |
- |
- |
- |
+ |
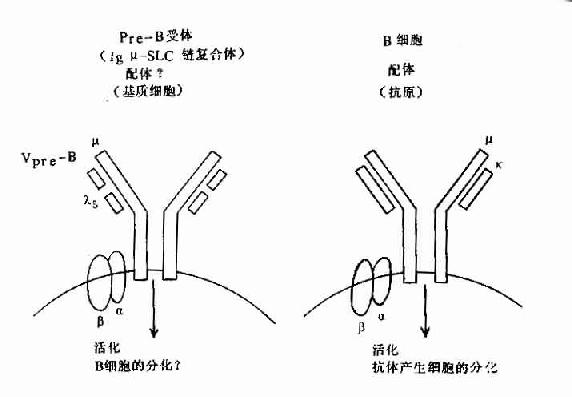
图8-6 pre-B受体(μ-SLC)与B细胞抗原受体机能
1.祖B细胞 这种发育早期的B细胞,发生在人胚胎约第9周开始,小鼠约第14天开始。尚未表达B细胞系的特异表面标志,也未发生lg基因重排,仍处于胚系基因(germline)阶段。但祖B细胞的晚期可出现B系特异标志,Thy-1+、Tdt+、B200+、mb-1+等分子。
2.前B细胞 是由祖B细胞分化而来,约占成人骨髓有核细胞的5%。前B细胞能检出的最早标志是lg重链基因重排,随后在胞浆中可检测出IgM的重链分子,即μ链。但无轻链基因重排,因此也无膜Ig表达。
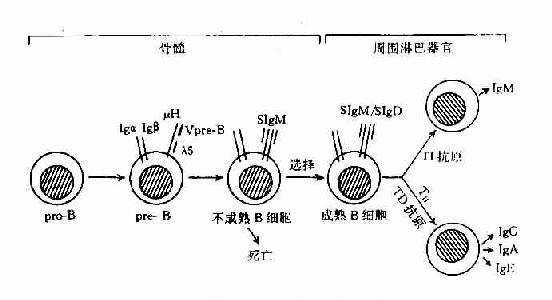
图8-7 B细胞分化膜式图
但近年在小鼠前B细胞株中,克隆出二个前B细胞特有的基因,并与Cγ与Vγ同源,分别命名为λ5和Vpre-B基因,在人也证明前B细胞中存在此种基因。它们编码的蛋白Vpre-B和λ5可非共价结合,形成伪轻链(pseudo L chain,Фl)或替代轻链(surrogate L chain)。此伪L链可与μ链结合形成μ重链与伪L链复合体,并表达于前B细胞膜上构成其受体,与信号传导有关,对前B细胞的进一步分化具有重要作用。
此阶段还表达MHCⅡ、Tdt、CD19、CD10、CD20和CD24等分化抗原。其中CD19、CD20、和CD22在胞浆中的出现均早于μ链。前B细胞对抗原无应答能力,不表现免疫功能。
3.不成熟B细胞 此阶段发生L链基因重排,故可组成完整的IgM分子,并表达于膜表面(IgM),可称为Bμ细胞。此种细胞如与抗原结合,易使膜受体交联,产生负信号,使B细胞处于受抑状态,不能继续分化为成熟B细胞。这种作用可能是使自身反应B细胞克隆发生流产,是形成B细胞自身耐受的机制之一。
不成熟B细胞开始丧失Tdt和CD10,但可表达CD22、CD21及FcR。同时CD19、CD20以及MHCⅡ类分子表达量增加。
4.成熟B细胞 随着B细胞的进一步分化,可发育为成熟B细胞,并离开骨髓进入周围免疫器官。此时膜表面可同时表达sIgM和sIgD,但其V区相同,而C区不同,故其识别抗原特异性是相同的。成熟B细胞可发生于一系列膜分子变化,可表达其它多种膜标志分子,如丝裂原受体、补体受体、Fc受体、细胞因子受体,病毒受体以及一些其它分化抗原等。
5.浆细胞(PC) 成熟B细胞可在周围淋巴器巴接受抗原刺激,在TH细胞及抗原呈递细胞的协助下,及其产生的细胞因子作用下可使B细胞活化,增殖并分化为合成和分泌抗体的浆细胞。此阶段B细胞可逐渐丢失一些膜分子如CD19和CD22等。并可发生Ig的类别转换,从产生IgM转换为产生Igg 、IgA或IgE的B细胞。
在此期分化过程中,有部分B细胞可恢复为小淋巴细胞,并停止增殖和分化,SIgD可消失,且寿命长,可生存数月至数年。当再次与同抗原相接触时易于活化和分化,故称此种细胞记忆B细胞,与机体的再次免疫应答相关。
当成熟B细胞分化为浆细胞时,B细胞表面的部分标志消失,并出现一些新的浆细胞特有标志,如浆细胞抗原-1(PCA-1)等分子。一种浆细胞只能产生一种类别的Ig分子,并且丧失产生其它类别的能力。浆细胞寿命长较短,其生存期仅数日,随后即死亡。
第三节 第三群淋巴细胞
在淋巴细胞中,除T和B细胞外,还发现一群没有T和B细胞表面标志的淋巴样细胞。一些学者认为它们可能是与T和B细胞并列的第三群淋巴细胞。目前认为它们是来源于其它细胞系,有待深入研究后才能确定其归属。
一、自然杀伤细胞(NK细胞)
1.NK细胞的特性 NK细胞来源于骨髓,主要存在于血液和淋巴样组织,特别是存于脾中。由于其胞浆中含有颗粒故有称为大颗粒淋巴细胞(large granular lymphocyte,LCL)。
从系统发生看,NK细胞被认为是原始杀伤T细胞,但它没有抗原识别受体,能杀伤肿瘤细胞和病毒感染细胞,所以是非特异杀伤作用,但无MHC分子的限制性,故名自然伤细胞。
虽然NK细胞对靶细胞的作用范围远大于杀伤T细胞,但其杀伤作用也不是随机的而是有一定范围的。NK细胞可以杀伤某些病毒感染细胞,但对正常未感染细胞无杀伤作用。NK细胞可杀伤某些肿瘤细胞株,特别是对造血细胞来源的肿瘤细胞更为敏感,但不是对所有肿瘤细胞均有作用。
2.NK细胞的表面标志 从细胞表型来看,NK细胞既不是T细胞也不是B细胞。NK细胞没有Ig或TCR基因重排,也不表达CD3分子。但NK细胞可表达CD2分子和低亲和性的IgGFc受体FcRⅢ(CD16)。如使CD2或CD16交联可促使NK细胞增殖和分泌细胞因子。值得注意的是尽管NK细胞缺乏CD3分子,但它能表达CD3的同二聚体ζ链分子,并与CD16联在一起。当IgG与CD16结合后它在信号传递中也发挥重要作用。
3.NK细胞的杀伤作用 当IgG与靶细胞结合并与NK细胞的CD16结合时即可引起NK细胞对靶细胞的杀伤作用,称这种作用为抗体依赖的细胞介导的细胞毒性作用(ADCC)。NK细胞是ADCC的重要介导细胞。但NK细胞识别敏感靶细胞上的分子尚未明确。
NK细胞可合成和分泌THF,但无LT。在一定条件下也可合成和分泌IFN-γ可活化巨噬细胞,能杀伤感染的病原微生物。
二、淋巴因子活化的杀伤细胞
近年来有些学者应用分离正常人或小鼠淋巴细胞加入白细胞介素-2(IL-2)在体外培养使之活化增殖,发现这种经IL-2活化增殖的淋巴细胞在体外能杀伤自体和异体新鲜肿瘤细胞,但对自体和异体外周血淋巴细胞无杀伤作用,称这种细胞为淋巴因子活化的杀伤细胞(lymphokine activated killercells,LAK)。并证明了LAK细胞与NK细胞和Tc(TCL)不是同一的细胞群。LAK细胞对肿瘤的治疗具有重要意义。
LAK细胞的前体细胞也属于大颗粒淋巴细胞(LGL),但不是NK细胞和T细胞。LAK的前体细胞有仅存在于人外周血中,也存在于人的骨髓和胸导管中,表明其分布较为广泛。对这种前体细胞的特性和起源有待深入研究。
三、肿瘤浸润淋巴细胞
近来美国学者Rosenberg应用在和和动物肿瘤组织中分离出的淋巴细胞加入IL-2在体外培养。实验证明这种活化增殖的肿瘤浸润淋巴细胞(tumor infiltuating lymphocyte,TIL)具有比LAK细胞更强的杀伤瘤细胞的作用。LAK细胞具有广谱杀瘤作用,而TIL细胞有特异杀瘤作用。TIL前体细胞为Lyt-2+,与杀伤T细胞的表面标记相同。TIL细胞对肿瘤的过继免疫治疗更具有应用前景。