免疫耐受(immunologic tolerance)是指免疫活性细胞接触抗原性物质时所表现的一种异性的无应答状态(a state of specific unresponsiveness)。它是免疫应答的另一种重要类型,其表现与前述的正相免疫应答相反,亦与各种非特性的免疫抑制不同,后者无抗原特异性,对各种抗原均呈无应答或低应答(表13-1)。
按照免疫耐受形成的特点,可分为天然与获得两种。
免疫耐受既可天然获得,亦可人工诱导。前者称天然耐受(naturaltolerance),后者称获得耐受(acpuiredtolerance)。外来的或自身的抗原均可诱导免疫耐受,这些抗原称耐受原(tolerangen)。针对自身抗原呈现的免疫耐受(self tolerance)。
按照免疫耐受的程度,又可分为完全耐受和不完全耐受。后者又有多种形式。如仅对T细胞或B细胞产生的耐受分别称T细胞耐受或B细胞耐受。又如免疫活性细胞仅对抗原分子上的某一特定决定簇产生耐受而不涉及对其它决定簇的应答,这些现象称为分离耐受(splittolerance)。不完全耐受尚可表现为抗体分泌细胞在再次受抗原刺激后,产生低亲和力抗体或缺失抗体类别转换,是为免疫偏离(immune deviation)。
表13-1 免疫耐受与免疫抑制的比较
|
免疫耐受 |
免疫抑制 |
| 原因 |
细胞系消失或不活化,Ts细胞的抑制作用 |
免疫活性细胞发育缺损或增殖分化障碍 |
| 产生条件 |
可先天或后天获得,特别是在免疫功能未成熟或减弱时容易形成 |
先天缺损,或人为产生,如X-射线、免疫抑制药物、抗淋巴细胞血清作用 |
| 特异性 |
高 |
无 |
| 持续性 |
长期的,一时性的或终生 |
一时性 |
| 临床应用 |
实验治疗阶段 |
已应用于变态反应,自身免疫病和移植 |
| 合并症 |
无 |
感染与肿瘤 |
第一节 免疫耐受现象的发现
一、天然耐受现象
1945年Owen观察到异卵双生小牛胎盘血管融合,血液交流而呈自然的联体共生,可在一头小牛的血液中同时存在有两种不同血型抗原的红细胞,成为血型镶嵌体(chimeras)。这种小牛不但允许抗原不同的血细胞在体内长期存在,不产生相应抗体,而且还能接受双胞胎另一小牛的皮肤移植而不产生排斥反应。但是不能接受其他无关个体的皮肤移植。Owen称这一现象为天然耐受。Burnet等人认为异卵双生牛体内,对异型血细胞的耐受现象的产生是由于胚胎期免疫功能尚未成熟,异型血细胞进入胚胎牛体内,能引起对异型细胞产生抗体的免疫细胞克隆受抑制或被消灭,故此小牛出生后对胚胎期接触过的异型红细胞抗原不会发生免疫应答。根据这个理论,不少人进行了诱导实验性耐受工作。
二、实验诱导的耐受性
1953后Medawar等将CBA系黑鼠的淋巴细胞接种入A系白鼠的胚胎内,待A系白鼠出生8周后,将CBA黑鼠的皮肤植至该A系白鼠体上,可存活不被排斥。这一实验证实了胚胎期接触抗原物质,出生后对该抗原就有特异的免疫耐受现象。这一发现使人们对于耐受机制的认识有了重大的突破,提示胚胎期接触抗原将导致耐受。其后又证明在成年动物也可引起免疫耐受性,但较胚胎期困难的多。
第二节 影响免疫耐受形成的因素
抗原性物质进入机体后,有时导致正相免疫应答,有时导致免疫耐受或负相免疫应答。这两种不同免疫应答的出现,取决于诸多因素的影响,而主要与抗原物质及机体两方面的因素有关。
一、抗原方面的因素
(一)抗原的性质
耐受原仅是一个功能性定义,有许多因素可影响某抗原使之成为免疫原或耐受原。例如牛或人的丙种球蛋白(BGG、HGG)呈大分子聚合状态时具免疫原性,而分子较小的非聚合单体则是良好的耐受原。给动物注射这种耐受原后,对以后再注入的聚合丙种球蛋白表现为无应答。一般来说分子量小的抗原其免疫原性差,导致耐受能力强,并随分子量大小而递减或递增。例如多聚鞭毛素(分子量104KD)、单体鞭毛素(分子量40KD)及由单体鞭毛素提取的成分A(分子量18kD)三者的免疫原性依次递减,而致耐受原性则依次递增。
此外,可溶性抗原常为致耐原,而颗粒性抗原则易于引起正相免疫应答。易被吞噬细胞迅速摄取的抗原常诱发免疫应答,而缓慢或不易被吞噬细胞摄取的抗原则多为致耐原。抗原表位密度高,即抗原分子表面具有许多相同重复的抗原决定簇者,其致耐原强。
(二)抗原的剂量
足以诱导耐受的抗原剂量随抗原种类、动物的种属、品系及年龄、且参与效应细胞类型等的不同而有所差异。一般来说,抗原剂量越大所诱导的耐受越完全和持久。
Mitchison在1964年首先报告高、低带耐受性(high-zone,low-xone tolerance)现象。当他给小鼠注射低剂量(10-8M)与高剂量(10-5M)牛血清白蛋白(BSA)后,动物出现耐受。而中等剂量(10-7M)BSA引起良好的免疫应答。
T、B细胞产生耐受所需抗原剂量明显不同。T细胞所需抗原量较B细胞要小100-10000倍,而且发生快(24小时内达高峰),持续长(数月)。而B细胞形成耐受不但需要抗原量大,且发生缓慢(1-2周),持续时间短(数周)(表13-2)。
表13-2 低带与高带耐受主要特征比较
|
低带耐受 |
高带耐受 |
| 参与细胞 |
T细胞 |
T、B细胞 |
| 产生速度 |
快 |
慢 |
| 持续时间 |
长 |
短 |
| 抗原 |
TD |
任何抗原 |
Waigle研究指出,小剂量抗原引起T细胞耐受,而大剂量抗原则引起T细胞和B细胞都耐受。
致耐受所需抗原量与个体的年龄有关,即随年龄相应增大。与抗原的类别亦有关,即强免疫原性抗原大量注入时能引起耐受,继续注入大量抗原使耐受性增强;胸腺非依赖抗原高剂量易致耐受,胸腺依赖抗原用高、低剂量均可引起耐受。
(三)抗原注射途径
一般来说,抗原经静脉注射最易诱导耐受性,腹腔注射次之,皮下及肌肉注射最难。但不同的部位静脉注射引起后果可各异。HGG经颈静脉注入引起免疫,肠系膜静脉注入引起耐受;IgG或白蛋白注入静脉能致耐受,注入周围静脉则引起免疫应答。有些半抗原经皮内注射能诱导抗体生成及迟发型变态反应,但通过口服则发生耐受性。
通过肠系膜及门静脉注射易于致耐受的原因可能是由于肝起着生物学过滤的作用,将抗原解聚,聚合抗原被肝内枯否细胞吞噬降解,从而除去了免疫原性强的抗原部分,剩下非聚合抗原进入外周血流或淋巴道。
二、机体因素
(一)年龄因素
年龄与耐受易感程度密切相关。Owen与Billingham等人的资料表明胚胎期与新生期的免疫系统接触抗原(不论是天然或人工的)后,极易导致终生或长期的耐受性。其后,许多实验证实这一现象的普遍性。这主要与免疫系统发育未成熟有关,体外实验证明未成熟细胞大30倍以上。成年机体一般亦不易诱导耐受,常须联合应用其他免疫抑制措施,以加速其诱导过程。
(二)遗传因素
小鼠免疫耐受及维持的难易程度随品系不同而异。自身免疫病好发鼠(NZB×NAW)F1品系难于诱导耐受,所诱导出的耐受性维持时间短。所有自发产生类似人类系统性红斑狼疮(SLE)品系小鼠不易用半抗原或非聚合的免疫球蛋白诱发耐受。
(三)免疫抑制的联合应用
前已提及,单独使用抗原一般不易对成年机体诱发耐受性,而常需要与各种免疫抑制措施联合应用。常用的有效方法是全身淋巴组织照射,应用抗淋巴细胞血清(anti-lym-phocyte serum,ALS),抗TH细胞抗体(人抗CD4、小鼠抗L3T4),环磷酰胺,环孢素A,糖类皮质激素等免疫抑制药物。
上述现象不仅已被许多实验所证明,而且在器官移植临床工作中已被证实是延长移植物存活的有效措施,认为是常规防止移植物排斥的方法。
单纯免疫抑制药物并不能诱导出抗原特异性的免疫耐受。这些药物必须与抗原联合应用,在免疫耐受形成过程中起促进作用,降低耐受原剂量,阻断抗原刺激后免疫活性细胞的分化。
例如环磷酰对抗原诱导免疫耐受有促进作用。现已证明,环磷酰胺同时作用于T及B细胞。它参与免疫耐受诱导的机制可能与其阻止B细胞表面免疫蛋白受体的再生有关。
又如全身淋巴组织照射时用铅板遮蔽骨髓、肺及其他生命重要的非淋巴器官,因此剂量即使高达40戈瑞(Cy)亦无副反应。这种处理可使机体胸腺及二级淋巴器官中已成熟的淋巴细胞受到破坏,造成类似新生期的状态。此时胸腺和二级淋巴器官中未成熟的淋巴细胞可重新形成集落,细胞表面虽有抗原受体表达但尚未发育成熟。因此,全身淋巴组织照射后能用多种抗原诱导出持久的免疫耐受,如输注同种异体骨髓能建立起同种骨髓嵌合体且不发生移植物抗宿主病。这种情况下,耐受性的维持与体内产生特异性的抑制细胞有关,称为天然抑制细胞。这种细胞见于新生及照射过的动物脾内,它们不具有通常T细胞表面标志,表型类似NK细胞,但对NK细胞敏感的靶细胞并无杀伤作用。
第三节 免疫耐受的维持和终止
一、影响免疫耐受持续时间的因素
(一)抗原因素
抗原的持续存在是维持机体免疫耐受性的必要因素。因免疫系统中不断有新的免疫活性细胞产生,持续存在的抗原可使新生的免疫细胞不断耐受。一旦体内的抗原消失,则已建立起来的免疫耐受可使耐受性也逐渐消退,对特异抗原可重新出现免疫应答。
多次重复注射耐受原可使耐受状态延长,持续时间长短与使用抗原次数有关。
抗原的性质与耐受性维持时间也有关。一些有生命的耐受原,如活的淋巴细胞、病毒等能在体内繁殖,此种抗原在体内持续时间长,因而诱导的耐受性亦不易消退。在一些无生命的抗原中,分解缓慢的抗原较分解迅速的抗原所诱导的耐受性持续时间长。如D氨基酸多聚体在体内分解缓慢,只需一次性注射就诱导出长达一年的耐受状态。
(二)机体因素
免疫系统处于未成熟状态时,如胎儿、新生期、经适当的免疫制措施后,所诱导的免疫耐受性维持时间长。
二、免疫耐受的终止
(一)自发终止
已建立了耐受性的个体如无抗原的再度刺激,免疫耐受性随着体内抗原被清除而自行消退,重新出现对特异抗原的免疫应答,此即为免疫耐受性的自发终止。
(二)特异终止
使用各种模拟抗原物质,可特异地破坏已建立的耐受性。
1.注射化学结构改变的耐受原如通过理化及生物因素使抗原结构改变。
2.注射置换载体的新抗原将耐受原的半抗原部分连接到另一载体上,形成新抗原。例如,事先以BSA-DNP诱发家兔产生耐受性,将DNP连接至HAS上,若将其注射至耐受家兔,可使其再度出现抗DNP抗体,即原有的特性免疫耐受性终止。
3.注射与耐受原有交叉反应的抗原具有共同抗原决定簇的各种抗原物质能够诱导交叉反应。人体对自身抗原有免疫耐受性,接受交叉抗原刺激后,可能导致自身耐受性的终止,而出现自身免疫性。
第四节 免疫耐受的机制
1975年著名免疫学家Burnet提出克隆选择学说,并以克隆清除(clonaldeletion)学说解释免疫耐受现象。他的观点曾对免疫学的发展产生深远影响。随着近代基础免疫学,尤其是免疫调节研究的迅速发展,当前对免疫耐受机制的认识已远远超越了这一学说当时的涵义。它的发生涉及到免疫应答过程中任何一个正、负调节系统。下述几种重要观点,其各自均有相应的实验证据。
一、克隆清除
Burnet的克隆选择学说提出体内约存在着102-107具有免疫活性的细胞克隆,每一克隆细胞都具有其特异的、能与其相应抗原决定簇起反应的受体。但处于未成熟阶段的T、B反应细胞系因接触抗原而被清除,则造成免疫耐受。现知大量未成熟自身反应性T细胞在胸腺内因接触相应的自身抗原后,发生程序性死亡而被清除,这是维持自身耐受最有效的机制。
克隆清除学说强调了免疫耐受诱导过程的中枢衰竭机制。这一学说尚不能解释许多客观存在的现象:①已建立的耐受性可以、甚至易于被破坏,即对原先的耐受原重新出现免疫应答;②给已建立耐受性的动物输注同品系正常动物的淋巴细胞(含反应克隆)并不能使动物恢复对耐受原的免疫应答;③将已建立耐受动物的淋巴细胞转移到同品系正常动物体内,能使其产生对相同抗原的耐受性;④成年机体对大多数自身抗原虽呈免疫耐受,但业已发现成年机体内可检测到对自身抗原起反应的T和B细胞克隆的存在。
以上事实提示,在免疫耐受,尤其是获得性免疫耐受的机体内,自身反应细胞克隆并未被彻底清除,而是处于功能受抑或无能状态(clonalanergy)。凡是细胞表面抗原受体被封闭,抗原不能与细胞表面受体结合,缺少T细胞或巨噬细胞的辅助作用,以及T细胞与巨噬细胞主动抑制作用,抗独特型网络的主动抑制等都可能参与耐受的诱导过程。导致反应细胞克隆的不应答,而不能发生正相免疫应答。
二、克隆不应答
(一)免疫活性细胞缺乏激活信号
现已知T细胞必须的激活信号至少包括:①由特异抗原与自身MHCⅠ类或Ⅱ类抗原的复合物激发的信号;②由协同刺激因子(costimulator)激发的信号。缺乏足够的激活信号则导致免疫不应答。目前认为,一些针对胸腺内不表达的自身抗原(如器官特异抗原)的自身反应性T细胞克隆存在于正常机体,但因带有这些自身抗原的细胞表面通常有具有MHCⅡ类抗原,因此不能激活相应T细胞克隆。
(二)免疫活性细胞激活受阻
1.免疫活性细胞表面抗原受体被封闭则可产生不应答。适量双价或多价抗原与免疫活性细胞表面抗原受体结合,受体聚集成帽状,使细胞活化而产生免疫应答(图13-1B)。而单价抗原(monomeric antigen)与免疫活性细胞表面抗原各个受体结合(图13-1A),抗原占据整个细胞的表面受体,对受体起封闭作用,则不能激活免疫细胞。如分子表面有许多相同重复决定簇的非胸腺依赖抗原在体内不易被分解,能与B细胞表面的抗原受体呈牢固、广泛交联,可使受体封闭。高剂量多价抗原使细胞表面抗原受体广泛交联,使液态镶嵌的细胞膜不能流动,膜受体呈“冻结”状态,细胞不被活化(图13-1C)。
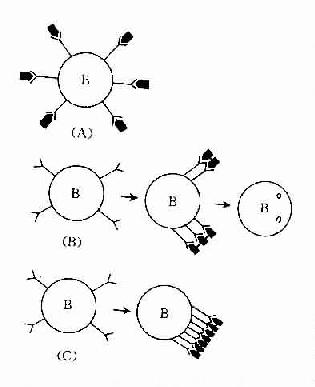
图13-1 B细胞表面抗原受体的封闭
(A)单价抗原占据B细胞表面抗原受体;
(B)适量双价抗原使B细胞表面受体交联成帽状,内吞;
(C)大量 多价抗原使B细胞表面受体交联“冻结”
2.抗原不能抵达免疫活性细胞表面有时机体在初次接触抗原后,产生抗体过剩,抗体与再次进入的抗原在体液中结合,使抗原不能到达细胞表面受体上,因而也可造成免疫无反应性。
(三)缺乏辅助细胞
胸腺依赖抗原(自然界大多数抗原均属此类)激发免疫应答均需TH细胞巨噬细胞的参与,若缺乏辅助细胞,免疫活性细胞单独不能作出有效应答。
1.缺乏辅助性T细胞(TH) 前已述及T/B细胞对同一抗原产生耐受性时,表现不同的特征。小剂量抗原便足以使T细胞产生耐受,此时B细胞虽未产生耐受,但因失去T细胞的辅助而不能活化,但是T细胞的耐受性维持时间大大超过B细胞(如图13-2所示)。B细胞虽恢复免疫应答,但T细胞仍处于耐受状态,因而出现T、B反应性呈分离状态的区域(表13-3)。这时,B细胞仍缺乏必要的T细胞辅助而不能产生有效的免疫应答。

图13-2 T、B 细胞发生耐受的不同特征
2.缺乏巨噬细胞辅助巨噬细胞在免疫应答形成中,起着重要的摄取抗原、加工和呈递抗原的作用,从而参与了特异性免疫应答。所以巨噬细胞的功能缺陷也是耐受诱导的重要的原因。
表13-3 T细胞与B细胞耐受特征
|
T细胞 |
B细胞 |
| 克隆清除 |
蛋白质抗原胸腺内诱导 机制:不成熟T细胞与抗原高亲和力结合导致和序性细胞死亡(PCD) |
蛋白质抗原及非蛋白质抗原导部位骨髓或周围尚不肯定 机制、:程序性细胞死亡(PCD) |
| 克降不应答 |
APC缺乏协同刺激因子 |
多价抗原与不成熟B细胞结合 |
| 抗原性质 |
可溶性蛋白质静脉或口服无佐剂参与 |
大剂量多糖类抗原多聚蛋白质抗原(重复表位)无TH参与 |
| 耐受期限 |
期限长 |
期限短 |
| 抗原耐受剂量 |
剂量低 |
剂量高 |
三、抑制细胞的作用
(一)TS细胞的作用
70年代Gershon等首先提出TS细胞的现象。将耐受动物的脾或胸腺细胞转输给同品系正常动物后,使后者获得耐受性,又称为传染性耐受(infectious tolerance)。如果在转输前将脾细胞用抗Thy-1血清加补体处理,去除T细胞,则受体动物不会发生过继性耐受。
TS细胞的作用通常是抗原特异性的,它可能是通过阻止抗原呈递,阻断TH细胞的功能。抑制B细胞分化以及阻断B细胞分化为抗体分泌细胞等环节发挥作用。
(二)自然抑制细胞的作用
自然抑制(natural suppressor,NS)细胞主要抑制T细胞参与的免疫应答,无抗原特异性。这些细胞可能在新生与成年动物的耐受诱导中均起作用。NS细胞形态上为大颗粒淋巴细胞(large granularlymphocytes,LGL),见于胚胎及新生期、出生后数天内消失,抗原不能诱导,表面无T、B细胞特有的标志、对B细胞无抑制作用,成年动物照射后,先是NS细胞的再现,照射后短期内导入抗原,继之便出现TS细胞。照射促使骨髓移植物存活,可能与此种机制有关。抑制功能:混合淋巴细胞反应、TC细胞生成GVH反应。
(三)巨噬细胞的抑制作用
已有文现献报告抑制性单核-巨噬细胞亚群的存在。其抑制作用可能是由花生四烯酸代谢产物所介导。因阿司匹林和消炎痛能逆抑制作用。我国学者发现耐受动物的腹腔巨噬细胞有抑制同系正常动物混合淋巴细胞反应的作用,此作用并有抗原特异性。在对照组中,正常动物的巨噬细胞却能增强抗原特异性的混合淋巴细胞反应。
(四)抗独特型网络的作用
每个T、B细胞克隆均具有其独特型。B细胞表面及分泌的免疫蛋白超变区抗原结合部位是独特型的物质基础。免疫球蛋白独特型结构本身具抗原性,被相应细胞克隆识别而产生抗独特型抗体可进一步诱导抗-抗独特型第一系列连锁反应。对免疫应答起“自限”作用。T、B细胞参与的免疫应答均受独特特型网络的调节。有人报道给新生鼠注射抗特型抗体导致长期独型耐受,而对成年动物注射抗独特型抗体,可引起短暂的独特型耐受。
抗独特抗体所引起的耐受性,仅针对抗体的独特型部分,机体对抗原其他决定簇的免疫应答依然存在。
第五节 免疫耐受的临床意义
首先,免疫耐受的诱导、维持和破坏影响着许多临床疾病的发生、发展和转归。人们企图诱导和维持免疫耐受性来防治超敏性疾病、自身免疫性疾病以及移植物的排斥反应。某些感染性疾病以及肿瘤生长过程中,设法解除免疫耐受、激发免疫应答将有利于对病原体的清除及肿瘤的控制。
根据免疫耐受发生机制的多样性,对Ⅰ型变态反应患者诱导免疫耐受的可能途径是通过B克隆清除或主动抑制。处理的方法有注射表面高密度多聚耐受原、变性蛋白抗原或脱敏疗法等。
自身免疫病的发生至今认为主要与自身耐受的破坏有关,去除导致耐受破坏的因素,当然有利于对自身免疫病的防治。
现代医学虽然已将古人幻想的器官移植变为现实,但同种异体免疫排斥现象仍是器官移植中主要存在的问题。免疫抑制疗法上的进步有利于延长移植物存活,但非特异抑制所带来的副作用仍有待解决。若能将特异抑制(免疫耐受)成功地应用于临应,收到较好的效果,无疑是在此领域中的重大突破。
在麻风及慢性粘膜皮肤念珠菌病患者中,若体内出现良好的细胞免疫应答,虽抗体生成低下或甚至缺如,临床预后仍良好,并常伴随有效的防御性免疫。反之,如细胞免疫水平低下,抗体效价虽高,而预后较差,多呈进行性感染。这种分离耐受现象对感染性疾病的预后有重要影响。乙型肝炎病毒携带者伴有极轻微的肝炎病变,可能与新生期发生感染而使机体对病毒产生部分耐受性有关。
在对肿瘤患者的免疫治疗中,解除患者的免疫耐受状态也是一项有意义的措施。近年,美国两家实验室报导将一种协同刺激因子B7的基因转染黑色素瘤细胞,并用这种转染细胞进行防治黑色素瘤的实验性研究,获得可喜的成功。为这一领域的研究开阔了新的途径。