第一节 缺氧的概念
氧参与生物氧化,是正常生命活动不可缺少的物质。成人在静息状态下,每分钟耗氧量约250毫升;活动时,耗氧量增加。但人体内氧储量极少,有赖于外界环境氧的供给和通过呼吸、血液、血液循环不断地完成氧的摄取和运输,以保证细胞生物氧化的地需要。
当组织得不到充足的氧,或不能充分利用氧时,组织的代谢、机能、甚至形态结构都可能发生异常变化,这一病理过程称为缺氧(hypoxia)。
缺氧是许多疾病所共有的一个基本病理过程。例如休克、呼吸功能不全、心功能不全、贫血等,都可以引起缺氧。缺氧在军事医学中也是个非常重要的课题,例如高原适应不全症主要是个缺氧的问题;高空飞行、潜水作业、密闭舱或坑道内作业,如果处理不当或发生意外,都可发生缺氧。所以研究缺氧发生和发展的规律以及缺氧所引起的病理生理变化,对缺氧的防治,保障部队战斗力,具有重要的意义。
氧的获得和利用是个复杂的过程。组织的供氧量=动脉血氧含量×血流量;组织的耗氧量=(动脉血氧含量-静脉血氧含量)×血流量。故血氧是反映组织的供氧与耗氧的重要指标。
常用的血氧指标及其意义
氧分压(PO2)是指以物理状态溶解在血浆内的氧分子所产生的张力(故又称氧张力)。在100毫升37℃的血液内、以物理状态溶解的氧,每0.003毫升可产生0.133kPa(1mmHg)的氧分压。正常人在静息状态,呼吸海平面空气,以物理状态溶解在动脉血内的氧约0.3毫升%,动脉血氧分压(PaO2)约13.3kPa(100mmHg);静脉血氧分压(PvO2)正常约5.32kPa(40mmHg)。
PaO2主要取决于肺泡氧分压(PAO2)的高低、氧通过肺泡膜弥散入血的量、肺泡通气量与肺血流量的比例。如果外界空气氧分压低或肺泡通气减少,使肺泡氧分压降低,或弥散障碍、通气/血流比例失调,使肺动-静脉血功能性或解剖性分流增加,都可使PaO2降低。
氧含量 是指100毫升血液内所含的氧毫升数,包括实际与血红蛋白结合的氧和溶解在血浆内的氧。正常动脉血氧含量约19.3毫升%,混合静脉血氧含量约12毫升%。
血液氧含量主要取决于PaO2与血红蛋白的质和量。PaO2明显降低或血红蛋白结合氧的能力降低,使血红蛋白饱和度降低,或单位容积血液内血红蛋白量减少,都可使氧含量减少。
氧容量 指氧分压为19.95kPa(150mmHg),二氧化碳分压为5.32kPa(40mmHg),湿度38℃,在体外100毫升血液内血红蛋白所结合的氧量。正常血红蛋白在上述条件下,每克能结合氧1.34~1.36毫升。若按每100毫升血液含量含血红蛋白15克计算,动脉血和静脉血氧容量约20毫升%。
氧含量取决于单位容积血液内血红蛋白的量和血红蛋白结合氧的能力。如果血红蛋白含量减少(贫血)或血红蛋结合氧的能力降低(如高铁血红蛋白、碳氧血红蛋白),则氧容量减少,氧含量也随之减少。如果单位容积血液内血红蛋白的量和性质正常,只是由于氧分压降低使血红蛋白氧饱和度降低。此时氧含量减少,但氧容量是正常的。
氧饱和度 是指血红蛋白与氧结合达到饱和程度的百分数。1克血红蛋白最多能与1.36毫升的氧结合,氧饱和度达到100%。氧饱和度可以下列公式表示:
氧饱和度(%)=实际1克血红蛋白结合的氧(毫升)/1.36(毫升)×100
正常动脉血氧饱和度约95~97%,混合静脉血氧饱和度约75%。
氧饱和度高低主要取决于氧分压的高低,氧分压与氧饱和度之间的关系,可用氧离曲线来表示(图3-1)。由于血红蛋白的生理特点,氧离曲线呈S形,PO27.98kPa(60mmHg)以下,才会使氧饱和度明显降低,氧含量明显减少,从而引起缺氧。
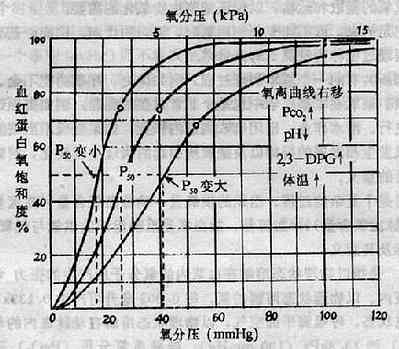
图3-1 氧离曲线
中间曲线为标准状态下(38℃、PCO2 5.32kPa(40mmIIg)、pH7.4)的氧离曲线,P50约3.59kPa (27mmHg)
动脉血氧分压和氧饱和度
混合静脉血氧分压和氧饱和度
kPa: 千帕斯卡(Kilo-Pascal),1mmHg=0.133kPa
血红蛋白与氧亲和力高低,常用P50表示。P50是指血液在38℃,pH7.4,PCO2 5.32kPa(400Hg)的条件下,使氧饱和度达到50%时的氧分压。正常成人P50约为3.59kPa(27mmHg)。血液PCO2升高、pH降低、湿度升高或红细胞内2,3-DPG含量缯加,都可使血红蛋白氧亲和力降低,氧离曲线右移,P50增大(图3-1);反之,使血红蛋白与氧亲和力升高,氧离曲线左移,P50变小。血红蛋白的结构与功能异常,不易与氧结合或不易解离氧,对P50也有影响。
动静脉血氧差 即动脉血氧含量减去静脉血氧含量所得的毫升,说明组织对氧消耗量。由于各组织器官耗氧量不同,各器官动静脉血氧差很不一样。正常动脉血与混合静脉血氧差约6~8毫升%。
动静脉血氧差变化取决于组织从单位容积血液内摄取氧的多少。PaO2明显降低,动脉血与组织氧分压梯差变小;微循环动静脉吻合支开放,使流经真毛血管的血量减少;红细胞变形能力降低或红细胞聚集,使血液流变性发生改变;细胞受损,利用氧的能力降低,都可使组织细胞从血液中的摄取的减少,动静脉血氧减少变小。淤血,血流缓慢,虽然单位时间动脉血灌流减少,但由于血流缓慢和氧离曲线右移,组织从单位容积血液内摄取的氧增多,动静脉血氧差加大。各型缺氧时动静脉血氧差的变化,要对具体情况作具体的分析。
第二节 缺氧的原因和类型
根据缺氧发生的速度,有急性缺氧和慢性缺氧。根据缺氧时PaO2的变化,有低张性低氧血症和等张性低氧血症。根据缺氧的原因,有乏氧性缺氧、血液性缺氧化、循环性缺氧、组织性缺氧。
一、乏氧性缺氧(Hypoxic Anoxia)
乏氧性缺氧是指由于肺泡氧分压降低,或静脉血分流入动脉,血液从肺摄取的氧减少,以致动脉血氧含量减少,PaO2降低。属于低张性低氧血症(hypotonic hypoxemia)。
(一)原因
1、吸入气氧分压低 例如高原或高空,大气压低;通风不好的矿井、坑道内;吸入低氧的混合气体(如吸入气摄入高浓度的氮、氢或笑气)。由于吸入气氧分压低,PAO2和PaO2随之降低。
2、外呼吸功能障碍 呼吸运动减弱或肺的疾患(如窒息、慢性阻塞性肺疾患、肺水肿、肺炎等),致肺泡通气量减少,PACO2升高,PAO2降低,结果血液通过肺摄取的氧减少,动脉血氧含量和PAO2降低。由呼吸功能障碍而引起的缺氧,又称呼吸性缺氧(respiratoryanoxia)。
3、静脉血分流入动脉(静脉血掺杂)增多正常掺杂到动脉的静脉血约占心输出量的2-3%。如果心房或心室中隔缺损,伴有肺动脉狭窄或肺动脉高压,右心的静脉血可部分经缺损处流入左心。又如肺的疾患,引起弥散障碍或通气/血流比例失调,或肺动脉吻合支开放,可致肺动静脉血功能性或解剖性分流增加。静脉血分流入动脉增多,达到心输出量的50%,PaO2可降到6.65kPa(50mmHg)以下。如果此时肺泡气通气量正常,则肺泡与动脉血氧分压差加大。
(二)、乏氧性缺氧的特点(图3-2)
1、动脉血氧分压、氧饱和度和氧含量都降低,静脉血氧分压、氧饱和度和氧含量亦随之降低。
2、动脉血和静脉血氧容量正常。如果由于慢性缺氧,使单位容积血液内红细胞数和血红蛋白量增多,氧容量增加。
3、动脉血氧差接近正常。如果PaO2太低,动脉血与组织氧分压差明显变小,血氧弥散到组织内减少,可使动静脉血氧差降低。
4、除血氧变化外,根据肺泡通气量,PaO2有不同的变化,例如严重的肺气功能障碍,CO2排出少,PaCO2升高;如果过度换气,CO2排出多,则PaCO2降低。
二、血液性缺氧(Hemic Anoxia)
血液性缺氧是指由于血红蛋白含量减少或性质发生改变,致血液携带的氧减少,血氧含量降低,或血红蛋白结合的氧不易释出所引起的缺氧。由于以物理状态溶解在血液内的氧不受血红蛋白的影响,这型缺氧的PaO2正常,属于等张性低氧血症(isotonic hypoxemia)。
(一)原因
1、贫血(anemia)各种原因引起的贫血,单位容积血液内红细胞数和血红蛋白量减少,虽然PaO2和氧饱和度正常,但氧容量降低,氧含量随之减少。虽然由血红蛋白携带的氧减少,但由于单位容积的红细胞数减少,血液粘度降低,血流加快,运输氧的能力提高(单位时间内血液给组织运输的氧量以血细胞压积为30%时最高),一般当贫血使血细胞压积低于20%,才会引起组织对氧供给不足。
2、高铁血红蛋白血症(methemoglobinemia)血红蛋白的二价铁,在氧化剂的作用下,可氧化成三价铁,形成高铁血红蛋白(methemoglobin,HbFe3+OH),也称变性血红蛋白或羟化血红蛋白。高铁血红蛋白的三价铁因与羟基牢固结合而丧失携带氧的能力,加上血红蛋白分子的四个二价铁中有一部分氧化为三价铁后还能使剩余的Fe2+与氧的亲和力增高,导致氧离曲线左移,使组织缺氧。生理情况下,血液中不断形成极少量的高铁血红蛋白,又不断地被液中的还原剂如NADH,抗坏血酸,还原型谷胱甘肽等还原为二价铁的血红蛋白,使正常血液中高铁血红蛋白含量占血红蛋白的1.7%以下。当亚硝酸盐、过氯酸盐、磺胺等氧化剂中毒时,如使血中高铁血红蛋白含量增加至20~50%,就可出现头疼、衰弱、昏迷、呼吸困难和心动过速等症状。较常见的是食用大量含硝酸盐的腌菜后,经肠道细菌将硝酸盐还原为亚硝酸盐,吸收后形成高铁血红蛋白血症,称为“肠源性发绀”(enterogenouscyanosis)。
3、碳氧血红蛋白血症(carboxyemoglobinemia)碳氧血红蛋白血症是由于CO中毒引起的,CO与Hb的亲和力为O2与Hb亲和力的218倍(37℃),Hb与CO结合后就不能与O2结合。另一方面,CO还能抑制红细胞内糖酵解,使其2,3-DPG生成减少,氧离曲线左移,HbO2中的氧不易释出,从而加重组织缺氧,血液HbCO含量达到Hb总量的10~20%,就可引起轻度缺氧;当吸入气中有0.1%的CO时,血液中的血红蛋白可能有50%为HbCO,则可发生极为严重的缺氧。
(二)血液性缺氧的特点(图3-2)
1.PaO2正常,氧容量和氧含量减少。
2.血红蛋白氧饱和度,贫血性缺氧正常,高铁血红蛋白血症和碳氧血红蛋白血症降低。
3.动静脉血氧差常小于正常。
4.由于PaO2正常,一般不引起肺通气增加。严重贫血不出现紫绀。高铁血红蛋白呈咖啡色(皮肤、粘膜青紫),碳氧血红蛋白呈樱桃红色。
三、循环性缺氧(Circulatory Anoxia)
循环性缺氧是指由于血液循环障碍,供给组织的血液减少而引起的缺氧,又称低血流性缺氧(hypokinetic anoxia)。循环性缺氧可以是局部的(如血管狭窄或阻塞);也可以是全身性的(如心力衰竭、休克)。由于动脉狭窄或阻塞,致动脉血灌流不足而引起的缺氧,又称缺血性缺氧(ischemic anoxia);由于静脉血回流受阻,血流缓慢,微循环淤血,导致动脉血灌流减少而引起的缺氧,称淤血性缺氧(stagnant anoxia)。
(一)原因
1、血管的狭窄或阻塞 可见于血管的栓塞、受压、血管的病变如动脉粥样硬化或脉管炎与血栓形成等。
2、心力衰竭 由于心输出量减少和静脉血回流受阻,而引起组织淤血和缺氧。
3、休克 由于微循环缺血、淤血和微血栓的形成,动脉血灌流急剧减少,而引起缺氧。
(二)循环性缺氧的特点(图3-2)
1.动脉血氧分压、氧饱和度和氧含量正常。氧容量一般是正常的。
2、由于血流缓慢和氧离曲线右移,组织从单位容积血液内摄取的氧增多,静脉血氧分压、氧饱和度和氧含量降低,动静脉血氧差别加大。休克时,如果微循环动静脉吻合支开放,或细胞利用氧的能力降低,动静脉血氧差也可以变小。
3.不仅组织缺氧,组织内代谢产物也不能及时运出,所以低血流性缺氧比乏氧性缺氧对组织细胞损害更为严重。
四、组织性缺氧(Histogenous Anoxia)
由组织细胞利用氧异常所引起的缺氧称为组织性缺氧。
(一)原因
1、组织中毒如氰化物、硫化氢、磷等可引起组织中毒性缺氧(histotoxic anoxia)。最典型的是氰化物中毒。各种氰化物,如HCN、KCN、NaCN、NH4CN等可由消化道、呼吸道或皮肤进入体内,迅速与氧化型细胞色素氧化酶的三价铁结合为氰化高铁细胞色素氧化酶,使之不能还原成还原型细胞色素氧化酶,以致呼吸链中断,组织不能利用氧。0.06克的HCN即可使人死亡。硫化氢、砷化物等中毒也主要由于抑制细胞色素氧化酶等而影响了细胞的氧化过程。细菌毒素、放射线等也可能损伤线粒体的呼吸功能而引起氧的利用障碍。
2、组织水肿组织间液和细胞内液的异常增多,使气体弥散距离增大,引起内呼吸障碍。
3、组织需氧过多如冠状动脉硬化的病人运动或情绪激动时,心肌耗氧量增加可诱发心绞痛。
(二)组织性缺氧的特点(图3-2)
1.动脉血氧分压、氧饱和度和氧含量正常。
2.静脉血氧分压、氧饱和度和氧含量高于正常,动脉血氧差变小。
因组织需氧过多引起缺氧时,组织耗氧量是增加的,静脉血氧含量与氧分压较低,使动静脉血氧增大。
表3-1 各型缺氧的血氧变化
| 缺氧类型 |
动脉血氧分压 |
动脉血氧饱和度 |
血氧容量 |
动脉血氧含量 |
动-静 脉氧差 |
| 乏氧性缺氧 |
↓ |
↓ |
N |
↓ |
↓和N |
| 血液性缺氧 |
N |
N |
↓或N |
↓或N |
↓ |
| 循环性缺氧 |
N |
N |
N |
N |
↑ |
| 组织性缺氧 |
N |
N |
N |
N |
↑或↓ |
↓降低 ↑升高N正常
缺氧虽分为上述四型,但在实际情况中所见的,往往是混合型。例如失血性休克,既有血红蛋白减少所致的血液性缺氧,又有有微循环障碍所致的循环性缺氧。又如心力衰竭,既有循环障碍引起的循环性缺氧,又可继发肺淤血、水肿而引起呼吸性缺氧。因此,对具体病人,要作全面地具体分析。
第三节 缺氧时机体的机能代谢变化
缺氧时机体的机能代谢变化,包括机体对缺氧的代偿性反应和由缺氧引起的代谢与机能障碍。轻度缺氧主要引起机体代偿性反应;严重缺氧而机体代偿不全时,出现的变化以代谢机能障碍为主。机体在急性缺氧时与慢性缺氧时的代偿性反应也有区别。急性缺氧是由于机体来不及代偿而较易发生代谢的机能障碍。各种类型的缺氧所引起的变化,既有相似之处,又各具特点,以下主要以低张性缺氧为例,说明缺氧对机体的影响。
一、代偿性反应
动脉血氧分压一般要降至8kPa(60mmHg)以下,才会使组织缺氧,才引起机体的代偿反应,包括增强呼吸血液循环,增加血液运送氧和组织利用氧的功能等。
(一)呼吸系统
PaO2降低(低于8kPa)可刺激颈动脉体和主动脉体化学感受器。反射性地引起呼吸加深加快,从而使肺泡通气量增加,肺泡气氧分压升高,PaO2也随之升高。吸入10%氧时,通气量可增加50%;吸入5%氧可使通气量增加3倍。胸廓呼吸运动的增强使胸内负压增大,还可促进静脉回流,增加心输出量和肺血流量,有利于氧的摄取和运输。但过度通气使PaO2降低,减低了CO2对延髓的中枢化学感受器的刺激,可限制肺通气的增强。
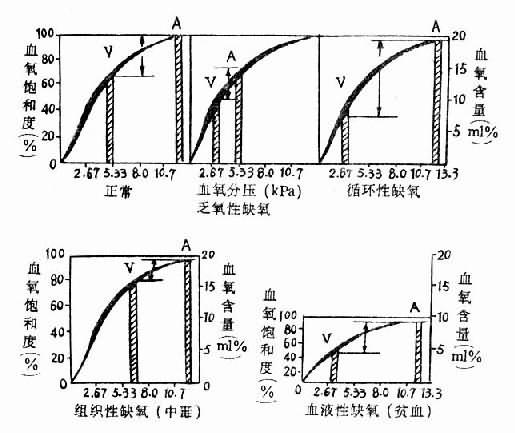
图3-2 各型缺氧的血氧变化特点
A动脉V静脉图中kPa相当于mmHg的数值
| kPa |
mmHg |
| 2.67 |
20 |
| 5.33 |
40 |
| 8.0 |
60 |
| 10.7 |
80 |
低张性缺氧所引起的肺通气变化与缺氧持续的时间有关。如人达到400m高原后,肺通气量立即增加,但仅比在海平面高65%。数日后,肺通气量可高达在海平面的5~7倍。但久居高原,肺通气量逐渐回降,至仅比海平面者高15%左右。在急性缺氧早期肺通气增加较少,可能因过度通气形成的低碳酸血症和呼吸性碱中毒对呼吸中枢的抑制作用,使肺通气的增加受限。2~3日后,通过肾脏代偿性地排出HCO3-,脑脊液内的HCO3-也逐渐通过血脑屏障进入血液,使脑组织中pH逐渐恢复正常,此时方能充分显示缺氧兴奋缺氧的作用。久居高原肺气量回降,可能与外周化学感受器对缺氧的敏感性降低有关。据观察,世居高原者之颈动脉体的平均体积比世居海平面者大6.7倍,患慢性阻塞性肺病的病人的颈动脉比正常人大一倍以上。电镜观察表明,在慢性低张性缺氧的早期,颈动脉体增大,其中I型细胞增多,因I型细胞中嗜锇体含儿茶酚胺类神经介质,其增多可能具代偿意义。但在缺氧晚期,在增大的颈动脉体中嗜锇体的中心(core)缩小、晕轮(halo)加宽,有时整个嗜锇体为空泡所取代。这可能是颈动脉化学感受器敏感性降低的原因。长期缺氧使肺通气反应减弱,这也是一种慢性适应性反应。因为肺通气每增加1L,呼吸肌耗氧增加0.5ml,可能加剧机体氧的供求矛盾,故长期呼吸运动增强显然是对机体不利的。
肺通气量增加是对急性低张性缺氧最重要的代偿性反应。此反应的强弱存在显著的个体差异,代偿良好者肺通气量增加较多,PaO2比代偿不良者高。PaCO2也较低。
血液性缺氧和组织性缺氧因PaO2不低,故呼吸一般不增强;循环性缺氧如累及肺循环,如心力衰竭引起肺淤血、水肿时,可使呼吸加快。
(二)循环系统
低张性缺氧引起的代偿性心血管反应,主要表现为心输出量增加、血流分布改变、肺血管收缩与毛细血管增生。
1、心输出量增加 有报道进入高原(6100m)30天的人,其心输出量比平原居民高2~3倍。在高原久住后,心输出量逐渐减少。心输出量增加可提高全身组织的供氧量,故对急性缺氧有一定的代偿意义。心输出量增加主要是由于:
(1)心率加快:过去认为心率加快是颈动脉体和主动脉体化学感受器刺激反射性地引起。但有人实验,在控制呼吸不变的情况下,缺氧刺激血管化学感受器却使心率变慢。因此缺氧时心率加快很可能是通气增加所致肺膨胀对肺牵张感受器的刺激,反射性地通过交感神经引起的。
然而呼吸运动过深反而通过反射使心率减慢,外周血管扩张和血压下降。
(2)心收缩性增强:缺氧作为一种应激原,可引起交感神经兴奋,作用于心脏β—肾上腺素能受体,使心收缩性增强。
(3)静脉回流量增加:胸廓呼吸运动及心脏活动增强,可导致静脉回流量增加和心输出量增多。
2、血流分布改变器官血流量取决于血液灌注的压力(即动、静脉压差)和器官血流的阻力。后者主要取决于开放的血管数量与内径大小。缺氧时,一方面交感神经兴奋引起的血管收缩;另一方面局部组织因缺氧产生的乳酸、腺苷等代谢产物则使血管扩张。这两种作用的平衡关系决定器官的血管是收缩或扩张,以及血流量是减少或增多。急性缺氧时,皮肤、腹腔内脏交感神经兴奋,缩血管作用占优势,故血管收缩;而心、脑血管因以局部组织代谢的产物的扩血管作用为主,故血管扩张,血流增加。这种血流分布的改变显然对于保证生命重要器官缺氧的供应是有利的。
心肌活动消耗的能量主要来自有氧代谢。心脏重量约占体重之0.4~0.5%,静息时冠脉流量约占心输出量之4~5%,其动—静脉血氧含量差约为12ml%,表明心肌耗氧量大,由单位容积血液摄取的氧量多。心肌缺氧时,进一步提高对单位容积血液中氧的摄取率很有限,主要依靠扩张冠状血管以增加心肌的供氧。冠脉扩张由局部代谢产物(腺苷、H+、K+、PGI2等)与冠脉平滑肌中β—肾上腺能受体占优势所致,其中腺苷的作用最为重要。当心肌细胞缺氧时,由ATP、ADP生成的AMP增多,AMP在5—核苷酸酶的作用下,脱去磷酸,形成腺苷。腺苷易透过细胞膜进入组织液,作用于冠状血管,使之扩张。通常组织液中的腺苷大部分进入细胞,重新磷酸化生成AMP,一部分被腺苷脱氨酶灭活。缺氧时,腺苷脱氨酶活性可能降低,这也是局部腺苷增多的一个原因。
3、肺血管收缩肺血管直接对缺氧的反应与体血管相反。肺泡缺氧及混合静脉血的氧分压降低都引起肺小动脉收缩,从而使缺氧的肺泡的血流量减少。如果是由肺泡通气量减少引起的肺泡缺氧,则肺血管的收缩反应有利于维持肺泡通气与血流的适当比例,使流经这部分肺泡的血液仍能获得较充分的氧,从而可维持较高的PaO2。此外,正常情况下由于重力作用,通过肺尖部的肺泡通气量与血流量的比值过大,肺泡气中氧不能充分地被血液运走。当缺氧引起较广泛的肺血管收缩,导致肺动脉压升高时,肺上部的血流增加,肺上部的肺泡通气能得到更充分的利用。
缺氧引起肺血管收缩的机制较复杂,尚未完全阐明,研究结果也有矛盾。当前具倾向性的观点:①交感神经作用:缺氧所致交感神经兴奋可作用于肺血管的α受体引起血管收缩反应。②体液因素作用:缺氧可促使肺组织内肥大细胞、肺泡巨噬细胞、血管内皮细胞等释放组胺、前列腺素和白三烯等血管活性物质,其中有的能收缩肺血管,如白三烯(leukotriene,LTs)、血栓素A2(thromboxane A2、TXA2)、前列腺素F2a(prostaglandin F2a,PGF2a)等,有的扩张血管,如前列环素(prostacyclin,PGI2)、前列腺素E1(prostaglandin E1 PGE1)等。在肺血管收缩反应中,缩血管物质生成与释放增加,起介导作用;扩血管物质的生成与释放也可增加,起调节作用。两者力量对比决定肺血管收缩反应的强度。组胺作用于H1受体使肺血管收缩,作用于H2受体则使之扩张。在缺氧性肺血管收缩反应中,组胺释放增多,主要作用于H2受体以限制肺血管的收缩。③缺氧直接对血管平滑肌作用:缺氧使平滑肌细胞膜对Na+、Ca2+的通透性增高,促使Na+、Ca2+的通透性增高,促使Na+、Ca2+内流,导致肌细胞兴奋性与收缩性增高。这一观点还有待进一步证实。看来缺氧性肺血管收缩反应是多因素综合作用的结果。
4、毛细血管增生长期慢性缺氧可促使毛细血管增生。尤其是脑、心脏和骨骼肌的毛细血管增生更显著。毛细血管的密度增加可缩短血氧弥散至细胞的距离,增加对细胞的供氧量。
(三)血液系统
缺氧可使骨髓造血增强及氧合血红蛋白解离曲线右移,从而增加氧的运输和释放。
1、红细胞增多 移居到3600m高原的男性居民红细胞计数通常约为6×1012/L(6×106/mm3),Hb为210g/L(21g/dl)左右。慢性缺氧所致红细胞增多主要是骨髓造血增强所致。当低氧血流经肾脏近球小体时,能刺激近球细胞,使其中颗粒增多,生成并释放促红细胞生成素(erythropoietin),促红细胞生成素能促使红细胞系单向干细胞分化为原红细胞,并促进其分化、增殖和成熟,加速Hb的合成和使骨髓内的网织红细胞和红细胞释放入血液。当血浆中促红细胞生成素增高到一定水平时,可因红细胞增多使缺氧缓解,肾脏促红细胞生成素的产生因而减少,通过这种反馈机制控制着血浆促红细胞生成素的含量。红细胞增多可增加血液的氧容量和氧含量,从而增加组织的供氧量。
2、氧合血红蛋白解离曲线右移缺氧时,红细胞内2,3—DPG增加,导致氧离曲线右移,即血红蛋白与氧的亲和力降低,易于将结合的氧释出供组织利用。但是,如果PaO2低于8kPa,则氧离曲线的右移将使血液通过肺泡时结合的氧量减少,使之失去代偿意义。
2,3—DPG是红细胞内糖酵解过程的中间产物。缺氧时红细胞中生成的2,3—DPG增多是因为:①低张性缺氧者氧合血红蛋白(HbO2)减少,脱氧血红蛋白(Hb)增多,前者中央孔穴小,不能结合2,3—DPG;后者中央孔穴较大,可结合2,3—DPG。故当脱氧血红蛋白增多,红细胞内游离的2,3—DPG减少,使2,3—DPG对二磷酸甘油酶变位酶(diphosphoglycerate mutase, DPGM)及磷酸果糖激酶的抑制作用减弱,从而使糖酵解增强及2,3—DPG的生成增多;②低张性缺氧时出现的代偿性肺过度通气所致呼吸性碱中毒,以及由于脱氧血红蛋白稍偏碱性,致使pH增高,pH增高能激活磷酸果糖激酶使糖酵解增强,2,3—DPG合成增加,另一方面,pH增高还能抑制2,3—DPG磷酸酶(2,3—DPg phosphatase, 2,3—DPG)的活性,使2,3—DPG的分解减少(图3-3,图3-4)。
2,3—DPG增多使氧离曲线右移,是因为:①2,3—DPG与脱氧血红蛋白结合,可稳定后者的空间构型,使之不易与氧结合;②2,3—DPG是一种不能透出红细胞的有机酸,增多时能降低红细胞内pH,而pH下降通过Bohr效应可使血红蛋白与氧的亲和力降低。(Bohr效应系指H+和Pco2对Hb与O2亲和力的影响,当H+浓度或Pco2增高时,Hb与O2的亲和力降低,氧离曲线右移)。
P50为反映Hb与O2的亲和力的指标,指的是血红蛋白氧饱和度为50%时的氧分压,正常为3.47~3.6kPa(26~27mmHg)。红细胞内2,3—DPg 浓度每增高1μm/gHb,P50将升高约0.1kPa。
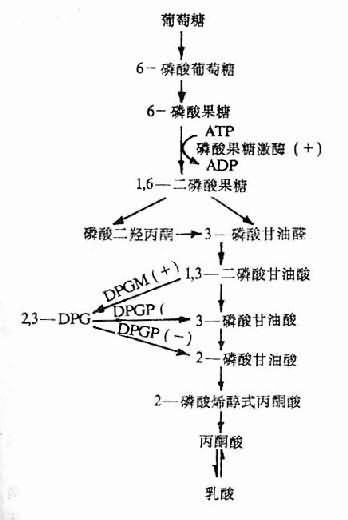
图3-3,2,3—DPG的生成与分解
DPGM二磷酸甘油酸变位酶;
DPGP二磷酸甘油酸磷酸酶;
(+)pH增高时促进反应;
(-)PH增高时抑制反应

图3-4 2,3-DPG结合于HHb分子的中央空穴示意图
(四)组织细胞的适应
在供氧不足的情况下,组织细胞可通过增强利用氧的能力和增强无氧酵解过以获取维持生命活动所必须的能量。
1、组织细胞利用氧的能力增强 慢性缺氧时,细胞内线粒体的数目和膜的表面积均增加,呼吸链中的酶如琥珀酸脱氢酶、细胞色素氧化酶可增加,使细胞的内呼吸功能增强。如胎儿在母体内处于相对缺氧的环境,其细胞线粒体的呼吸功能为成年动物的3倍,至出生后10~14天,线粒体呼吸功能才降至成年动物水平。
2、无氧酵解增强发 严重缺氧时,ATP生成减少,ATP/ADP比值下降,以致磷酸果糖激酶活性增强,该酶是控制糖酵解过程最主要的限速酶,其活性增强可促使糖酵解过程加强,在一定的程度上可补偿能量的不足。
3、肌红蛋白增加 慢性缺氧可使肌肉中肌红细胞蛋白含量增多。肌红蛋白和氧的亲和力较大,当氧分压为1.33kPa(10mmHg)时,血红蛋白的氧饱和度约为10%,而肌红蛋白的氧饱和度可达70%,当氧分压进一步降低时,肌红蛋白可释出大量的氧供细胞利用。肌红蛋白的增加可能具有储存氧的作用。
肺通气及心脏活动的增强可在缺氧时立即发生。但这些代偿功能活动本身消耗能量和氧,红细胞的增生和组织利用氧能力的增强需较长的时间,但为较经济的代偿方式。急性缺氧时以呼吸系统和循环系统的代偿反应为主;慢性缺氧者,如世居高原的居民,主要靠增加组织利用氧和血液运送氧的能力以适应慢性缺氧。其肺通气量、心率及输出量并不多于居住海平面者。
二、缺氧时机体的机能代谢障碍
严重缺氧,如低张性缺氧者PaO2低于4kPa(30mmHg)时,组织细胞可发生严重的缺氧性损伤,器官可发生功能障碍甚而功能衰竭。
(一)缺氧性细胞损伤
缺氧性细损伤(hypoxic cell damage)主要为细胞膜、线粒体溶酶体的变化。
1、细胞膜的变化 在细胞内ATP含量减少以前,细胞膜电位已开始下降。其原因为细胞膜对离子的通透性增高,导致离子顺浓度差透过细胞膜。
(1)钠离子内流:Na+内流使细胞内Na+浓度增加,可激活Na+-K+泵以泵出Na+,从而消耗ATP。ATP消耗量增多可促使线粒体氧化磷酸化过程增强,严重缺氧时,线粒体呼吸功能降低使ATP生成减少,以至Na+-K+泵不能充分运转,进一步使细胞内Na+增多。细胞内Na+的增多促使水进入细胞,导致细胞水肿。血管内皮细胞肿胀可堵塞微血管,加重微循环缺氧。
(2)钾离子外流:K+外流使细胞内缺K+。而K+为蛋白质包括酶等合成代谢所必需。细胞内缺钾将导致合成代谢障碍,酶的生成减少,将进一步影响ATP的生成和离子泵的功能。
(3)钙离子的内流:细胞外Ca2+浓度比胞浆中游离Ca2+高1000倍以上。细胞内Ca2+逆浓度外流和肌浆网、线粒体逆浓度差摄Ca2+均为耗能过程。当严重缺氧时使细胞膜对Ca2+的对通透性增高量Ca2+内流将增加;ATP减少将影响Ca2+的外流和摄取,使胞浆Ca2+浓度增高。Ca2+增多可抑制线粒体的呼吸功能;可激活磷脂酶,使膜磷脂分解,引起溶酶体的损伤及其水解酶释出;还可激活一种蛋白酶,使黄嘌呤脱氢酶(D型)转变为黄嘌呤氧化酶(O型)。由此增加自由基的形成,加重细胞的损伤。
2、线粒体的变化 细胞内的氧约有80-90%在线粒体内用于氧化磷酸化生成ATP,仅10~20%在线粒体外用于生物合成、降解及生物转化(解毒)作用等。轻度缺氧或缺氧早期线粒体呼吸功能是增强的。严重缺氧首先影响线粒体外氧的作用,使神经介质的生成和生物转化过程等降低,当线粒体部位氧分压降到监界点0.1kPa(<1mmHg)时,可降低线粒休的呼吸功能,使ATP生成减少。呼吸功能降低主要因脱氢酶活性下降,严重时线粒体可出现肿胀、嵴崩解、外膜破裂和基质外溢等病变。
3、溶酶体的变化缺氧时因糖酵解增强,乳酸生成增多,和脂肪氧化不全使其中间代谢产物酮体增多。导致酸中毒。pH降低可引起磷脂酶活性增高,使溶酶体膜磷脂被分解,膜通透性增高,结果使溶酶体肿胀、破裂,和大量溶酶体酶的释出,进而导致细胞本身及其周围组织的溶解、坏死。
(二)中枢神经系统的机能障碍
脑重仅为体重为2%左右,而脑血流量约占心输出量之15%,脑耗氧量约为总耗氧量的23%,所以脑对缺氧十分敏感。脑灰质比白质的耗氧量多5倍,对缺氧的耐受性更差。急性缺氧可引起头痛、情绪激动、思维力、记忆力、判断力降低或丧失以及运动不协调等。慢性缺氧者则有易疲劳、思睡、注意力不集中及精神抑郁等症状。严重缺氧可导致烦躁不安、惊厥、昏迷甚而死亡。正常人脑静脉血氧分压约为4.53kPa(34mmHg),当降至3.73kPa(28mmHg)以下可出现神经错乱等;降至2.53kPa(19mmHg)以下时可出现意识丧失;低达1.6kPa(12mmHg)时将危及生命。缺氧引起脑组织的形态学变化主要是脑细胞变性、坏死、脑细胞肿胀及脑水肿。
缺氧引起中枢神经系统机能障碍的机制较复杂。神经细胞膜电位的降低、神经介质的合成减少、ATP的生成不足、酸中毒、细胞内游离Ca2+增多、溶酶体酶的释放以及细胞水肿等,均可导致神经系统的功能障碍,甚而神经细胞结构的破坏、当PaO2低于6.67kPa(50mmHg)时,可使脑血管扩张。缺氧与酸中毒还使脑微血管通透性增高,从而导致脑水肿(图3-5)。脑血管扩张、脑细胞及脑间质水肿可使颅内压升高,由此引起头痛、呕吐等症状。

图3-5 缺氧时脑水肿发生机理
(三)外呼吸功能障碍
急性低张性缺氧,如快速登上4000m以上的高原时,可在1-4天内发生肺水肿,表现为呼吸困难、咳嗽、咳出血性泡沫痰、肺部有湿性罗音、皮肤粘膜发绀等。因高原肺水肿的动物模型难以复制成功,故其发病机制至今尚不清楚。因为肺水肿与肺动脉高压呈正相关,故有人强调肺毛细血管压力增高的作用。可能缺氧所致外周血管收缩使回心血量增加。和肺血量增多;加上缺氧性肺血管收缩反应使肺血流阻力增加,导致肺动脉高压。由于肺血管收缩强度不一,致使肺血流分布不均,在肺血管收缩较轻或不收缩的部位肺泡毛细血管血流增加,毛细血管压力增高,从而引起压力性肺水肿。也有人强调肺微血管通透性增高的作用。因为患者支气管肺泡洗出液中蛋白质含量较高,并有大量肺泡巨噬细胞,可测得补体C3a、LTB4、TXB2等;尸检可见肺泡水肿、炎性细胞浸润及透明膜形成。但高原性肺水肿不同于其它原因引起的成人呼吸窘迫综合征,前者经休息、氧疗或下山后短期内即可痊愈;而成人呼吸窘迫综合征经治疗往往要数月后才能痊愈。肺内血压高和流速对微血管的切应力(流动的血液作用于血管壁的力与管壁平等方向的分力)可能是导致微血管内皮损伤和血管通透性增高的一个因素。肺水肿影响肺的换气功能,可使PaO2进一步下降。
PaO2过低可直接抑制呼吸中枢,使呼吸抑制,肺通气量减少,导致中枢性呼吸衰竭。
(四)循环功能障碍
严重的全身性缺氧时,心脏可受累,如高原性心脏病、肺原性心脏病、贫血性心脏病等,甚而发生心力衰竭。今以高原性心脏病为例说明缺氧引起循环障碍的机制。
1、肺动脉高压 肺泡缺氧所致肺血管收缩反应可增加肺循环阻力,可导致严重的肺动脉高压。慢性缺氧使肺小动脉长期处于收缩状态,可引起肺血管中膜平滑肌肥大,血管硬化,形成稳定的肺动脉高压。肺动脉高压增加右室射血的阻力。另外,缺氧所致红细胞增多,使血液粘度增高,也可增加肺循环阻力。肺动脉高压可导致右心室肥大,甚至心力衰竭。
2、心肌的收缩与舒张功能降低心肌缺氧可降低心肌的舒缩功能,甚而使心肌发生变性、坏死。(参阅第十四章心血管系统病理生理学)
3、心律失常 严重缺氧可引起窦性心动过缓、期前收缩、甚至发生心室纤颤致死。心动过缓可能为严重的PaO2降低对颈动脉体化学感受器的刺激,反射性地兴奋迷走神经所致。此外,持久缺氧也往往显示副交感优势使心率变慢。期前收缩与室颤的发生与心肌细胞内K+减少、Na+增加使静息膜电位降低、心肌兴奋性增高、和传导性降低有关。缺氧部位的心肌静息膜电位降低,使其与相邻较完好的心肌之间形成电位差,从而产生“损伤电流”,可成为异位激动的起源,严重的心肌受损可导致完全的传导阻滞。
4、静脉回流减少 脑严重缺氧时,呼吸中枢的抑制使胸廓运动减弱,可导致静脉回流减少,全身性极严重而持久的缺氧使体内产生大量乳酸、腺苷等代谢产物,后者可直接扩张外周血管,使外周血管床扩大,大量血液淤积在外周,回心血量减少,使心输出量减少,而引起循环循衰竭。
除以上所述神经系统、呼吸与循环系统机能障碍外,肝、肾、消化道、内分泌等各系统的功能均可因严重缺氧而受损害。
第四节 影响机体缺氧耐受性的因素
年龄、机体的机能状态、营养、锻炼、气候等许多因素都可影响机体对缺氧的耐受性,这些因素可以归纳为两点,即代谢耗氧率与机能的代偿能力。
一、代谢耗氧率
基础代谢高者, 如发热、机体过热、或甲状腺机能亢进的病人,由于耗氧多,故对缺氧的耐受性较低。寒冷、体力活动、情绪激动等可增加机体耗氧量,也使对缺氧的耐受性降低。体温降低、神经系统的抑制则因能降低机能耗氧率使对缺氧的耐受性升高。故低温麻醉可用于心脏外科手术,以延长手术所必需阻断血流的时间。
二、机体的代偿能力
机体通过呼吸、循环和血液系统的代偿性反应能增加组织的供氧。通过组织细胞的代偿性反应能提高利用氧的能力。这些代偿性反应存在着显著的个体差异,因而各人对缺氧的耐受性也很不相同。有心、肺疾病及血液病者对缺氧耐受性低,老年人因为肺和心脏的功能储备降低、骨髓的造血干细胞减少、外周血液红细胞数减少,以及细胞某些呼吸酶活性降低等原因,均可导致对缺氧的适应能力下降。另外,代偿能力是可以通过锻炼提高的。轻度的缺氧刺激可调动机体的代偿能力。如登高山者如采取缓慢的队梯性的上升要比快速上升者能更好地适应。慢性贫血的病人血经蛋白即使很低仍能维持正常活动,而急性失血使血红蛋白减少到同等程度就可能引起严重的代谢机能障碍。
第五节 缺疗与氧中毒
一、氧疗
各类缺氧的治疗,除了消除引起缺氧的原因以外,均可给病人吸氧。但氧疗的效果因缺氧的类型而异。
氧疗对低张性缺氧的效果最好。由于病人PaO2及SaO2明显低于正常。吸氧可提高肺泡气氧分压,使PaO2及SaO2增高,血氧含量增多,因而对组织的供氧增加。但由静脉血分流入动脉引起的低张性缺氧,因分流的血液未经肺泡直接掺入动脉血,故吸氧对改善缺氧的作用不大。
血液性缺氧、循环性缺氧和组织缺氧者PaO2及SaO2正常,因为可结合氧的血红蛋白已达95%左右的饱和度,故吸氧虽然可明显提高PaO2,而SaO2的增加却很有限,但吸氧可增加血浆内溶解的氧。通常在海平面吸入空气时,100ml血液中血浆内溶解的氧仅为0.31ml;吸入纯氧时,要达1.7ml%;吸入3个大气压的纯氧时,溶解的氧可增至6ml%。而通常组织从100ml血液中摄氧量平均约为5ml。可见,吸入高浓度氧或高压氧使血浆中溶解氧量增加能改善组织的供氧。组织性缺氧时,供氧一般虽无障碍,而是组织利用氧的能力降低;通过氧疗提高血浆与组织之间的氧分压梯度,以促进氧的弥散,也可能有一定治疗作用。一氧化碳中毒者吸入纯氧,使血液的氧分压升高,氧可与CO竞争与血红蛋白结合,从而加速HbCO的解离,促进CO的排出,故氧疗效果较好。
二、氧中毒
O2虽为生命活动所必需,但0.5个大气压以上的氧却对任何细胞都有毒性作用,可引起氧中毒(oxygen intoxication)。
氧中毒时细胞受损的机制一般认为与活性氧的毒性作用有关(参阅第十三章缺血与再灌注损伤)。
氧中毒的发生取决于氧分压而不是氧浓度。吸入气的氧分压(PiO2)与氧浓度(FiO2)的关系如公式:PiO2=(PB-6.27)×FiO2,式中PB为吸入气压力(kPa)。6.27(kPa,即47mmHg)为水蒸汽压。潜水员在深50m的海水下作业(PB约为608kPa 即4560mmHg)时,虽然吸入气的氧浓度正常(FiO2=0.21),氧分压(FiO2)却高达126.4kPa(948mmHg),从而可导致氧中毒;相反,宇航员在1/3大气压环境中工作,即使吸入纯氧(FiO2=1),PiO2也仅27.5kPa(206mmHg),不易出现氧中毒。当吸入气的氧分压过高时,因肺泡气及动脉血的氧分压随着增高,使血液与组织细胞之间的氧分压差增大,氧的弥散加速,组织细胞因获得过多氧而中毒。
人类氧中毒有两型:肺型与脑型。
肺型氧中毒 发生于吸入一个大气压左右的氧8小时以后,出现胸骨后疼痛、咳嗽、呼吸困难、肺活量减少、PaO2下降。肺部呈炎性病变,有炎性细胞浸润、充血、水肿、出血和肺不张。氧疗的病人如发生氧中毒,吸氧反而使PaO2下降,加重缺氧,造成难以调和的治疗矛盾,故氧疗时应控制吸氧的浓度和时间,严防氧中毒的发生。
脑型氧中毒 吸入2-3个大气压以上的氧,可在短时内引起脑型氧中毒(6个大气压的氧数分种;4个大气压氧数十分钟),病人主要出现视觉、听觉障碍、恶心、抽搐、晕厥等神经症状,严重者可昏迷、死亡。高压氧疗时,病人出现神经症状,应区分“脑型氧中毒”与由缺氧引起的“缺氧性脑病”。前者病人先抽搐以后才昏迷,抽搐时病人是清醒的;后者则先昏迷后抽搐。对氧中毒者应控制吸氧,但对缺氧病脑病者则应加强氧疗。
附 高原适应不全症(高山病)
Syndrome of Insufficient AltitudeAdaptation (Mountain Sickness)
人未经适应就迅速进入3000米以上高原,或由海拔较低的高原进入海拔更高的地区,加上寒冷气候的影响,或体力负荷过重,而使机体对低氧环境耐受性降低,以致个体适应能力不足,一部分可出现一系列症状和机能代谢变化,称为高原适应不全症。国外习惯用急性高山病和慢性高山病。
我军对高原适应不全症提出了下列分型:
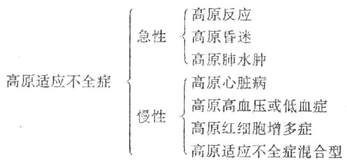
上述分型简明,有利于诊断治疗。但对具体病人来说,常常是混合型,很少是单一的,但在一定阶段可能以某一型为主。
我国幅员辽阔,海拔3000米以上的高原、高山地区,约占全国总面积的六分之一。这些地区大多分布在边疆省区,具有重要的国防意义。高原地带气候多变,寒冷、风大、空气稀薄,对人体构成了一个特殊的自然环境。其中空气稀薄,大气压和氧分压降低,是高原环境对机体影响的主要因素。
在高原地区世居的少数民族,对高原环境已经适应,但一般人口稀少,对这些地区的经济建设需要内地支援。我军有守卫边疆的任务,内地人员进入高原地区日渐增多,因此如何保证进入高原的人员健康,我是军卫生工作的重要任务。
在海平地区,空气在每平方厘米上所形成的压力为101.3kPa(760毫米汞柱),在干燥空气中氧占20.40%,故氧分压为21.15kPa(159毫米汞柱)。空气中氧所占比例基本不受高原影响,当大气压力因海拔增高而降低时,则氧分压按比例降低。下面选择几个不同高度的大气压和氧分压的改变列表如下(表3-2)。
初抵3000米以上高原地区,由于大气压中氧分降低,肺泡气和动脉血氧分压也相应的降低,毛细血管血液与细胞线粒体间氧分压梯度差缩小,从而引起缺氧。如果逐渐登高,有一个锻炼适应过程,在低氧分压环境中,机体可发生一系列代偿适应性变化,如通气加强,肺泡膜的弥散能力提高;循环功能加强,输送氧的能力增加;红细胞和血红蛋白含量增加,红细胞中2,3-二磷酸甘油酸增多,氧离曲线右移,通过这些代偿作用,以便使组织可利用氧达到或接近正常水平。机体具有一定的适应能力,可以较长期居住高原地区。一般地说,长期居住可适应的最大高度为5000米。但有人适应能力较弱,在5000米以下一定高度就失去了适应能力,而出现高原适应不全症。
在高原地区除了大气压降低对机体的主要作用,还有气候的影响,如寒冷、大风、雨雪以及紫外线照射等。这些因素降低机体适应能力,往往是高原适应不全症的诱发和加重因素。因此在相同高度的不同地区,由于气候不同,因而引起高原反应的发病率也不一样。
表3-2 不同的海拔高度大气压和氧分压的改变
| 高度 |
大气压 kPa |
氧分压 kPa |
| 英尺 |
米 |
| 0 |
0 |
101.31(760.0mmHg) |
21.15(159.0mmHg) |
| 10,000 |
3,048 |
69.51 (522.6mmHg) |
14.55(109.4mmHg) |
| 17,000 |
5,182 |
52.59(395.4mmHg) |
11.01(82.8mmHg) |
| 20,000 |
6,097 |
46.44(349.2mmHg) |
9.72(73.1mmHg) |
| 23,000 |
7,010 |
40.88(307.4mmHg) |
8.57(64.4mmHg) |
| 26,000 |
7,925 |
35.88(269.8mmHg) |
7.51(56.5mmHg) |
| 28,000 |
8,534 |
32.82(246.8mmHg) |
6.88(51.7mmHg) |
| 33,000 |
10,058 |
26.12(196.4mmHg) |
5.47(41.7mmHg) |
三、急性高原适应不全症
(一)高原反应
从海平面地区进入高原地区以后,在不同的高度,人群中有些可出现一系列不适反应,如头痛、头昏、失眠、乏力、四肢发麻、眼花、耳鸣;重的可发生食欲不振、恶心、呕吐、胸闷、呼吸困难、心慌、浮肿等症状,称为高原反应。多数人在两周内由于代偿适应功能的建立,症状可自行消失。
这些人发病较快,如无合并症恢复也较快,一般3~5天即可恢复。也有少数人持续数月而不恢复的。
初入高原的人到海拔1000米以上就有人发病,随着高度增加,发病率增高。下面是一部分人群从海拔1000米处出发到5000米高度,高原反应发病率的情况(图3-6)。一般在3500米以下发病率占37~51%,3600~5000米发病率占50%。有一个单位在3000米居留一段时间,再登高,抵达4500~5000米时才有一些人发生高原反应。
急性高原反应的发生率与个体代偿适应能力和预先有无锻炼有关。
在代偿适应反应中主要是通过肺泡能气量增加,以增加肺泡气氧分压;并通过加强血液对氧的输送和增加组织对氧的利用。高原反应的人主要是这几个环节的代偿能力低下或发生障碍所致。
因肺泡有水蒸气和较高的CO2分压,再加上氧的弥散入血,肺泡气与大气氧分压有一个很大的梯度差(表3-3)。
在海平地区,大气→肺泡气→动脉血→混合静脉血的氧分压之间的梯度差较大。而进入高原,抵达5791米高度时,它们之间的梯度差变小。例如,在海平大气氧分压为21.15kPa(159毫米汞柱),肺泡氧分压为13.83kPa(104毫米汞柱),相差7.32kPa(55毫米汞柱);而登高抵达5791米处,大气氧分压为10.64kPa(80毫米汞柱),肺泡氧分压为5.99kPa(45毫米汞柱),只相差4.66kPa(35毫米汞柱)(图3-7)。此时大气与肺泡气氧分压差变小,主要是由于代偿性通气增加的结果。
通气增加是机体在高原的代偿适应的重要环节,主要通过呼吸加深来实现的,呼吸频率增加不明显(表3-4)。由于呼吸加深,每分肺泡通气量增加,以提高肺泡气分压。
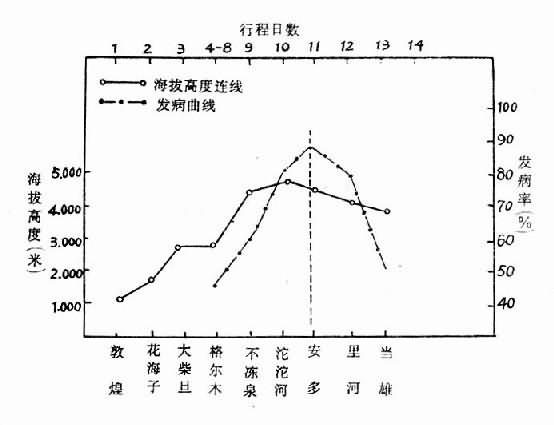
图3-6 高原反应发病率与行程
─·海拔高度·─·─·发病率
表3-3 在海平地区呼吸过程中各部分气体分压变化
| 气体分压(kPa) |
大气 |
吸入气 |
肺泡气 |
呼出气 |
动脉血 |
混合静脉血 |
| 氮 |
79.40 |
74.93 |
75.68 |
75.28 |
76.21 |
76.21 |
| 氧 |
21.15 |
19.86 |
13.83 |
15.96 |
13.30 |
5.32 |
| 二氧化碳 |
0.04 |
0.04 |
5.32 |
3.59 |
5.32 |
6.12 |
| 水蒸气 |
0.49 |
6.25 |
6.25 |
6.25 |
6.25 |
6.25 |
| 总 量 |
101.08 |
101.08 |
101.08 |
101.08 |
101.08 |
93.90 |
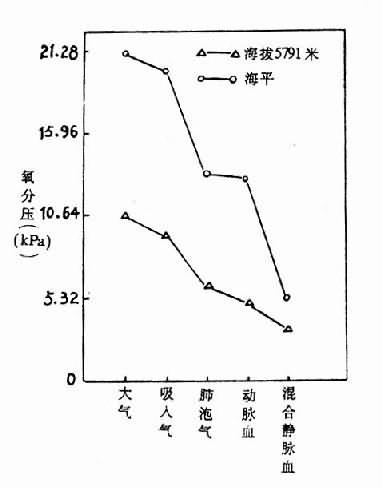
图3-7 在海平和5791米高度时氧分压的变化
表3-4 在不同高度每分通气量和呼吸频率的变化
| 高度(米) |
每分通气量(升) |
每分呼吸次数 |
| 海平地区 |
8.85 |
12 |
| 3658 |
9.71 |
12 |
| 5486 |
11.06 |
12 |
| 6706 |
15.31 |
15 |
发生高原反应的人,常常对低氧环境代偿反应较弱,没有明显的呼吸加深,因此每分通气量增加不多。由于这些人代偿适应反应弱,因此登高到一定高度,缺氧症状比较严重。目前有人认为,可用减压舱测定人群每分通气量变化,作为预测人群地高度适应的能力。
呼吸加深,可提高肺泡膜弥散功能,使肺泡氧进入肺泡壁毛细血管增加。我国健康成人静息时氧的弥散量为23毫升/0.133千帕(1毫米汞柱)/分,每分钟约有250毫升的氧弥弥散入血,供组织代谢需要。缺氧时,由于呼吸加强,参与气体交换的肺泡数增多和肺泡容量增加,同时开放的肺毛细血管数也增多和毛细血管扩张,这样就增加了肺泡—毛细血管膜弥散面积,血液从肺泡摄取较多的氧。如果这种代偿能力弱,可促使高原反应发生。
缺氧时,向组织输送氧的能力提高。正常人在海平地区安静状态下,平均每分种100毫升血给组织输送约为5毫升氧,正常心脏每分输出量约为5000毫升,那么每分钟就有250毫升氧输送给组织。在高原地区,一方面心脏活动增强,每分输出量增加,组织血流量增多;另一方面,红细胞数和血红蛋白增多,增强携带氧的能力。这样在一定限度内可以补偿组织代谢对氧的需要。如果这种代偿适应能力降低或尚未建立起来,也易发生高原反应。
初进高原,由于呼吸加强,二氧化碳排出过多,还可引起低碳酸血症和呼吸硷中毒。PaCO2降低,可引起脑血管收缩,部分抵销缺氧引起脑血管扩张的反应,容易发生意识丧失。
(二)高原昏迷
进入高原地区较高高度,有少数人可发生昏迷。在昏迷发生前,常有头痛、头晕、呕吐等症状。昏迷发生后常出现阵发性抽搐,大小便失禁,病人瞳孔常缩小而固定,或忽大忽小;少数病例有肢体强直或肢体弛缓性瘫痪。1/5的病例眼底有小动脉痉挛,静脉扩张,视网膜乳头水肿。
高原昏迷常在3500米以上的高度发生。根据67例发病高度统计,3500~4000米发病11.9%,4000~4500米发病28.4%,4500~5110米发病59.7%。一般进入高原后1~10天内发病。
高原昏迷发生的机理,主要是由于缺氧(见缺氧时中枢神经系统的变化)。早期可能由于缺氧,氧化过程障碍,能量供应减少,而致脑细胞功能降低。正常脑内ATP贮存量很少。ATP是推动“钠泵”的能源。ATP减少。“钠泵”作用减弱,则钾与钠离子在细胞内、外的浓度差减小,膜电位降低。人吸入含8%氧的混合气体3~5分钟,脑电就出现每分钟2~7次的慢波。高山运动员在减压舱内,当减压到相当于9000米高度大气压力时,脑电α波减少,慢波增多,出现神经细胞功能抑制现象。
缺氧进一步加重,ATP形成更加减少,不能维持细胞内外离子浓度差,细胞内钠离子增多,氯也进入细胞内,水随之进入增多,发生细胞内水肿。大白鼠实验性缺氧,有4~6%的大白鼠发生细胞内水肿。1962年印度士兵急性高山病死亡率病例中,3/4有脑水肿病变。
除神经细胞水肿外,神经胶质细胞和血管内皮细胞也发生水肿。毛细血管和小静脉周围神经胶质细胞水肿,可以压迫血管;血管内皮细胞水肿,有的呈疱疹状向管腔突出或脱落,使血管腔狭窄或堵塞,造成脑微循环障碍,缺氧和脑水肿进一步加重。
严重缺氧,还可引起呼吸中枢兴奋性降低,二氧化碳排出减少,动脉血二氧化碳分压升高。二氧化碳分压升高和缺氧,可使脑血管失去自家调节,而引起脑血管扩张,血流量增加,毛细血管流体静压和通透性升高,组织间液和脑脊液生成增多。有的实验证明,动脉血二氧化碳分压升高到6.65kPa(50mmHg),脑脊液平均增加55%,脑脊液压力由正常0.69~1.78kPa(70~180毫米水柱)升高到2.82kPa(285毫米水柱)。在西藏地区高原昏迷病人,有人测定过10例脑脊液,其中7例脑脊液压力升高。
脑水肿(包括细胞水肿和间质水肿)和脑脊液增多,使颅内压升高超过3.96kPa(400毫米水柱),可压迫脑的小血管,动脉血灌流明显减少。高原昏迷的许多临床症状是由于缺氧和颅内压升高所引起的。
(三)高原肺水肿
高原肺水肿发病率较高。一般由海平地区初入高原或重返高原一周内发病。据218例高原肺水肿发病与高度的关系统计,3500~4000米,占28.3%;4000~4500米,占34.4%;4500~5100米,占37.3%。
高原肺水肿发病急骤,临床症状除有一般高原反应症状外,所有患者均有不同程度的咳嗽,开始为干咳或有少量痰,以后即咳出均匀混合、稀薄的粉红色或白色泡沫痰。呼吸急促,有时每分钟高达30~40次。病人惊恐不安,心慌、胸闷、紫绀、两肺满布湿罗音。
高原肺水肿的主要病理变化是广泛的呈片块状分布的肺泡水肿,偶而可见透明膜形成(这是肺泡水肿液中的纤维蛋白沉积所致)。肺水肿最早在血管周围间隙形成(间质水肿),当这些间隙扩张,压力超过了肺泡压,则液体进入肺泡。微动脉和毛细血管充血,偶而可见血管周围有出血。
高原肺水肿发生机理目前还不清楚。以往推测可能是肺静脉压升高,肺毛细血管通透性增加。近年来应用心导管直接测定肺动脉压、楔压(wedge pressure)、肺静脉压和左心房压力,发现高原肺水肿病人动脉压升高,楔压正常或降低,肺静脉压和左心房压力正常。因此可以排除左心衰竭或肺静脉收缩而引起高原肺水肿的论点。
高原性缺氧引起肺动脉压升高,已为许多研究所证实,随着高度增加,肺动脉压也增加(图3-8)。在单纯性缺氧,肺泡氧分压降到7.98kPa(60mmHg)以下,也引起肺动脉压升高。曾进高原患过高原的肺水的人,肺动脉对缺氧敏感性升高,则很快发生肺动脉高压。Hultgren观察了5例曾患过高原肺水肿的人,在海平地区,安静时的肺动脉压平均为1.84kPa(13.8mmHg),肺泡气氧分压降到5.99kPa(45mmHg),肺动脉压平均为3.06kPa(23mmHg),有两例高出正常的范围(图3-9)。高原肺水肿的发生与肺动脉压升高有关,但是肺动脉压升高是如何引起肺水肿的,现在还不清楚。有人推测肺动脉收缩是区域性的,高山缺氧时可能引起一部分肺动脉收缩,另一些小动脉尚未收缩,则肺的血流大量进入肺动脉尚未收缩的区域,因此这些局部的微循环中血量增多,流体静压增加,液体向血管周围间隙转移增多,当组织间液生成增多超过淋巴液回流量,则引起肺水肿。所以高原肺水肿在X线下看到的往往呈片块状分布。
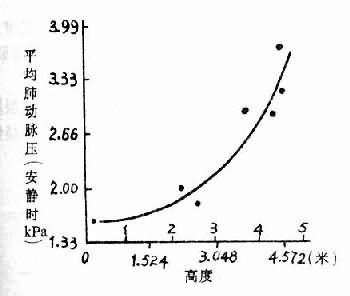
图3-8 不同高度肺动脉压的变化
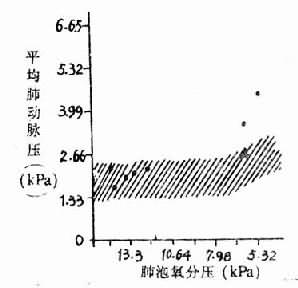
图3-9 人缺氧时肺动脉压的变化
肺微循环有旁路,从小动脉发出分枝直接进入毛细血管静脉端(图3-10),称为前终末微动脉(preterminal arteriole),正常是闭合的。当肺微动脉收缩时,则此旁路开放,血液从小动脉直接进入毛细血管静脉端,血量增加,压力增高,液体渗出增多。由于这些血液没有进行气体交换,故动脉血氧分压急剧下降。
高山缺氧还引起外周静脉收缩,回心血量增加,肺血量增加,Wood测定前臂肢体容积,推测静脉容量。在海平地区前臂肢体容积测定溢出水量平均为4.4毫升;登山到3596米时,第三下降到3.4毫升,表明有静脉收缩。而高原肺水肿病人降到2.5毫升。周围静脉收缩,中心血量增多,可能是促进肺水肿发生的一个因素。
此外,缺氧可使肺毛细血管通透性升高,也是引起肺水肿的重要因素。
四、慢性高原适应不全症
慢性高原适应不全症包括高原心脏病、高原血压或低血压和高原红细胞增多症。有的是高原心脏病、高原高血压和高原红细胞增多症三型中有两型以上并存的混合型。
(一)高原心脏病
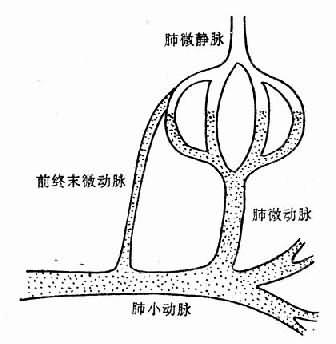
图3-10 肺小动脉与肺毛细血管静脉端的交通支—前 终末微动脉
久居高原地区的人,有少数(特别是儿童)逐渐出现心悸、气喘、胸闷、浮肿、右心室增大等现象,可考虑有高原心脏病的可能。X线检查:肺动脉圆锥突出,右肺下动脉增宽。心电图图形;右心肥厚,电轴右偏,有时出现肺型P波。
高原心脏病的发生,多数人认为是由于高原缺氧,肺小动脉持续收缩,引起肺小动脉肌层肥厚,管壁增厚,管腔狭窄,阻力增加,而使肺动脉压持续升高(表3-5),加重右心室负担。慢性缺氧,还使红细胞生成增多,血液粘滞性增加,又加重心脏的负担。
表3-5 慢性高原适应不全症人与高原居民右心和肺动脉压比较
| 慢性高原适应不全症(Monge氏病) |
高原世居者 |
海平正常人 |
|
| 右心房平均压(kPa) |
0.52(3.9mmHg) |
0.39(2.9mmHg) |
0.35(2.6mmHg) |
| 右心室平均压(kPa) |
3.86(29mmHg) |
2.00(15mmHg) |
1.20(9mmHg) |
| 肺动脉(收缩压、舒张压、平均压)kPa |
8.51(64mmHg) |
4.52(34mmHg) |
2.93(9mmHg) |
| 4.39(33mmHg) |
1.73(13mmHg) |
0.80(6mmHg) |
| 6.25(47mmHg) |
3.06(23mmHg) |
1.60(12mmHg) |
| 肺动脉楔压(kPa) |
0.76(5.7mmHg) |
0.92(6.9mmHg) |
0.82(6.2mmHg) |
有人比较高原习服的人和高原心脏病患者的右心室功和心脏指数,证明高原心脏病患者心脏负担加重(表3-6)。
表3-6 高原习服的人和高原心脏病患者的右心室功
和心脏指数比较(五例的平均数)
| 高原习服者 |
高原心脏病者 |
|
| 心脏指数(升/分/米2) |
3.83 |
4.01 |
| 右心室功(公斤-米/分/米2) |
1.08 |
2.47 |
长期肺动脉压升高,心脏负担加重,将引起右心室代偿性肥大,最后可发展为右心衰竭。但也有少数病例是以右心衰竭为主的全心衰竭。
(二)高原高血压和高原低血压
进入高原以后,部分人发生头痛、头昏、失眠等症状,血压持续在18.62/11.97kPa(140/90毫米汞柱)以上,返回平原,血压又恢复,称为高原低高血压。高原高血压的特点是以舒张压升高为主,超过11.97kPa(90毫米柱),收缩压略有升高或在正常范围内,因而脉压变小。
高原高血压的发生机理,可能是由于缺氧使大脑皮层对皮层下枢的调节功能减弱,血管运动中枢兴奋性升高,通过交感神经兴奋和肾上腺素分泌增多,引起小动脉收缩;另外,红细胞增多,血液粘滞性升高,也是引起外周阻力增加的一个因素。
进入高原后,还有少数人血压降到11.97/7.98kPa(90/60毫米汞柱)以下,并伴有头昏、眩晕、乏力等症状,称为高原低血压。高原低血压以收缩压降低为主。其发生机理不清楚,可能因缺氧,植物神经功能紊乱,迷走神经张力增加,引起心动缓慢和外周阻力降低;也有人认为,缺氧通过某些生理活动性物质的作用,使小动脉平滑肌紧张性降低。
(三)高原红细胞增多症
进入高原后,红细胞数超过650万/立方毫米,血红蛋白超过20克%,血红细胞压积超过65%,并伴有紫绀、头痛、头昏、乏力、呼吸困难等,称为高原红细胞增多症。
红细胞和血红蛋白增多,是机体对缺氧的代偿适应性变化,进入高原后可以很快出现,以进入高原后6~14天最明显,一般持续6~8个月,开始血量不增加,以后血量有所增加(图3-11)。组织缺氧,肾脏产生促红细胞生成因子(erythrogenin)增多,使血浆中促红细胞生成素原(erythropoietinogen)变为促红细胞生成素(erythropoietin),刺激骨髓红细胞生成增多,结果单位容积血液内红细胞数和血红蛋白量增加。

图3-11 登山以后不同时期血液的变化
Ⅰ在4000和5791米处停留8周后
Ⅱ在5791米处停留3~6周后
Ⅲ在5791米处停留9~14周后
高原红细胞增多症的发生机理,可能是:
1、在慢性缺氧条件下,中枢化学感受器对二氧化碳的敏感性和主动脉体与颈动脉体对缺氧的敏感性降低,不能充分发挥呼吸的代偿功能,肺泡通气量增加不明显,肺泡氧分压降低。
2、血中二氧化碳分压和红细胞内2,3-二磷酸甘油酸高于同一高度的健康居民,氧离曲线右移(图3-11),血红蛋白对氧亲和力降低,血液从肺摄取的氧减少,更加重缺氧,使得红细胞生成更多。