*本信息仅供医疗卫生专业人士和诺和诺德员工阅读。

2021年,胰岛素将迎来它的百岁庆典。胰岛素的发现改变了全球数百万人的生活,挽救了几代人的生命,我们将用4期内容回顾人类医学史上这一伟大成就。
上一期 (回首百年-胰岛素发展简史)我们回顾了胰岛素的发现和胰岛素制剂发展的历史。自上世纪二十年代胰岛素被发现后,关于其合成分泌过程、如何发挥生理作用以及如何降解消除等生理学过程的研究从未停止,帮助人们逐渐深化了对胰岛素及糖尿病的认知。
胰岛素仅由51个氨基酸构成,但在人体内发挥着至关重要的作用。本期我们将基于Journal of Cell Biology发表的一篇经典综述1,带领大家一起回顾胰岛素这个小巧而不凡的分子在人体内经历了怎样的奇妙旅程。
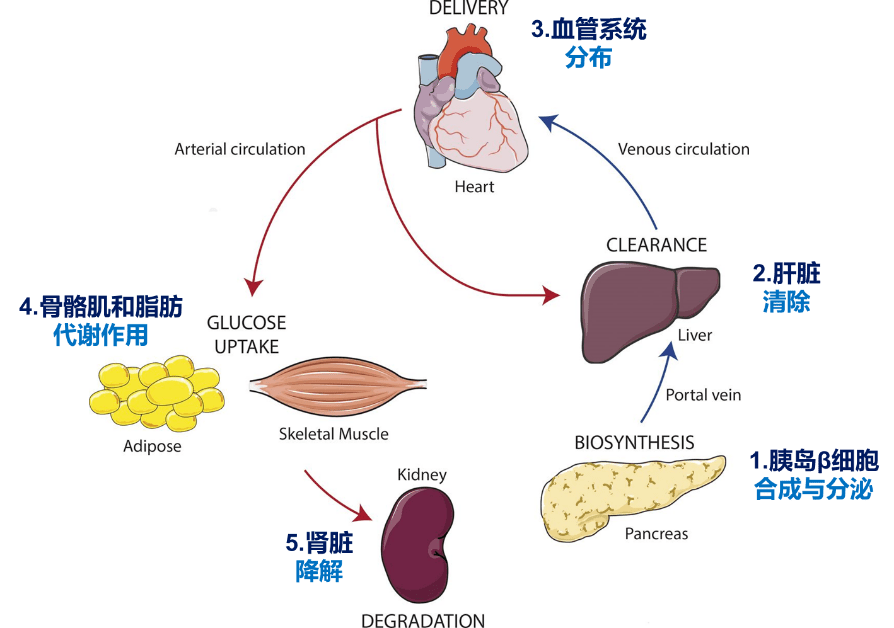
胰岛素在人体内的“五部曲”
始发站:胰岛β细胞中的合成与分泌
啮齿类动物有两个胰岛素基因ins1 和ins2 ,而人类只有 唯一一个胰岛素编码基因 INS ,位于第11 号染色体,其转录受到多个上游调控元件的控制,包括PDX1 、MafA 和NeuroD1 等,胰岛β细胞可以响应葡萄糖和其它胰岛素分泌调控信号,通过上述元件控制胰岛素基因的表达。
INS基因首先被转录翻译为单链分子 前胰岛素原( preproinsulin),随后24个氨基酸的信号序列被信号肽酶切割后成为 胰岛素原( proinsulin)。在粗面内质网中,胰岛素原被折叠成稳定的3D构象——通过二硫键将A链结构域和B链结构域连接起来。转运至高尔基体后,正确折叠的胰岛素原会被包装为未成熟的分泌颗粒,并通过激素原转化酶PC1/3和PC2将C肽切掉——因此C肽总是与胰岛素以等摩尔量释放。随后,羧肽酶E将肽链C端的碱性氨基酸去除,产生了由二硫键连接A链和B链所构成的 成熟胰岛素。
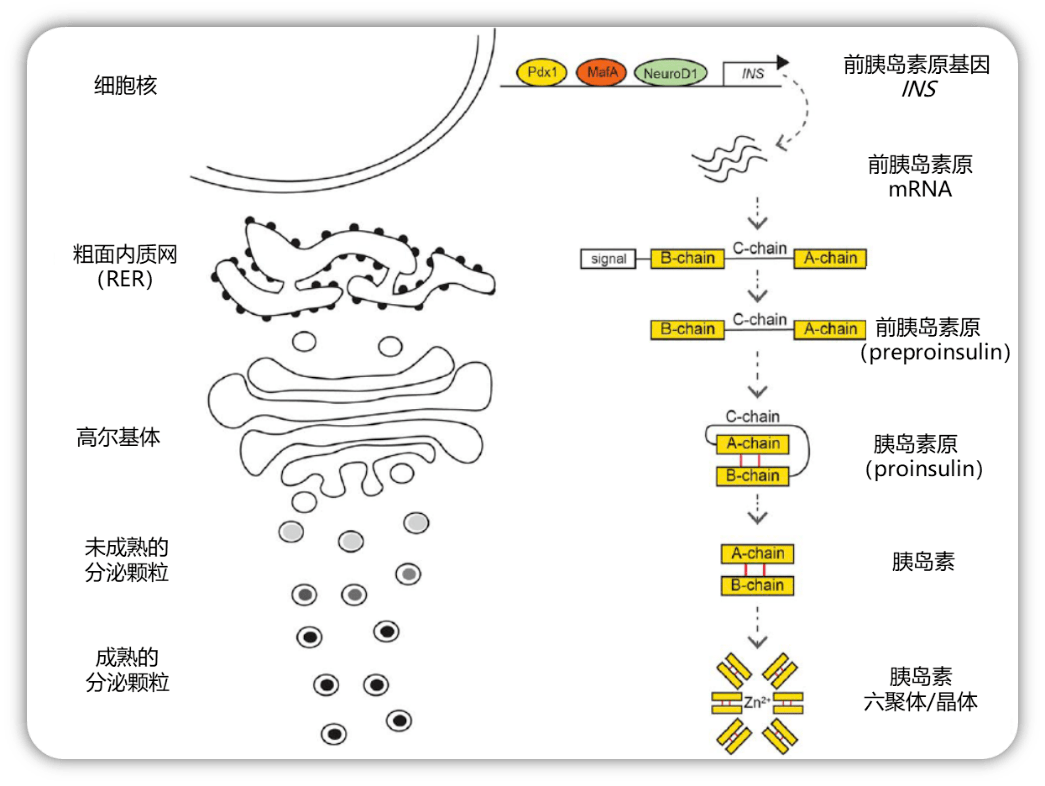
胰岛素的合成和分泌过程
以这种方式进行的胰岛素生物合成快速(不到2 小时)且高效,合成的胰岛素单体与锌离子(Zn 2+ )偶联形成胰岛素六聚体,包装在成熟的分泌颗粒中。β细胞中估计有上万个胰岛素分泌颗粒,其中大部分位于与细胞膜有一段距离的胞浆中,后续需要转运到细胞膜上再释放;少部分沿细胞内微管网络移动到细胞膜附近,等待细胞内的钙离子信号“蓄势待发”。这可能解释了 葡萄糖诱导胰岛素呈现“双时相分泌”的模式,早相或第一时相分泌由已经装载在细胞膜上的分泌颗粒产生,持续约10 分钟;随后的第二时相分泌,则需要经过肌动蛋白的重组,将储存的颗粒补充到细胞膜。
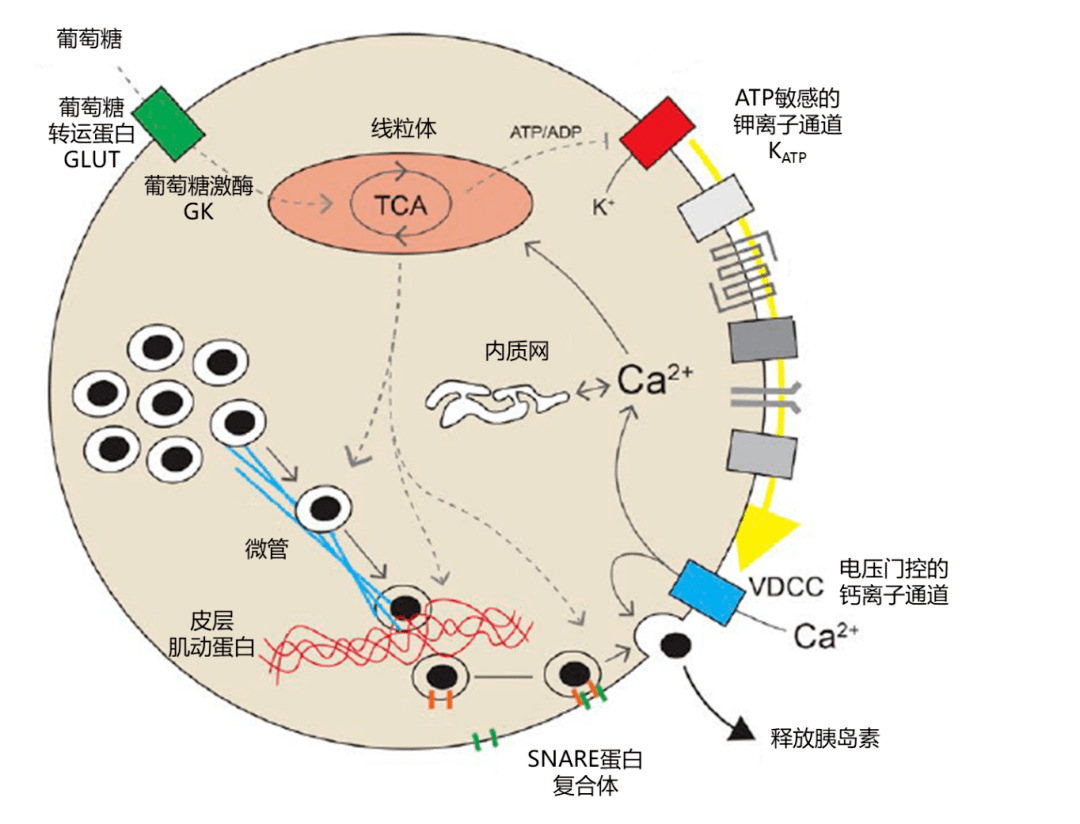
葡萄糖诱导的胰岛素分泌过程
葡萄糖是引发胰岛素分泌最重要的代谢信号。葡萄糖通过β细胞膜上的葡萄糖转运蛋白(GLUT )进入细胞,被葡萄糖激酶(GK )迅速磷酸化,生成6- 磷酸葡萄糖,进入三羧酸循环生成ATP ,胞浆中ATP/ADP 比例升高,抑制ATP 敏感的钾离子通道(K ATP )使β细胞膜去极化,从而将化学信号转为电信号。细胞膜去极化开放电压门控的L 型钙离子通道(VDCC ),使得Ca 2+ 进入细胞,触发胰岛素分泌颗粒运动并与细胞膜融合,通过胞吐作用将胰岛素分泌出来——电信号再次转为化学信号。
仅仅一个胰岛素合成与分泌的过程,就包含了如此复杂而精巧的步骤,并且受到机体的严格调控。当β细胞将胰岛素释放到胰腺的间质中,周围有空隙的内皮血管系统使胰岛素能够轻松通过门脉系统,直接到达肝脏发生“首过(first pass)”消除。
肝脏:胰岛素循环的“看门人”
胰岛素从β细胞分泌后,在旅程中到达的第一站是肝脏。因此,相较于其它靶组织如肌肉和脂肪,肝脏会暴露于更高浓度的胰岛素。
肝脏在胰岛素循环中起到“看门人”的作用,可以调节到达外周组织的胰岛素量。在人体研究中发现,经门静脉到达肝脏的胰岛素有大约50% 被肝脏“首过”消除,而通过体循环第二次经过肝脏后又会被降解25% ,因此体循环中的胰岛素浓度大约为门静脉的1/3 。肝脏对胰岛素的降解是可调节的,例如,在发生胰岛素抵抗时,肝脏胰岛素清除率可以适应性地降低,从而弥补胰岛素敏感性的下降。
门静脉循环将胰岛素递送到肝血窦的毛细血管中,这些毛细血管没有基底膜,并且内皮细胞上有孔隙,允许血液与周围肝细胞之间进行物质交换。肝血窦的这种特殊结构使得胰岛素容易从循环中扩散到窦周空间,与肝细胞发生接触,肝细胞是胰岛素清除的主要部位。
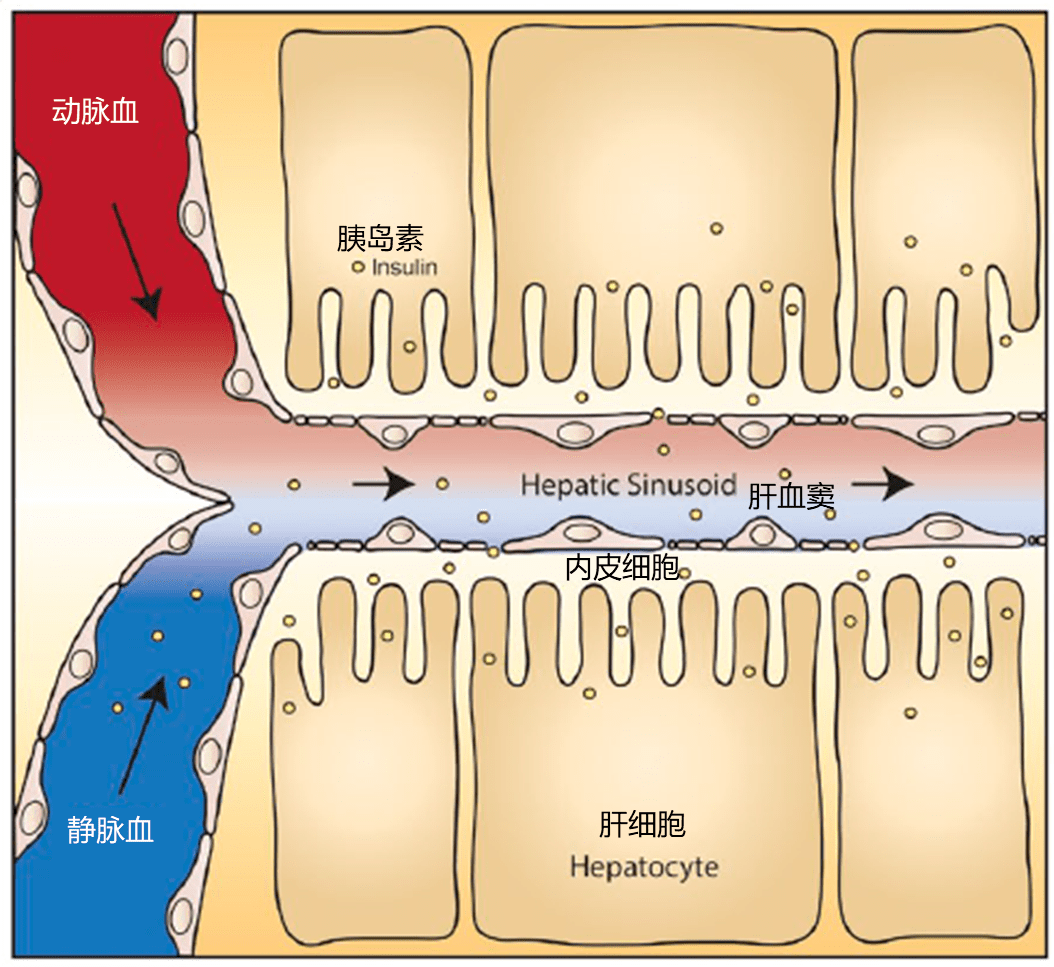
胰岛素通过肝血窦进入肝细胞
肝脏不仅是循环胰岛素调节的“看门人”,也是胰岛素发挥代谢调节作用的重要器官。胰岛素在肝脏的主要作用是抑制糖异生和糖原分解,促进糖原、蛋白质、长链脂肪酸和甘油三酯的合成代谢。
没有被肝脏降解的胰岛素会通过肝静脉回流到心脏,后者将胰岛素泵入动脉循环并到达其靶组织,包括骨骼肌、脂肪组织和肝脏等。如前所述,通过肝动脉进入肝脏的胰岛素会发生第二次清除,大约占循环胰岛素总量的25%。
胰岛素与脉管系统的相互作用
胰岛素经静脉回流到心脏,再经由体循环动脉系统分布到全身,到达外周靶组织前,胰岛素首先作用于脉管系统,通过内皮细胞发挥其血流动力学效应,从而促进血液流动,将其运送到外周组织。
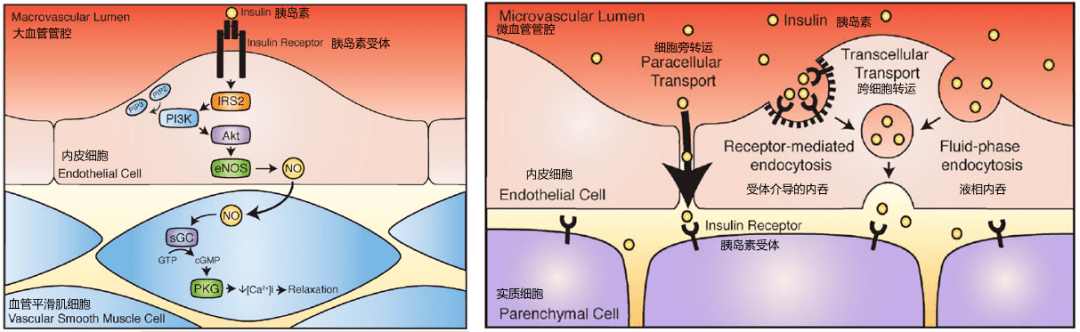
胰岛素在大血管和微血管的作用
在大血管(如主动脉、大动脉)中,胰岛素作用于内皮细胞的胰岛素受体,主要通过胰岛素受体底物2 (IRS-2 )磷酸化激活PI3K-Akt 信号通路,后者可以活化内皮型一氧化氮合酶(eNOS ),催化L- 精氨酸转化为一氧化氮(NO )。NO 是最重要的内源性血管舒张因子,可以迅速扩散到血管外层的平滑肌细胞,导致血管舒张。毛细血管前小动脉的舒张使得真毛细血管网灌注增加,即胰岛素的“毛细血管动员(capillary recruitment )”作用,保证胰岛素能够顺利递送到组织中发挥作用。
一旦到达了骨骼肌和脂肪细胞的微血管,胰岛素需要离开循环系统,进入实质细胞(肌细胞和脂肪细胞)发挥作用。与肝脏不同(肝血窦内皮细胞上有孔隙),骨骼肌和脂肪组织的毛细血管内皮是连续的,在血液循环和组织间隙之间起到严密的屏障作用,限制了内容物的通过。胰岛素是如何通过紧密连接的毛细血管内皮,目前尚有争议,可能的途径包括两条:一种是细胞旁转运,另一种是跨细胞转运(包括受体介导方式和液相内吞方式)。
胰岛素在靶器官发挥作用
胰岛素在外周组织中发挥多种作用,其中最重要的是调节葡萄糖及其它营养物质的代谢。前文介绍了胰岛素在肝脏中的作用;在脂肪细胞中,胰岛素介导GLUT-4 将葡萄糖转运至细胞内生成3- 磷酸甘油和脂肪酸,以此为底物合成甘油三酯;在肌肉组织中,胰岛素介导GLUT-4 将葡萄糖转运至细胞内,促进肌糖原合成,同时促进氨基酸的摄取以及蛋白质合成。肌肉和脂肪细胞的GLUT-4 在胞浆中的内体和细胞膜之间循环,控制葡萄糖的摄取。在未受到刺激的情况下,只有不到10% 的GLUT-4 分子存在于细胞膜表面2 。胰岛素促进GLUT-4 向细胞膜表面募集,使葡萄糖摄取迅速增高。
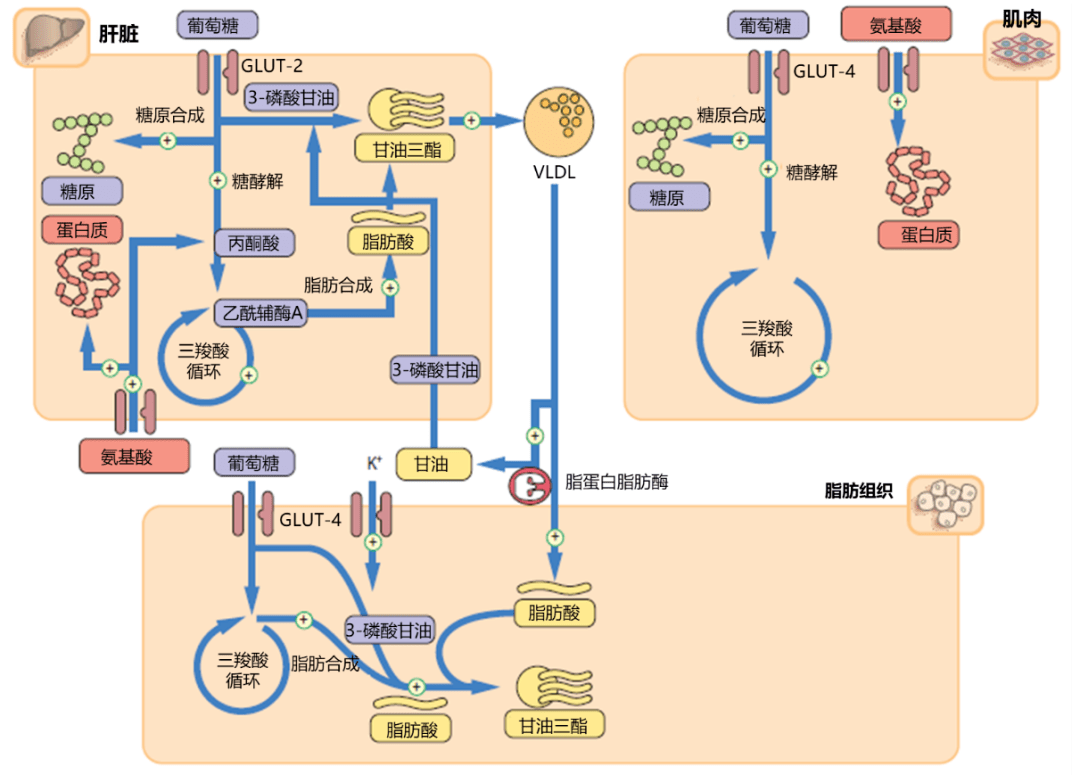
胰岛素在肝脏、脂肪组织和骨骼肌中的主要生理作用 2
除了肝脏、脂肪和骨骼肌这三个胰岛素作用的经典靶器官以外,近年来研究发现胰岛素还可以作用于一些非经典的靶器官,例如脑、心肌和巨噬细胞等。脑内胰岛素主要来自于外周血液循环,其水平远低于血液循环中的水平,但两者密切相关。胰岛素为大分子肽段,很难通过被动扩散的方式通过血脑屏障,但是外周胰岛素可通过选择性、载体介导的转运系统,经血脑屏障进入脑组织;在脉络丛处,血脑屏障上皮细胞和内皮细胞缺乏紧密连接,外周胰岛素通过扩散的方式经血-脑脊液屏障进入脑组织。胰岛素受体在脑的神经元和胶质细胞中广泛表达。不同脑区的生理功能各不相同,因此胰岛素可通过与不同脑区的胰岛素受体结合发挥相应的稳态调节、进食控制、记忆形成等调控作用。
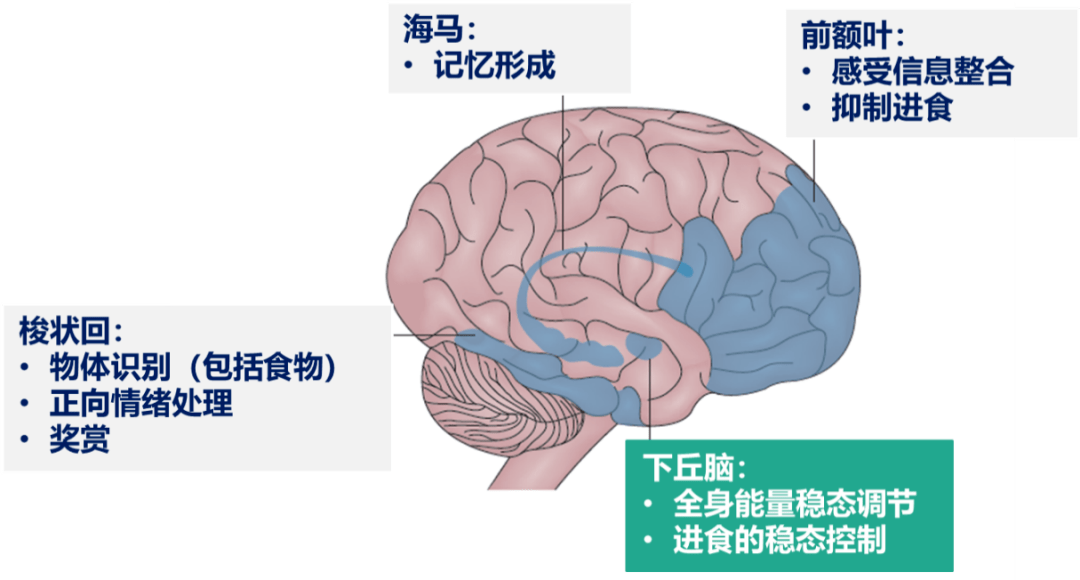
胰岛素在大脑中的应答区域及功能 3

胰岛素旅程的终点站:肾脏中降解
胰岛素在循环中的半衰期约为6分钟,从胰腺释放大约30 分钟后在循环中不再被检测到。50% 的胰岛素经肝脏“首过”消除,第二次经过肝脏时再次清除25% ,体内大多数组织细胞(主要是骨骼肌和脂肪细胞)可以内化(internalized )胰岛素并使其进入溶酶体降解。最终,循环中残留的胰岛素进入肾脏,并可能在这里走向三条不同的道路。
经肾小球滤过后,胰岛素进入肾小管管腔,被近端肾小管刷状缘的上皮细胞重吸收,这种重吸收并非由胰岛素受体介导,而是通过一些清除受体(例如megalin 和cubilin )介导的内化过程。进入细胞后胰岛素从结合位点解离,进入溶酶体降解,这是第一条途径。
第二条途径主要发生在肾曲小管,胰岛素与肾小管上皮细胞上的胰岛素受体结合进入细胞,调控肾小管对钠、磷以及葡萄糖的重吸收,而后在细胞内降解。有证据显示,肾脏通过这两条机制内化和清除的胰岛素量为每天大约6-8U 。
大部分在肾脏被细胞内化的胰岛素通过上述途径降解,但是还有一小部分可以通过逆胞吞作用(retroendocytosis )重吸收进入循环,这是最后一条途径。
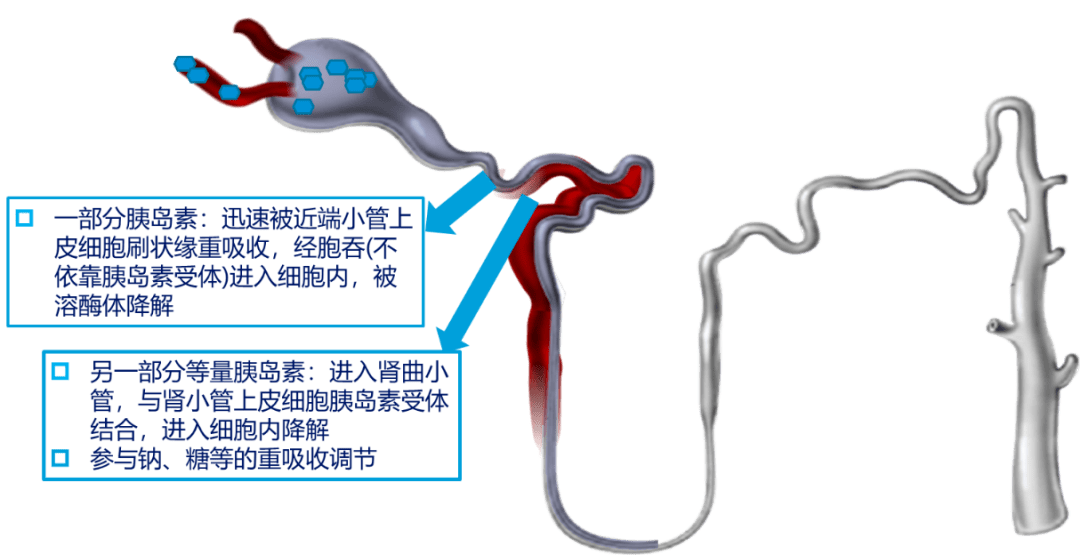
胰岛素在肾脏降解的两条途径
总 结
生理性胰岛素在β细胞中合成,首先进入门静脉循环,在肝脏“首过”消除;而后回流到心脏,被心脏泵入体循环,到达靶器官发挥作用并被内化降解,最终剩余的部分进入肾脏降解消除。这些步骤之间并非相互独立,例如,β细胞以脉冲的形式分泌胰岛素,门静脉也以大约每五分钟一次的频率将胰岛素从胰腺输送到肝脏进行清除;胰岛素舒张血管的作用,使其自身能够被运送到组织中发挥作用等等。尽管我们已经对胰岛素体内之旅的各段旅程有了深入的研究和理解,但是仍有很多疑问亟待解答。对生理过程的研究也有助于对疾病状态的理解,以寻找可能的干预手段和治疗靶点。
参考文献
2. Medical Biochemistry. CHAPTER 31-Glucose Homeostasis and Fuel Metabolism:Diabetes Mellitus.
3. Nat Rev Endocrinol. 2015 Dec;11(12):701-11.